2型糖尿病患者体位性低血压的发生率及其影响因素
姜涛,卢桂阳,宋秀霞,姚晓爱
体位性低血压(OH),国内外多项研究表明,OH不仅在糖尿病、高血压、老年人群中有很高的发生率,且其除了增加患者行走困难、摔倒、骨折、晕厥的风险外,还明显增加急性冠状动脉(冠脉)事件、脑卒中及全因死亡等风险[1~5]。目前,在我国的临床工作中,对于OH高发生率和危害尚缺乏足够的认识,糖尿病人群OH的调查研究亦较少,缺乏较为系统和完善的诊治预防措施。本研究旨在对住院2型糖尿病人群中OH的发生率、不同类型OH的发生率及其可能的影响因素进行调查分析,探讨糖尿病人群OH的危险因素及其可能的相关机制,以便为糖尿病OH患者在临床诊治和护理过程中提供更加完善及个体化的指导以改善其预后。
1 资料和方法
研究对象:选取2010-08至2011-04在我院糖尿病中心住院的2型糖尿病患者256例,其中男性147例(57.4%),平均年龄(58.05±11.54)岁,平均病程(9.72±8.33)年;平均体重指数(25.53±3.78)kg/m2。入选标准:糖尿病患者依据1999年世界卫生组织糖尿病诊断标准和分型标准,高血压患者依据1999年世界卫生组织及中国高血压联盟的诊断和治疗指南。排除标准:帕金森病、脑干损伤、脊髓损伤、格林巴利综合征、多系统萎缩等原发性中枢神经系统损伤,以及有精神病史、交感神经节切除术后等患者;目前正在服用抗惊厥药、抗帕金森病、抗肿瘤药物及抗抑郁药物(以三环类为主)者;合并严重肾功能不全(血浆肌酐清除率<30ml/min),肝功能不全(经典分级为B或C级),心功能不全(纽约心脏病协会心力衰竭分级为Ⅲ级或Ⅳ级);继发性高血压;各种严重心律失常者;低血容量,低白蛋白血症及贫血的患者;妊娠及肿瘤晚期患者。
收集基线资料:256例患者于住院当天收集病史,测定血压、身高、体重,计算体重指数(BMI=kg/m2)。于住院3天内抽血化验,患者禁食8~12 h后于次日空腹抽静脉血,检测肝肾功能、甘油三脂、总胆固醇、高密度脂蛋白、低密度脂蛋白、尿酸、空腹血糖、糖化血红蛋白。查血尿常规、检测8 h尿白蛋白排泄率。所有测定统一在我院检验科进行。于住院后4天内行心电图、超声心动图、必要时可行头颅计算机X线断层扫描或核磁共振检查。选择合适的患者于住院1周内行直立倾斜试验及自主神经功能检测。
直立倾斜试验:由经过培训的专业医务人员依据标准血压测量程序,采用心电监护仪器(PHILIPS-A3,美国)同时测量卧—立位时血压及心率。血压测量前至少安静休息5 min后坐位测量2次血压及心率,每次测量间隔至少1 min,取2次平均值作为坐位血压和心率的分析值。之后患者取仰卧位平躺在电动直立倾斜试验床上,安静休息至少5 min后测量卧位血压及心率2次,每次至少间隔1 min,取两次平均值作为卧位血压和静息心率的分析值。然后将倾斜床以固定速度转至≥60°倾角 的 位 置,记 录 即 刻 (0 min)、1 min、2 min、3 min、5 min末的血压和心率,并询问记录患者有无头晕、眼花、晕厥症状。OH定义为:直立倾斜床倾角≥60°角后任一时间内血压与卧位平均血压相比,收缩压下降≥20mmHg(1mmHg=0.133 kPa)和(或)舒张压下降≥10mmHg[3]。将256例患者分为单纯2型糖尿病组(非OH组,n=176),2型糖尿病合并OH组(OH组,n=80)。OH根据发生时相不同分类:OH伴收缩压(单纯收缩压下降超过20mmHg)下降(OH-S)者;OH伴舒张压(单纯舒张压下降超过10mmHg)下降(OH-D)者;OH伴收缩压和舒张压下降均超过上述标准(OH-C)者。根据体位改变时低血压发生和持续时间又可分为持续性OH、短暂性 OH 和延迟性 OH[6]。
自主神经功能检查:①RR间距变异:根据每分钟6次深呼吸时观察心电图上RR间距变化,用最短的和最长的RR间距分别换算出心率,并计算心率差。②瓦尔萨尔瓦指数:深吸气后尽量屏气,然后以极快的速度吹气(15 s内吹气的压力达40mmHg)同时描记心电图,正常人最大心率(RR间距)与最小心率(RR间距)之比应≥1.21,1.1~1.21为临界值,心脏自主神经病变者≤1.10。③立卧位心率差:常用的反映卧位变立位后心率变化的指标之一。立卧位心率差≥15次/分为正常,11~14次/分为临界值,≤10次/分为明显异常。
超声心动图:采用美国生产的PHILIPS-RE33彩色多普勒超声心动仪测量所有患者左心房收缩径、右心房径、左心室舒张径、右心室舒张径、舒张末期室间隔厚度、左心室后壁厚度、左心室射血分数(LVEF),二尖瓣心室充盈早期血流速度的峰值/晚期心室充盈心房收缩血流速度的峰值比值(E/A)。
统计方法:所有定量资料先进行正态分布检验,符合正态分布的定量资料由均数±标准差描述,对非正态分布的计量资料以中位数和四分位间距表示;其两组资料的比较用独立样本t检验,多组资料的比较采用单因素方差分析;呈偏态分布的资料采用非参数秩和检验。所有定性资料由百分率描述,率和构成比的比较采用Pearson χ2检验。Logistic回归分析多个变量与OH的关系,了解与OH相关的危险因素。所有数据用SPSS 17.0统计软件完成,以双侧检验P<0.05为差异有统计学意义。
2 结果
一般情况:256例患者,平均体重指数(25.53±3.78)kg/m2,平均糖化血红蛋白(8.97±2.37)%,其中肥胖(BMI≥28 kg/m2)者62例(24.2%),OH的发生率为31.1%。其中OH-S、OH-D以及OH-C所占比例分别为11.2%、6.8%、13.1%,而持续性、短暂性和延迟性OH的所占比例分别为13.1%,11.8%,6.2%。
两组间临床特征的比较:OH组比非OH组糖化血红蛋白、总胆固醇、甘油三酯、卧位收缩压、血肌酐、尿白蛋白排泄率、卧位心率均增加,高密度脂蛋白胆固醇降低;OH组左心房收缩径、室间隔厚度及左心室射血分数均大于非OH组。OH组糖尿病肾病发生率高于非OH组。上述比较差异均具有统计学意义(P均<0.05)。表1
表1 两组临床特征的比较()

表1 两组临床特征的比较()
注:与非OH组比较△P<0.05 *表示该数据为偏态资料,用中位数,第1分位及第3分位值描述比较 OH:体位性低血压 HDL-C:高密度脂蛋白胆固醇 UAER:尿白蛋白排泄率 Valsalva:瓦尔萨尔瓦1mmHg=0.133 kPa
非OH组(n=176)OH组(n=80)年龄(岁) 58.16±11.74 57.80±11.20男性(例,%) 97(54.4) 50(62.5)病程(年) 9.28±8.05 10.69±8.91体重指数(kg/m2) 25.23±3.56 26.18±4.21糖化血红蛋白(%)* 8.20(6.90,10.30) 9.45(7.58,11.45)△总胆固醇(mmol/L)* 4.74(4.06,5.36) 5.06(4.54,5.50)△甘油三酯(mmol/L)* 1.26(0.89,2.01) 1.80(1.21,2.26)△HDL-C(mmol/L)* 1.13(0.90,1.20) 1.02(0.96,1.28)△血肌酐(umol/L)* 95.00(86.00,104.25) 102.00(92.00,117.50)△UAER(ug/min)* 7.00(0.10,16.96) 44.25(1.31,360.67)△卧位收缩压(mmHg) 126.75±17.18△ 134.25±15.03卧位舒张压(mmHg) 72.18±10.54 74.99±9.02卧位心率(bpm)* 69.50(64.50,76.50) 74.25(65.87,82.00)△Valsalva指数* 1.13(1.09,1.20) 1.11(1.06,1.21)RR 变异度(bpm)* 9.00(6.00,12.00) 7.50(5.00,14.00)左心房收缩径(mm) 34.77±4.11 36.50±3.63△室间隔厚度(mm) 10.30±1.60 11.12±1.46△左心室射血分数(%)* 66.00(60.25,71.00) 70.00(64.75,73.00)△高血压患病率(%) 101(56.8) 52(66.0)冠心病患病率(%) 49(27.5) 20(25.0)应用降压药物(%) 95(53.3) 46(57.5)应用胰岛素(%) 43(24.1) 26(32.5)糖尿病肾病(%) 28(15.7) 40(50.0)
2型糖尿病合并OH危险因素分析:应用多因素Logistic逐步回归分析,以年龄、性别、体重指数、病程、高血压及降压治疗、冠心病、脑血管病、糖尿病肾病、糖化血红蛋白、总胆固醇、甘油三酯、血尿酸、卧位收缩压、坐位收缩压、卧位心率、瓦尔萨尔瓦指数、左心房收缩径、室间隔厚度及左心室射血分数等作为自变量,以是否发生OH作为因变量,结果提示2型糖尿病患者发生OH的风险与糖尿病肾病(β=1.381)、糖化血红蛋白(β=0.207)、卧位收缩压水平(β=0.071)、室间隔厚度(β=0.307)呈正相关,而与坐位收缩压(β=-0.074)呈负相关。表2
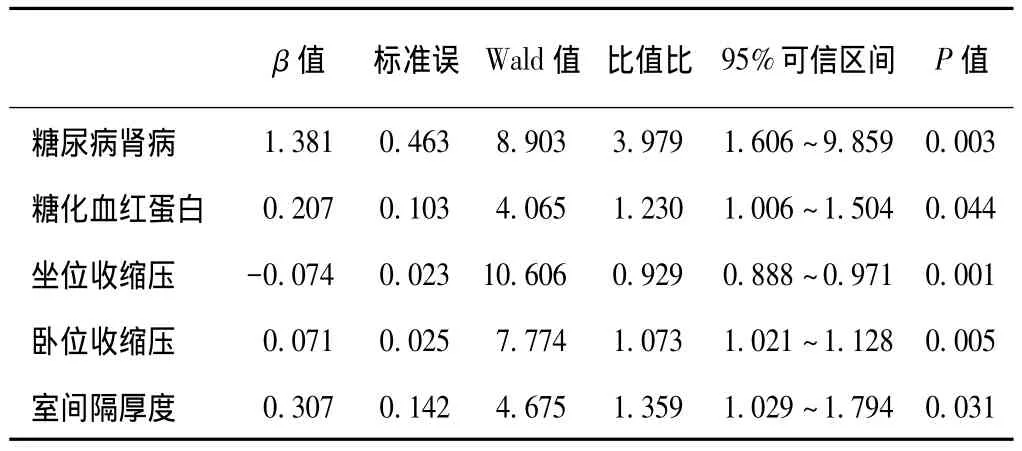
表2 2型糖尿病合并体位性低血压危险因素分析
3 讨论
本研究显示合并糖尿病肾病组OH发生率明显高于不合并糖尿病肾病组,OH组血肌酐和尿白蛋白排泄率水平明显高于非OH组,多因素回归分析提示2型糖尿病合并糖尿病肾病是发生OH的主要影响因素。糖尿病肾病易发生OH的原因可能与肾小球结节性和弥漫性病变导致肾脏调节机体有效血容量能力下降,肾脏功能受损导致体液向组织间隙转移,使体位改变时不能维持足够的血容量有关,另一方面糖尿病肾病提示微血管病变,微血管病变会导致神经内膜缺血、能量代谢障碍,神经轴突及髓鞘变性,引起心血管自主神经系统受损,使压力反射及心率反射通路调节能力下降[7]。另外,主要位于肾脏中的肾素—血管紧张素—醛固酮系统可能也受到一定的影响而参与OH的发生[8]。
本研究中2型糖尿病合并OH组与非OH组在高血压患病率和降压药物治疗率方面没有显著差异,但OH组的卧位收缩压显著升高,多因素回归分析提示OH的发病危险与卧位收缩压水平呈正相关,与坐位收缩压水平呈负相关,提示血压升高及血压压力反射调节通路受损是导致OH危险的直接影响因素[9]。而卧位收缩压升高说明外周血管硬化程度较重,顺应性降低,血压调节能力进一步下降而更容易出现OH[10]。心脏是心血管调节的重要靶器官,OH组左心房收缩径、室间隔厚度及左心室射血分数较非OH组明显升高,多因素回归分析提示,室间隔厚度增加与OH呈正相关。临床上大部分2型糖尿病患者在出现心力衰竭之前就已存在心脏舒张功能不全,左心室结构和功能与血压密切相关[11,12],室间隔增厚、左心室射血分数略有升高,反映了2型糖尿病早期心脏结构和功能上的代偿性改变,在出现心力衰竭之前先出现代偿性心肌肥厚、收缩力增强,导致心室顺应性下降、体位改变时心脏变异度下降,因此2型糖尿病患者若存在早期心脏结构和功能上的改变提示OH的患病风险升高。
糖尿病人群中OH的患病率差异较大,从8%~44% 不等[6,9,13],其原因与所选择患者病情严重程度、合并并发症不同及OH诊断方法有关。本研究采用准确性更高的直立倾斜试验来诊断OH,尽可能减少系统误差。对住院2型糖尿病患者进行OH调查发现,OH的发生率为31.1%,与国内彭妙官等[14]报道的32.7%相近,比台湾 Wu等[9]报道的25.5%略高,考虑与住院2型糖尿病患者病程较长、并发症较多、病情较严重有关,提示OH在住院的2型糖尿病患者中有更高的发生率。研究显示OH-S、OH-D、OH-C患者所占比例分别为11.2%、6.8%和13.1%,出现OH-C、OH-D提示患者心室顺应性减弱、动脉硬化较重,在体位改变时容易出现舒张期 OH。持续性 OH占13.1%,短暂性OH占11.8%,延迟性OH占6.2%。目前认为体位改变时迅速站立和持续站立血压的维持机制有所不同。持续站立时由于毛细血管的滤过作用使血液向组织间隙扩散,并随着站立时间的延长血容量可进一步降低;另外静脉的舒张使更多的血液潴留于静脉池中,进一步导致回心血量的减少[8],此时血压的维持主要靠交感神经对肌肉的持续兴奋[15]及肾素—血管紧张素—醛固酮系统的激活,糖尿病肾病及心血管自主神经受累程度较重易发生持续性OH。OH-C和持续性OH属于严重的OH,常提示预后不良,易发生猝死,应引起临床医生高度重视。
[1]Eigenbrodtml,Rose KM,Couper DJ,et al.Orthostatic hypotension as a risk factor for stroke:the atherosclerosis risk in communities study,1987-1996.Stroke,2000,31:2307-2313.
[2]Luukinen H,Koski K,Laippala P,et al.Orthostatic hypotension and the risk of myocardial infarction in the home-dwelling elderly.J Intern Med,2004,255:486-493.
[3]Fedorowski A,Stavenow L,Hedblad B,et al.Orthostatic hypotension predicts all-mortality and coronary events in middle-aged individuals(The Malmo Preventive project).European Heart Journal,2010,31:85-91.
[4]Fedorowski A,Stavenow L,Hedblad B,et al.Consequences of orthostatic blood pressure variability in middle-aged men(The Malmo Preventive project).Journal of Hypertension,2010,3:551-559.
[5]Masaki KH,Schatz IJ,Burchfielcm,et al.Orthostatic hypotension predicts mortality in elderly men:the Honolulu Heart Program.Circulation,1998,98:2290-2295.
[6]Jochanan E,Naschitza,Nizar Eliasa,et al.Predicting outcomes on head-up tilt based on orthostatic hypotension patterns.Journal of Hypertension,2006,24:1033-1039.
[7]Gibbons CH,Freeman R.Delayed orthostatic hypotension:a frequent cause of orthostatic intolerance.Neurology,2006,11,67:28-32.
[8]Smit AA,Halliwill JR,Low PA,et al.Pathophysiological basis of orthostatic hypotension in autonomic failure.J Physiol,1999,15,519 Pt 1:1-10.
[9]Wu JS,Yang,YC,Lu FH,et al.Population-based study on the prevalence and risk factors of orthostatic hypotension in subjects with prediabetes and diabetes.Diabetes Care,2009,32:69-74.
[10]Kaufmann H,Oribe E,Miller M,et al.Hypotension-induced vasopressin release distinguishes between pure autonomic failure and multiple system atrophy with autonomic failure.Neurology,1992,42(3 Pt 1):590-593.
[11]葛志明,张运.舒张性心力衰竭的诊断和治疗现状.中国循环杂志,2007,22:405-407.
[12]周芳明,祝之明,于军,等.2型糖尿病合并原发性高血压患者的动态血压及脉压和左心室结构和功能的关系.中国循环杂志,2002,17:350-353.
[13]Delcourt C,Vauzelle-Kervroedan F,Cathelineau G,et al.Low prevalence of long-term complications in non-insulin-dependent diabetes mellitus in France:a multicenter study.Journal of Diabetes and Its Complications,1998,12:88-95.
[14]彭妙官,张琦,邓雪峰,等.2型糖尿病体位性低血压的临床因素分析.中国动脉硬化杂志,2010,18:889-892.
[15]Joyner MJ,Shepherd JT,Seals DR.Sustained increases in sympathetic outflow during prolonged lower body negative pressure in humans.J Appl Physiol.1990;681004-1009.

