麻疯树种源/家系生长和结实变异研究
沈俊岭,骈瑞琪,孙佩光,陈晓阳
(1 青岛农业大学 园艺学院,青岛市现代农业质量与安全工程重点实验室,山东 青岛266109;2 华南农业大学 林学院,广东省森林植物种质资源创新利用重点实验室,广东 广州510642;3 中国热带农业科学院 海口实验站,海南 海口571101)
麻疯树Jatropha curcas 属大戟科Euphorbiaceae麻疯树属Jatropha,为小乔木或大灌木,起源于中美洲的墨西哥,南美洲的巴西、哥伦比亚等国.麻疯树用途广泛,因其种子可以用来提炼生物柴油而被广泛种植.麻疯树在美洲、非洲、澳大利亚、亚洲以及中南半岛等热带和亚热带地区均有分布.麻疯树传入中国已有300 多年的历史[1],在中国,麻疯树主要分布在云南、四川、广东、广西、贵州、台湾、福建、海南等省.麻疯树分布区跨越范围广,在长期的进化过程中,储藏了丰富的基因资源,为充分开发、挖掘和利用这些基因资源,培育高产、稳产、含油量高的优良新品种,育种学家应用DNA 标记技术对麻疯树的遗传多样性与遗传结构进行了研究[2-8],为该基因资源的保护、开发和利用提供了极有价值的信息.但目前关于麻疯树种源、家系、无性系和个体水平的田间生长遗传变异报道甚少.Heller[9]对非洲13 个种源在非洲的塞内加尔(Senegal)和佛得角(Cape Verde)进行了种源试验;Ginwal 等[5]比较了印度中部种植的6~24 个月10 个种源的变异情况;唐敏[10]对桂西南地区的麻疯树资源分布进行了调查,并分析了枝条生长量、叶面积、果实体积、坐果率以及种仁含油量的变异情况;贾宏林[11]对我国主要分布区的22 个种源苗期生长形态进行了研究.以上研究均发现麻疯树群体间和群体内都存在丰富的表型变异,这为以后选择培育速生、含油量高的优良家系提供了可能.据不完全统计,目前我国麻疯树的种植面积约200 万hm2,种植面积还在进一步扩大,培育生长快、含油量高的良种迫在眉睫.
本试验拟通过调查分析海南麻疯树育种基地收集的4 省19 个种源195 个家系2年生试验林的成活率、树高、地径、结实枝数及结实等级,以期揭示麻疯树不同种源间/家系间的表型变异及变异模式,为制定麻疯树育种策略提供理论依据.
1 材料与方法
1.1 试验材料
调查材料来自于海南省文昌市(19° 32'N,110° 47'E)麻疯树育种基地实生家系试验林.该家系实验林种植于2007年,包括来自4 省19 个种源的195 个家系,家系林采取随机区组试验设计[12],4 次重复,每个小区15 个单株,为3×5 株块状小区.具体家系来源见表1.
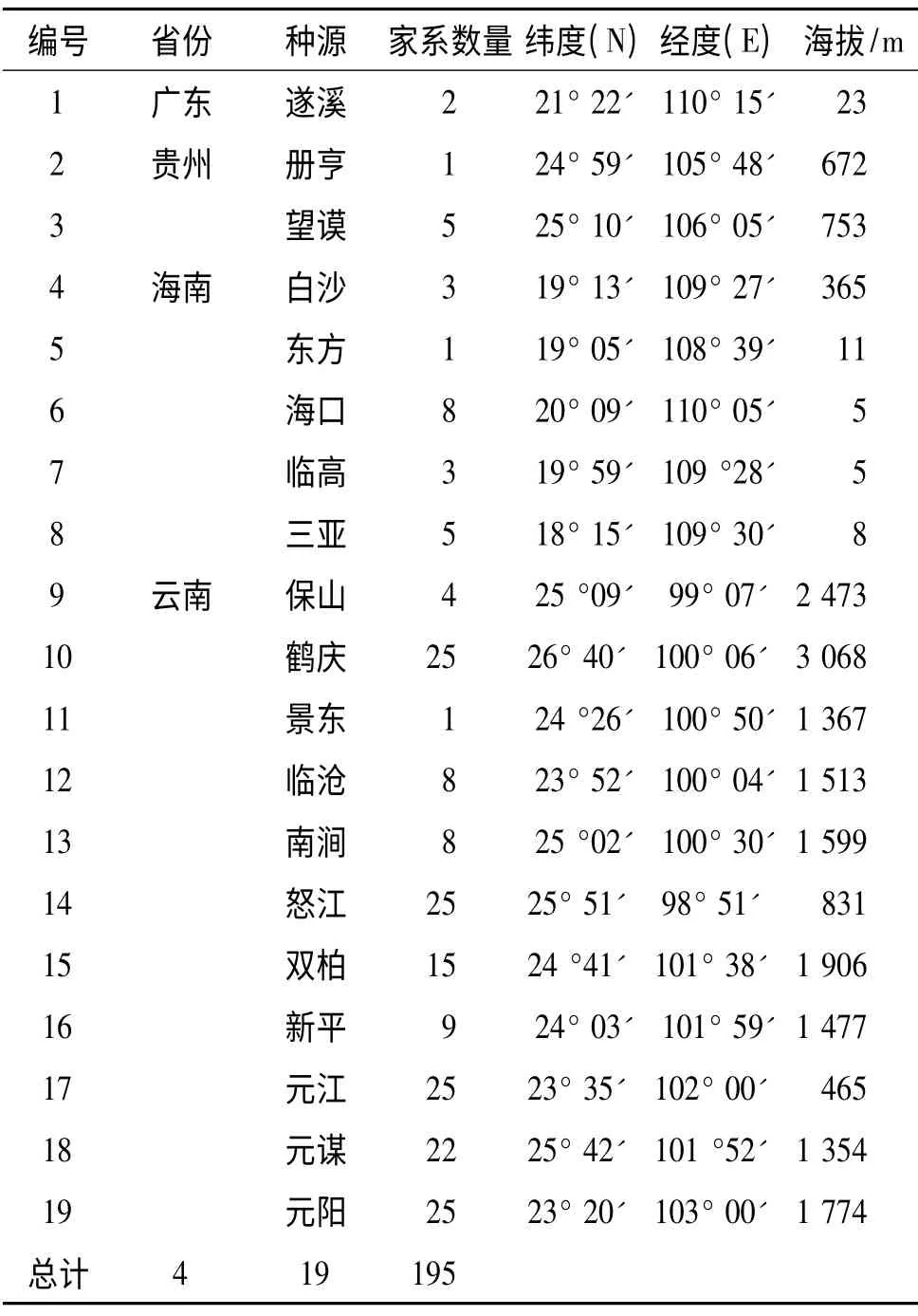
表1 麻疯树种源/家系来源一览表Tab.1 Details of seed origin of Jatropha curcas provenance/family trial and clone information in Hainan,China
1.2 田间生长性状的调查方法
分别于2008 和2009年的11月份调查各家系的生长状况,主要调查性状包括成活率、树高、地径、结实枝数及果实产量等级,其中:树高指从地面到主干最高点的高度;地径指高于地面10 cm 处的主干的直径;结实枝数指调查时所有结实枝的数量;果实产量分5 个等级:0 级为没有结实,1 级为1~20 个果,2 级为20~50 个果,3 级为50~100 个果,4 级为100~150 个果,5 级为>150 个果.
1.3 数据统计和分析
1.3.1 均值及方差分析 采用Excel 统计各生长性状均值;成活率经反正弦转换,结实个数和结实等级经平方根转换后用Genstat 软件[13]进行方差分析,主要分析家系、种源及省份间3 个水平的差异;并对差异显著的生长性状采用LSD 方法进行多重比较.
表型变异系数和基因型变异系数的计算参照Burton 等[14]的方法.遗传力的计算方法参照Hanson等[15]的方法.
1.3.2 各性状与地理位置的相关性分析 相关分析用SPSS 程序的Correlate 中的Bivariate 模块[16].为了反应纬度的真实效应,消除海拔因素的影响,对某些变异形式做出合理解释,本研究采用Kataring[17]等效纬度的概念,其计算公式为:等效纬度=纬度+(海拔高度-300)/a,当海拔高度大于300 m 时,a=140,当海拔高度小于300 m 时,a=200.
1.3.3 聚类分析 用NTSYS 2.1 软件对来自19 个种源的195 个家系的各个生长性状数据标准化后进行聚类分析[18].
2 结果与分析
2.1 种源/家系各生长性状变异分析
表2 的方差分析结果表明,除成活率以外,省份间及种源间的差异明显大于家系间的差异.成活率是唯一一个在家系间差异显著的性状,同时也是唯一一个在省级水平上差异不显著的性状.从表3中可知家系的平均成活率为93.65 %,只有海南临高(60.04 %)和云南鹤庆(81.44 %)2 个家系的成活率低于90%,云南元阳的成活率最高,为98.07 %.
植株平均高度统计结果(表3)显示,贵州的材料生长最慢,平均高度为1.81 m,其他3 省广东、海南和云南的平均高度分别为1.92 、2.06 和1.96 m.来自海南省和云南省的材料在省及种源水平上均存在极显著差异.来自海南省的材料树高变幅较大,最低的为海口(1.89 m),最高的为白沙(2.31 m);来自云南的材料中,最高的来自临沧(2.22 m),最低的来自景东(1.51 m).

表2 种源/家系各生长性状方差分析1)Tab.2 Variance analysis of population/family growth parameters
地径统计结果(表3)显示,海南材料的平均地径最粗,为6.99 cm,广东材料的地径最细,为6.30 cm;贵州和云南材料的平均地径分别为6.54 和6.86 cm.同树高一样,海南、云南材料在种源水平上存在极显著差异,海南省内,海口材料的地径最细,为6.71 cm,临高材料的地径值最大,为7.70 cm;在云南省内,地径变幅为5.88(景东)~7.25 cm(临沧).
单株结实枝数在省级及种源级间均存在极显著差异.在省级水平上,海南省材料的单株平均结实枝数最多,为1.56 个,其次为云南1.38 个,广东1.21个,而贵州最低,为0.77 个;海南省内和云南省内的材料间也存在极显著差异,海南白沙每棵树的平均结实枝数为2.42 个,而海南临高却只有0.99 个,云南省内单株结实枝数最大值为2.07 个(临沧),最小值为0.07 个(景东).
单株结实量变化趋势与结实枝数相似,贵州省材料的平均结实等级为0.52 级,意味着这些材料大多数单株结实量小于20 个;海南省材料的平均结实等级为1.04,其大多数单株结实量介于20~50 个,来自海南白沙的材料最丰产,平均结实等级为1.62,来自云南景东的材料结实等级最低,只有0.07.
遗传变异系数(GCV)是衡量性状遗传变异能力的指标,凡遗传变异系数大的性状表示从群体中选出优良性状个体的概率大.试验分析表明,家系的GCV 介于1.14%~13.64%,其中结实等级的GCV最高(13.64%),其次为成活率的GCV(10.10%),结实枝的GCV 为9.43%,表明家系间也蕴藏着丰富的遗传变异(表3).
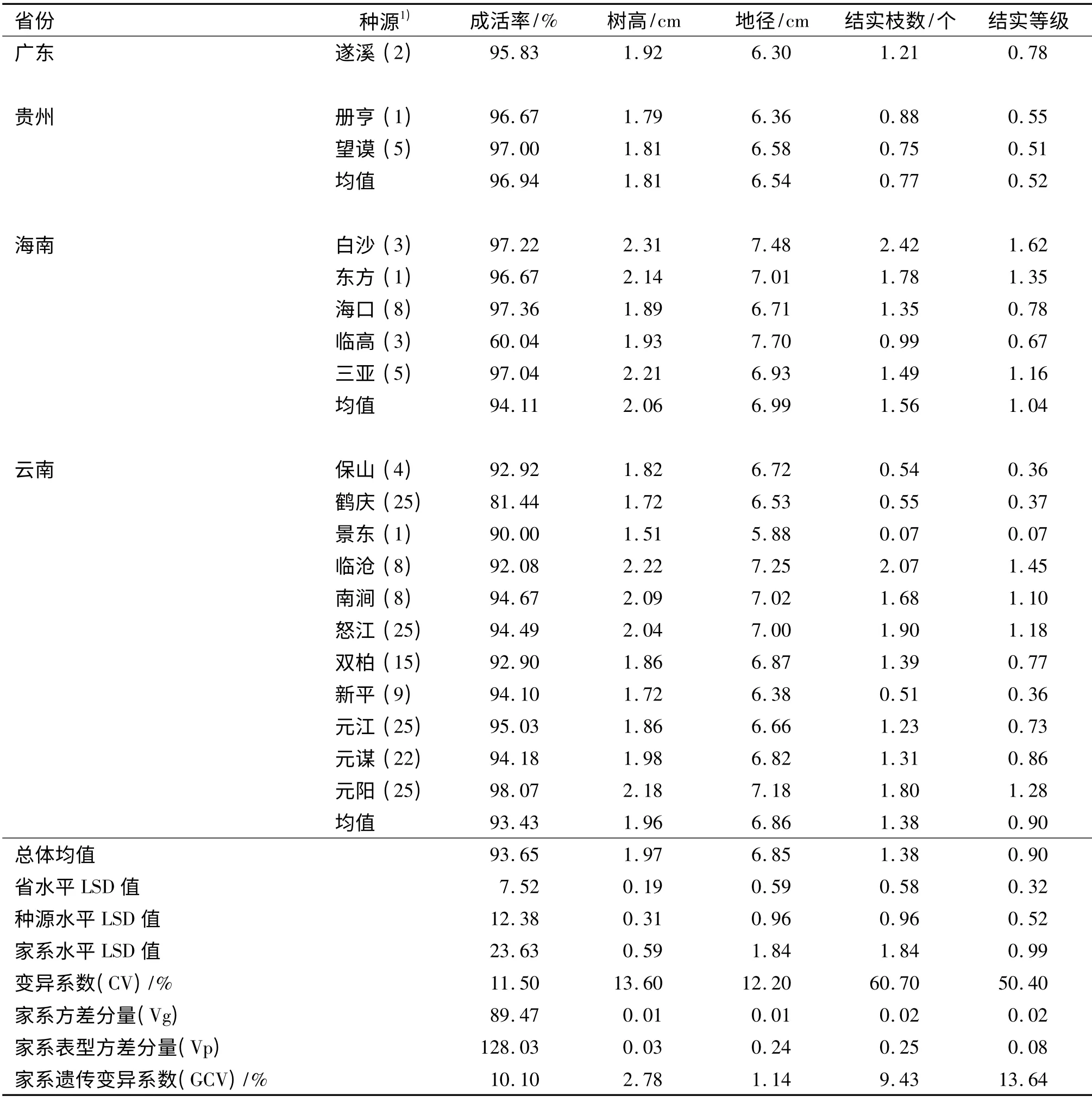
表3 种源/家系各生长性状的均值及多重比较Tab.3 Mean height,diameter at ground level,the number of fruiting branches,fruit crop yield and multiple comparison results among provenances/families
由于麻疯树分布区自然条件差异较大,来自不同省份、种源的麻疯树家系在生长性状特征上存在显著差异,不同区域的麻疯树遗传基础存在较大差异,具有丰富的表型变异和较大的选择概率.
2.2 各生长性状的相关分析
相关分析结果(表4)表明,成活率与树高、地径、结实枝数及结实等级间没有明显的相关性.而树高、地径、结实枝数和结实等级间的相关系数均大于0.700,其中树高与结实等级间相关系数最大,为0.969;而且显著性水平均小于0.01,说明这几个性状间显著相关,在以后的麻疯树优良单株选择中,可以使用这些相关关系较密切的性状进行辅助选择.
2.3 各性状与地理位置的相关性
通过各性状与经纬度的相关性分析(表4),可知成活率与经度、等效纬度和海拔的相关系数分别为0.048、0.048 和-0.054,其显著性水平都大于0.05,说明成活率与这几个因素相关性不显著.树高、地径、结实枝数和结实等级与经度、等效纬度和海拔间的相关性也不显著.经度和等效纬度与各性状的相关系数均小于绝对值0.06,没有明显的规律性,说明本试验所用试验材料没有明显的地理变异模式.而海拔与各个性状间均存在不显著的负相关,在一定程度上说明随着海拔的升高,成活率、树高、地径、结实枝数和结实等级均呈下降趋势.

表4 各生长性状及其与地理参数的相关性分析1)Tab.4 Correlation of survival,height,diameter at ground level,the number of fruiting branches,fruit crop yield and correlation with the geographic parameters
2.4 聚类分析
聚类分析结果(图1)显示,195 个家系的Jaccard’s 相似系数介于0.40~4.92,195 个家系可以分为2 个组和2 个单独的种源.第1 组包括来自广东遂溪的家系,海南海口的家系,贵州册亨和望谟的家系,以及采自云南元江、双柏、元谋、新平、保山和鹤庆的家系,共包括3 省的10 个家系;第2 组包括来自海南白沙、东方、三亚及云南临沧、元阳、南涧和怒江2 省的7 个家系;云南景东和海南临高家系未被划分到任何组内,而是单独被分开;从试验聚类结果可以看出生长性状的划分与种源的地理位置没有明显的相关性.
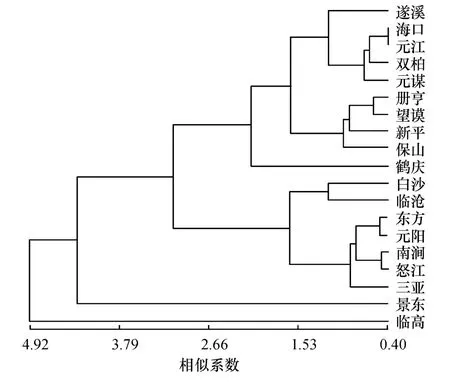
图1 19 个种源生长性状聚类分析Fig.1 Dendrogram of 19 provenances based on growth and fruit yield traits
3 讨论与结论
3.1 麻疯树的遗传变异
麻疯树不同种源/家系的田间5 个性状分析结果显示,2年生种源实生苗均存在丰富的表型变异,而家系水平上仅成活率有显著差异.唐敏[10]和贾宏林[11]也发现我国麻疯树主要分布区的种源存在丰富的变异,与麻疯树分子水平的遗传多样性结果[6-8]相比,其表型变异更丰富.Achten 等[19]也认为麻疯树的形态变异比其他热带树种更为丰富.这些丰富的表型变异为培育有经济价值的优良品种提供了良好的基础.
3.2 麻疯树分布的地域性
各性状与经纬度的相关性分析结果表明,各性状与经纬度没有明显的相关性,说明我国主要分布区麻疯树各家系的地理位置分布没有地域性.这与分子标记的结果[7]相似.推测其原因如下:1)麻疯树起源于中美洲的墨西哥、巴西、哥伦比亚、阿根廷等地区,17 世纪由葡萄牙人或其他欧洲航海者经南非好望角、印度尼西亚传播至亚洲地区[9],大约在100多年前引入中国;2)麻疯树最初大多用来做田地的篱笆,多通过无性扦插繁殖;3)麻疯树种子有毒,鸟禽不食,在一定程度上影响了种子传播.
3.3 优良种源/家系的选择
麻疯树不同种源田间生长结果显示,5 个观测性状2年生实生苗在种源间均存在丰富的表型变异,为培育有经济价值的优良品种提供了良好的基础.麻疯树各生长性状间存在一定的相关性,在优良种质资源筛选过程中可以使用这些相关的性状进行辅助选择.
从省级水平来看,贵州省的材料生长最慢,而且其结实枝数和结实量也低于其他省份,如果选择培育结实早并且丰产的优良品种,该省材料不被看好;海南省材料各个性状均优于其他省份,原因除材料本身的基因型差异外,还可能是各个种源在种植地适生性的表现不同;从种源水平来看,海南白沙、东方、三亚及云南临沧、南涧、怒江和元阳各项生长性状均优于其他种源材料,均为良好的育种材料.
3.4 麻疯树进一步试验的建议
本研究揭示了不同地域来源的材料在田间生长性状上的差异,但目前关于田间生长性状的研究报道还较少,而且处于初级阶段.大部分麻疯树还处于野生状态,还没有有效地驯化种植,此后应进一步加强田间的种源、家系、无性系及优良个体的选择研究,培育稳产高产麻疯树新品种.
麻疯树现有生长性状相关性分析结果显示,树高、地径、结实枝数和结实等级间显著相关,故应对现有家系生长性状进行继续调查评价,随着时间的推移,注意立木生长量、种子特性和种子产量与上述性状之间的相关性,从而建立麻疯树经济产量与早期表现的相关性模型,为麻疯树家系试验早期选择提供科学依据.
本试验采用的19 个种源195 个家系麻疯树材料的地理变异表现为明显的随机变异模式,但上述结论只是单点数据的结果,建议进一步开展多点试验验证,或需要增加其他性状的选择,以便进一步揭示麻风树的地理变异特点.
[1]王岩,龙春林,程治英.能源植物小桐子的利用与研究进展[J].安徽农业科学,2007,35(2):426-427.
[2]RAO G R,KORWAR G R,SHANKER A K,et al.Genetic associations,variability and diversity in seed characters,growth,reproductive phenology and yield in Jatropha curcas(L.)accessions[J].Trees,2008,22(5):697-709.
[3]BASHA S D,SUJATHA M.Inter and intra-population variability of Jatropha curcas(L.)characterized by RAPD and ISSR markers and development of population-specific SCAR markers[J].Euphytica,2007,156(3):375-386.
[4]BASHA S D,FRANCIS G,MAKKAR H P S,et al.A comparative study of biochemical traits and molecular markers for assessment of genetic relationships between Jatropha curcas L.germplasm from different countries[J].Plant Sci,2009,176(6):812-823.
[5]GINWAL H S,RAWAT P S,SRIVASTAVA R L.Seed source variation in growth performance and oil yield of Jatropha curcas Linn.In central India[J].Silvae Genet,2004,53(4):186-192.
[6]SUN Qibao,LI Linfeng,LI Yong,et al.SSR and AFLP markers reveal low genetic diversity in the biofuel plant Jatropha curcas in China[J].Crop Sci,2008,48(5):1865-1871.
[7]SHEN Junling,JIA Xiangnan,NI Huiqun,et al.AFLP analysis of genetic diversity of Jatropha curcas grown in Hainan,China[J].Trees,2010,24(3):455-462.
[8]SHEN Junling,PINYOPUSARERK K,BUSH D,et al.AFLP-based molecular characterization of 63 populations of Jatropha curcas L.grown in provenance trials in China and Vietnam[J].Biomass Bioenergy,2012(37):265-274.
[9]HELLER J.Physic nut:Jatropha curcas L.:Promoting the conservation and use of underutilized and neglected crops:1[M/OL].Rome:International Plant Genetic Resources Institute,1996[2013-03-05].http:∥www.ipgri.cgiar.org/publications/pdf/161.pdf.
[10]唐敏.桂西南麻疯树生长、种仁含油率及其与环境的相关性研究[D].南宁:广西大学,2007.
[11]贾宏林.中国小桐子不同地理种源差异比较与种源亲缘关系的研究[D].北京:北京林业大学,2008.
[12]续九如,黄智慧.林业试验设计[M].北京:中国林业出版社,1992.
[13]PAYNE R W.GenStat:Release 7.1 Reference Manual[M].Oxford,UK:VSN International Ltd,Wilkinson House,Oxford,UK,2003.
[14]BURTON G W,DE VANE E H.Estimating heritability in tall fescue(Festuca arundinacea)from replicated clonal material[J].Agron J,1953,45(10):478-481.
[15]HANSON C H,ROBINSON H F,COMSTOCK R E.Biometrical studies of yield in segregating populations of Korean Lespedeza[J].Agron J,1956,48(6):268-272.
[16]宋志刚,谢蕾蕾,何旭洪.SPSS16 实用教程[M].北京:人民邮电出版社,2008:112-117,132-140.
[17]KATARING L.Genotype×environment interaction of provenances of Pinus contorta(Dougl.)[J].Studia Forestalia Suecica,1983(66):41-44.
[18]ROHLF F J.NTSYSpc.Numerical taxonomy and multivariate analysis system:Version 2.1[M].New York:Exeter Software,Setauket,NY,2000.
[19]ACHTEN W M J,NIELSEN L R,AERTS R,et al.Towards domestication of Jatropha curcas[J].Biofuels,2010,1(1):91-107.

