大口黑鲈慢性气泡病的组织病理观察以及水体分层对发病的影响
彭天辉,潘连德,唐绍林
(1.上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海201306;2.广州利洋水产科技有限公司,广州505515)
大口黑鲈慢性气泡病的组织病理观察以及水体分层对发病的影响
彭天辉1、2,潘连德1,唐绍林2
(1.上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海201306;2.广州利洋水产科技有限公司,广州505515)
在池塘环境下,对自然发生鱼气泡病时水体的溶氧过饱和度进行了调查,结果发现,在池塘水平均溶氧值相差不大的条件下,水体分层不明显的池塘比水体分层严重的池塘更易发生慢性气泡病。在实验室中模拟出各种与调查池塘溶氧过饱和度相似的环境,将鱼体质量均为50 g的100尾大口黑鲈Micropterus salmoides随机分为4组,在不同溶氧饱和度条件下(50% ~100%、100% ~150%、150% ~200%、200% ~250%)饲养20 d,对自然发病和人工条件下发病的大口黑鲈进行临床检查和组织病理观察。结果表明:自然发病鱼和人工条件下发病鱼的临床症状一致,均表现为眼球角膜突出、不透明,鳃丝、眼球后极和鳍条基部等处出现气泡;两者的组织病理变化一致,均表现为眼球视网膜与脉络膜脱离,视网膜色素上皮细胞肥大、增生,随后坏死消失,脉络膜丛出现大量气泡,角膜血管化;肝脏、肾小管、肠道微绒毛和鳃丝复层上皮等处细胞空泡化,未成熟血细胞增多,血细胞破裂后含铁血黄素沉着,导致炎性细胞浸润。
大口黑鲈;水体分层;慢性气泡病;组织病理
大口黑鲈Micropterus salmoides隶属于鲈形目、太阳鱼科、黑鲈属,又称加州鲈,原产于北美中东部地区,20世纪80年代引入中国,成为中国主要的淡水养殖品种之一[1]。气泡病是大口黑鲈养殖过程中最严重的病害之一,一年四季均有发生,夏季出现最多。气泡病完全是由未得到补偿的高压溶解气体引起的,起初在血管和组织里引起损伤,随后引起一系列生理机能障碍[2]。史为良[3]曾用色谱仪分析了鱼体气泡,其成分主要是氮气和氧气。
一般情况下,当水体总气体压力(TGP)扣除静水压后过饱和度达到125%以上时,鱼类即可发生高致死性的急性气泡病[2]。氧气过饱和也能引起气泡病,但学者们对氧气过饱和引起急性气泡病时溶氧的过饱和度临界值的研究结果差别较大,为160%~300%[3]。TDG轻微过饱和可诱发慢性气泡病,引起鱼类生长减慢、继发感染、行为改变等,但不会在短时间内造成鱼的大量死亡[2,4-8]。一般认为,鱼类在TDG为100%~110%的条件下会发生慢性气泡病,且对鱼类的潜在伤害比急性气泡病更大[9-11]。目前,关于水族箱里气体过饱和导致的气泡病方面的报道较多,但对于池塘养殖条件下气泡病发生条件的报道很少,仅Boyd等[12]曾对池塘水面TDG的日变化、月变化和周年变化进行了统计,并记录到343.6%的最高溶氧过饱和度,但未见池塘里的斑点叉尾鮰和蓝鳃太阳鱼发病。关于溶解氧过饱和引起水生动物慢性气泡病的病理变化并不多见,Grahn等[13]对TDG长期轻微过饱和条件下患慢性气泡病的石斑鱼眼组织进行病理研究,Kulshrestha等[14]利用TDG过饱和的地下水饲养两种鮰鱼并对其组织病理进行观察,发现患病个体血细胞减少。本研究中,通过对多个发生气泡病的大口黑鲈养殖池塘各个水层的溶氧过饱和度进行统计,研究了上下水层溶氧值的差异对气泡病发病的影响,并对自然发病和人工条件下发病的大口黑鲈个体进行组织病理观察,旨在从病理方面为气泡病的诊断提供更多的佐证,从而为大口黑鲈气泡病的治疗和预防提供可行的方案。
1 材料与方法
1.1 材料
自然发病的试验鱼于2012年6—9月采自广东省佛山市顺德区勒流镇的部分发病池塘;人工条件下的试验鱼为上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室饲养的健康个体,苗种来自广东省佛山市顺德区。
1.2 方法
1.2.1 试验设计 将鱼体质量均为50 g的100尾大口黑鲈随机均分为4组,分别放养到标记为A、B、C、D的4个容积为300 L的室内封闭水族箱中。试验前驯养7 d,驯养期间,水温控制在23℃左右,每天投喂等量膨化饲料,使用空气泵充气。
驯养结束后开始20 d的室内水族箱试验,使用工业氧气瓶通过微管向A、B、C 3个水族箱中充纯氧,使得A、B、C 3个水族箱的溶氧过饱和度分别保持在 100% ~150%、150% ~200%、200%~250%,每次测量氧气过饱和度前均仔细观察各水族箱中鱼个体的行为表现,并观察和记录各水族箱中个体是否出现病危或死亡情况;D箱为对照组,不充氧,使用空气泵将溶氧始终控制在50%~100%。
每次从养殖池塘采样时均仔细观察和记录患病个体的行为表现。
1.2.2 病鱼样品的采集 在池塘养鱼中,通过临床诊断、宏观病理诊断和溶氧值的测定,选择出符合条件的8种病例,陆续从8种病例中采集濒死患病鱼共计26尾。将采集到的样品详细记录体长、体质量、月龄、临床症状、发病情况等,并拍照。
水族箱试验中,将采集到的患病鱼样品详细记录体长、体质量、月龄、组别、死亡时间、临床症状等,并拍照。
1.2.3 水质溶氧的监测及统计 对池塘中初步诊断为符合8种病例的鱼进行跟踪,对每尾病鱼从发病之日起持续跟踪5 d。用YSI550A型溶氧仪测定池塘中心溶氧的变化,每天 8:00~10:00、13:00~15:00和17:00~19:00各测量一次,在距离水面0、0.5、1.0、1.5、2.0 m处分别进行测量。每次测量发病鱼池塘环境因子的同时,选取另外一个相同天气条件下没有发病的池塘,同样测量并记录,作为发病鱼塘的对照。
水族箱试验中,当A、B、C 3箱中的氧气过饱和度分别达到150%、200%、250%后停止供氧。每隔30 min,监测一次各池的溶氧,根据实时溶氧数据决定是否向水族箱充氧或开启空气泵。
1.2.4 病理解剖 将从池塘采集的濒死病鱼用重击头部法致其死亡,仔细观察其临床症状,并逐步解剖,同时拍摄照片。眼球组织经中性福尔马林固定后沿视神经所在的直径切开两半,观察眼球各结构的宏观病理变化并拍照。
对饲养于水族箱的大口黑鲈个体每两天取样一次,每组选取一条症状较明显的个体,在干净的载玻片上滴加一滴蒸馏水,用手术剪刀取下样品的数片鳃丝和少量鳍条,盖上盖玻片后制成水浸片,在光学显微镜下观察鳃丝和鳍条的宏观病理变化并拍照。眼球处理同上。
1.2.5 组织病理观察 将所有样品和对照组个体的鳃、肝脏、肾脏、肠道和眼球等组织用体积分数为10%的中性福尔马林溶液固定24 h,其中眼球固定4 h后用一次性注射器针头在视神经处刺破眼球,再次放入固定液中固定20 h。将固定好的样品放入组织框中用自来水冲洗12 h,修整组织块(眼球沿视神经所在的直径切开两半),编号后进行脱水、透明和浸蜡,其中眼球用30%(体积分数,下同)的酒精开始逐级脱水,其他组织用70%的酒精开始逐级脱水。包埋后使用莱卡切片机制成厚度为4 μm的切片,用苏木精-伊红染色(H.E),中性树胶封片,用尼康光学显微镜观察组织病理变化,并用摄像系统进行拍照[16]。
2 结果
2.1 水质溶氧的监测
2.1.1 池塘溶氧 记录到表层水的最高溶氧过饱和度为452.9%,最低为34.7%。最大值出现在对照池塘,但该池塘未发生气泡病。在同一个池塘同一时间,测得的水面和水下2 m处的溶氧过饱和度差值最大为373.4%,最小差值为1.64%,均出现在对照池塘。
所有记录到的 1 200个数据中,发病池塘37.7%的溶氧过饱和度数据超过100%,对照池塘为25.3%。发病池塘水下1.0、1.5、2.0 m处测得的溶氧过饱和度数据占所有发病池塘测得的过饱和度数据的39.4%,而对照池塘这3处测得的过饱和度数据占所有对照池塘过饱和数据的28.3%。
对每个池塘每次测得的5个数据求标准差,t检验结果显示,发病组与对照组标准差的差异极显著(P<0.01)。
取一个发病池塘及其对照池塘的溶氧数据,将每次测量水面和水下0.5、1.0 m处的平均值作为水体上层的溶氧值,每次测量水下1.0、1.5、2.0 m处的平均值作为水体下层的溶氧值,不同时间下池塘上、下水层的溶氧过饱和度如图1所示。

图1 发病池塘和对照池塘水体各层溶氧过饱和度的对比Fig.1 The dissolved oxygen supersaturation at various water layers in the experimental ponds and control pond
2.1.2 水族箱溶氧 A、B、C水族箱中的溶氧过饱和度始终分别保持在100% ~150%、150% ~200%、200% ~250%,D箱溶氧保持在50%~100%。A、B、C、D 4个水族箱溶氧的平均值分别为123.6%、179.1%、228.8%和77.6%。
2.2 行为观察
在水族箱中的试验开始24 h后,A、B、C 3组中个体开始出现活力下降,或是在水面集群停留,或是在箱底停靠,且对惊吓相当敏感,此现象一直持续到试验结束。C组个体表现最明显,B组其次,A组则相对轻微,D组个体多在水体中下层活动,活力很强。试验结束时各组均未发生高致死性的急性气泡病,试验期间除了4尾大口黑鲈个体因外伤导致继发感染死亡外,其余个体均存活至试验结束。
池塘养殖条件下,观察到患病鱼的行为表现与人工条件下相似,常出现离群独游和长时间逗留水面等现象。
2.3 临床病理解剖
2.3.1 眼球症状 正常大口黑鲈个体眼球镶嵌在眼眶内,且角膜弧度极小,俯视头部可见眼眶上皮刚好遮住角膜(图2-A)。在水族箱中的试验开始24 h后,可见B组与C组少数大口黑鲈个体眼球角膜轻微突出,A组和D组个体无异常。48 h后, B组与C组眼球角膜突出的个体稍多且较24 h时严重(图2-B),A组偶尔见到极少数轻微眼球角膜突出的个体,D组个体无异常。一周后,B组与C组个体几乎全部出现很明显的眼球角膜突出的症状(图2-C),并且角膜逐渐变得不透明,C组个体角膜突出的程度较B组明显,A组个体出现角膜突出的个体稍多,但程度极其轻微。两周后,C组少数个体眼周皮肤随角膜一起突出眼眶(图2-D)。
池塘养殖条件下,自然发病鱼外观症状也是以眼球突出为主,但经常伴有各种继发感染,很少出现单纯的眼球突出症状。
2.3.2 鳃丝症状 正常鳃丝结构完整,鳃静脉内可见连续流动的血液(图2-E)。在水族箱中的试验开始24 h后,各组抽检个体鳃丝均极少出现气泡。48 h后,A、B、C组抽检个体均能见到少量气泡。一周后,B组和C组抽检个体鳃丝可见大量气泡和气柱(图2-F),且C组个体较B组个体明显,A组抽检个体见到少量气泡。两周后,各组抽检个体鳃丝水浸片结果与一周后相似。

图2 对照组和试验组大口黑鲈的临床解剖及观察(×4,比例尺50 μm)Fig.2 Clinic examination of the diseased large mouth bass in the control group and experimental groups(×4,bar scale=50 μm)
池塘养殖条件下,自然发病鱼鳃丝也出现相同症状,但经常伴有不同程度的烂鳃或寄生虫感染。
2.3.3 鳍条症状 正常鳍条组织呈连续的并行的多条线状结构,并具细小分节(图2-G)。在水族箱中的试验开始一周后,可见B组与C组部分个体各鳍条基部开始发白,透明度增加,剪取鳍条做水浸片,明显见到鳍条内的气柱(图2-H),A组和D组个体则无此症状出现。鳍条变透明的症状从臀鳍开始,接着腹鳍和背鳍也出现。A、B、C组大多数个体均出现鳍条发白现象。
池塘养殖条件下,自然发病鱼也出现鳍条发白的症状。
2.4 组织病理观察
2.4.1 眼球组织 正常眼球沿视神经所在直径剖开后呈现出各主要结构由前向后依次为角膜、晶状体、玻璃体、视网膜、脉络膜和巩膜,其中视网膜、脉络膜和巩膜全部集中在眼球后极,各结构依次与前一结构紧密连接(图3-A),视网膜从前向后依次由节细胞层、双极细胞层、视细胞层和色素上皮层构成(图3-B),脉络膜为视网膜提供氧分,内含丰富的毛细血管和纤维组织(图3-C)。
试验开始48 h后,患病个体眼球突出,玻璃体变性,角膜轻度水肿和血管化,视网膜与脉络膜分离,视网膜色素上皮细胞肥大,脉络膜丛出血,并出现被气泡占据的空间(图3-D)。一周后,角膜上皮细胞出现少量坏死并从基膜脱落,角膜血管化加重,视网膜与脉络膜之间的空间被大量气泡占据(图3-E),且逐渐扩大,压迫晶状体和角膜,致使角膜不断向前突出;视网膜色素上皮细胞层肥大、增生,出现少量坏死,视细胞层也出现增生(图3-F);脉络膜丛未成熟红细胞增多,部分红细胞破裂,并出现含铁血黄素沉着。两周后,角膜上皮细胞严重脱落,严重的血管化使得角膜变得不透明,眼球横截面上有很多被气泡占据的空间,贯穿整个葡萄膜、玻璃体、前室空隙甚至是整个眼眶和角膜,致使视网膜与脉络膜完全分离,视网膜变性及坏死处扩散,只剩下神经节细胞和神经纤维层,大部分的视网膜只剩下胶质瘢痕,残存的视网膜色素上皮细胞向退化的视网膜迁移,脉络膜大量出血,含铁血黄素沉着增多。但有部分个体并不出现以上病理变化,或是只有很轻微的病变,这可能与个体对高氧的耐受性不同有关。同一时期,A组的病变程度最轻,B组次之,C组最严重。
2.4.2 肝组织 正常肝脏静脉含适量血细胞,肝细胞排列规律,以中央静脉为中心呈放射状排列,形成清晰的索状结构(图3-G)。
试验开始48 h后,患病个体肝细胞仍排列整齐,出现轻微空泡变性,少量肝细胞出现核固缩。肝静脉淤血或血细胞很少,肝静脉中未成熟红细胞增多,极少量的红细胞裂解。一周后,肝细胞排列混乱,空泡变性加重,肝细胞核固缩增多,部分肝细胞坏死,部分肝静脉无内容物(图3-H),肝静脉壁上皮细胞变性,附近出现少量嗜碱性粒细胞,血管中出现较多未成熟红细胞,裂解红细胞增多,且周围出现大量嗜碱性粒细胞,肝静脉和肝细胞间隙出现少量含铁血黄素沉着,部分血管由血管壁向内出现小的血栓。两周后,肝细胞空泡变性和坏死严重,部分区域肝细胞和肝组织结构无法辨认,细胞核和细胞质均消失,只留下残存的细胞连接,大量血管无内容物,血管中出现大量未成熟红细胞和嗜碱性粒细胞,红细胞裂解增多(图3-I),含铁血黄素沉着增多,血栓体积增加。A、B、C 3个试验组肝脏均出现相似病理变化,病变程度随着溶氧过饱和度的增加而加重。
2.4.3 肾组织 正常肾组织血窦内含适量血细胞,肾小球与基膜紧密连接,肾小管由排列整齐的单层上皮细胞紧密连接构成(图3-J)。
试验开始48 h后,患病个体肾小球正常,部分肾小管空泡变性,管间有少量红细胞。一周后,肾脏少血,肾小管上皮细胞肿胀明显,空泡化严重(图3-K),肾小管腔消失,部分肾小管上皮细胞核固缩,少量坏死,细胞核消失;部分肾小管出现破裂,管间未成熟红细胞增多,部分红细胞裂解,且出现铁血黄素沉积,伴随着周围淋巴细胞浸润(图3-L)。两周后,肾脏很多部位已经丧失了细胞结构,部分肾小管上皮细胞坏死消失,只剩部分细胞连接。A、B、C 3个试验组病鱼个体肾组织均出现相似病理变化,同一时期,A组的病变程度最轻,B组次之,C组最严重。
2.4.4 肠组织 正常肠组织从外向内由浆膜、肌层和黏膜层构成,浆膜的结缔组织及肌层的肌纤维均紧密连接,黏膜层的最内层由规则排列的微绒毛构成(图3-M)。
试验开始48 h后,患病个体黏膜皱襞的上皮细胞空泡化和变性导致微绒毛损伤,浆膜细胞也出现空泡变性。一周后,黏膜层、肌层和浆膜均出现被气泡占据的空间(图3-N、O),部分微绒毛损伤显著,上皮细胞破裂,肠腔里出现细胞渗出物。两周后,气泡的数量和体积越来越大,浆膜细胞的细胞质几乎全部消失,部分微绒毛上皮细胞从基膜上脱离。溶氧过饱和度较高的B、C组个体出现以上症状,A组基本正常。
2.4.5 鳃组织 正常鳃静脉血细胞丰富,鳃小片上皮由单层细胞构成,鳃小片的宽度仅能容一个红细胞通过,鳃丝复层上皮细胞间隙较小(图3-P)。试验开始48 h后,患病个体鳃丝血管中红细胞减少,鳃丝复层上皮细胞和鳃小片上皮细胞轻微水变性。一周后,鳃丝血管中红细胞数目进一步减少,未成熟红细胞增多,部分血管无内容物,部分鳃小片上皮细胞破裂(图3-Q),部分鳃丝复层上皮细胞增生(图3-R),细胞间出现被气泡占据的空间。两周后,部分鳃小片从鳃丝上脱落,鳃丝复层上皮变性严重,有少量坏死。A、B、C 3个试验组的病鱼个体鳃丝,在同一时间段的病理变化差别不大。
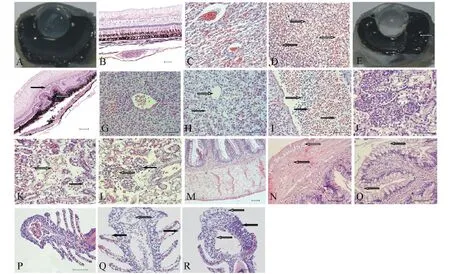
图3 大口黑鲈正常组织和慢性气泡病病理组织观察(比例尺50 μm)Fig.3 Histopathological observation of tissues in normal and chronic gas bubble diseased large mouth bass(bar scale=50 μm)
3 讨论
3.1 诱发大口黑鲈慢性气泡病的溶氧条件
本试验中未出现高致死性的急性气泡病,说明氧气过饱和度达到250%仍无法导致大口黑鲈发生急性气泡病,这一结果更倾向于认同部分学者所提出的氧气过饱和度达到300%以上才会发生急性气泡病[3]。不过不同品种可能会对溶氧过饱和的耐受能力不同,本试验中,作为品种对照的鲫也未发生急性气泡病,且无论从临床症状还是行为表现上看,均显现出比大口黑鲈更强的耐过饱和溶氧的能力。这也提示了我们,能导致气泡病发生的溶氧过饱和度临界值不可能是一个准确的数值,该临界值不仅会因品种的不同而变化,氧气与氮气的比例也会对其造成很大的影响,还有很多未发现的因素也可能会对其造成影响。从A组的情况来看,溶氧过饱和度低于150%就能导致大口黑鲈发生慢性气泡病,但要确定具体数值则需进行进一步研究。
3.2 水体分层对大口黑鲈慢性气泡病发病的影响
在池塘养殖条件下,鱼的发病原因比实验室复杂得多,在实验室,可以通过提供纯氧及保持稳定的水温和水质等方法减少理化因素对疾病发生的影响,还可以通过定期杀虫、杀菌等措施减少病原生物和浮游生物对疾病发生的影响。而在池塘条件下,浮游生物的影响以及水的密度流导致池塘水体出现不同程度的分层,水温和气压的变化导致氧气在水中的溶解能力发生显著变化,病原生物又会导致各种并发症和继发感染。通过对发病池塘各水层溶氧过饱和度的调查发现,在池塘各水层平均溶氧值相差不大的条件下,水体分层不明显的池塘比水体分层严重的池塘更易发生气泡病,这是首次从水体分层的角度对池塘条件下发生气泡病的原因进行探讨。监测的16个池塘中,溶氧最高值出现在对照组,最低值也出现在对照组,出现最高值的对照池塘与对应的发病池塘各水层的溶氧平均值相差不大,但表层溶氧比发病池塘高很多,即对照池塘水体分层较对应的发病池塘严重得多,但对照池塘反而没发病。水体分层导致池塘底部溶氧过饱和度相对较低,这可能有利于鱼类逃离严重过饱和水层,因而大幅降低发病率。底层水的溶氧过饱和度在气泡病的发生过程中起着关键作用。
3.3 大口黑鲈慢性气泡病的病理变化特征和规律
本研究中发现,病鱼眼球突出、玻璃体变性和角膜不透明等症状使其视力逐步衰退,导致前期视网膜色素上皮细胞代偿性肥大和增生。随着病情的加重,为视网膜提供养分的脉络膜中出现气泡,红细胞数目减少,携带氧气的能力随之减小,且逐渐从视网膜上分离,这就导致了视网膜色素上皮细胞和神经节细胞的坏死以及神经纤维层的退化和消失,进一步加快了患病鱼失明。即便如此,很多患病鱼的活动能力依然不会受到太大的影响。肝脏、肾小管和肠道微绒毛等处细胞的最主要病变是空泡变性,这与局部缺血、缺氧关系紧密,血栓或气泡导致氧气无法被准确携带到指定区域,线粒体发生病变,出现细胞空泡变性。而Grahn等[13]研究认为,石斑鱼除了眼球外其他部位没明显变化。大口黑鲈多个器官组织均能见到含铁血黄素的沉着,这与切片中见到的红细胞破裂相吻合。Kulshrestha等[14]对鮰鱼的研究也显示,红细胞大量减少,至于红细胞减少的原因则仍需要进一步研究。大量的坏死红细胞需要较多的白细胞分解,因此,切片中常见到大量炎性细胞浸润。红细胞坏死后,未成熟红细胞代偿性增生,于是便出现比正常情况多的未成熟红细胞。长期暴露在不利的环境条件下,水生动物自身也会产生更多的未成熟红细胞参加应激反应或免疫反应[15-16]。
由病毒、细菌、真菌或寄生虫引起的眼炎可能产生与气泡病相似的病理变化,但是患气泡病个体有独特的一面,即眼球组织、鳃组织、肠组织等处可见被气泡占据的空间。
3.4 病理变化在临床诊断中的应用
本试验研究结果显示,鱼眼球和鳃丝中的气泡是大口黑鲈慢性气泡病出现最早和最直观的临床症状,这与 Speare[17]、Noga[18]的研究结果相吻合。由于鱼眼球和鳃丝的气泡出现时间早,且易于观察,因此,这两个症状可作为大口黑鲈慢性气泡病临床诊断的首选依据。本试验中,鳍条基部出现气泡的时间虽较眼球和鳃丝晚,但也可作为气泡病严重程度的参考指标。此外,由于个体差异较大和气泡难以量化等原因,大口黑鲈慢性气泡病的宏观病理诊断标准难以建立,因此,溶氧过饱和度及过饱和状态的持续时间也只能作为疾病发生的两个正相关因素为气泡病的宏观病理诊断提供参考。
[1]何小燕,白俊杰,樊佳佳,等.大口黑鲈早期生长发育规律的研究[J].大连海洋大学学报,2011,26(1):23-29.
[2]Bouck G R.Etiology of gas bubble disease[J].Transactions of the American Fisheries Society,1980,109(6):703-707.
[3]史为良.冰下溶氧过高引起亲鱼气泡病一例[J].淡水渔业, 1987,6:41-42.
[4]Marking L L.Gas supersaturation in fisheries:causes,concerns,and cures[J].Fish and Wildlife Leaflet,1987,10:9-10.
[5]Jensen J O T.Combined effects of gas supersaturation and dissolved oxygen levels on steelhead trout(Salmo gairdneri)eggs,larvae, and fry[J].Aquaculture,1988,68(2):131-139.
[6]Krise W F,Smith R A.Eye abnormalities of lake trout exposed to gas supersaturation[J].The Progressive Fish-Culturist,1993,55(3):177-179.
[7]Mesa M G,Warren J J.Predator avoidance ability of juvenile chinook salmon(Oncorhynchus tshawytscha)subjected to sublethal exposures of gas-supersaturated water[J].Canadian Journal of Fisheries and Aquatic Sciences,1997,54(4):757-764.
[8]Counihan T D,Miller A T,Mesa M G,et al.The effects of dissolved gas supersaturation on white sturgeon larvae[J].Transactions of the American Fisheries Society,1998,127(2):316-322.
[9]Alderdice D F,Jensen J O T.An explanation for the high resistance of incubating salmonid eggs to atmospheric gas supersaturation of water[J].Aquaculture,1985,49(1):85-88.
[10]Colt J.Gas supersaturation-impact on the design and operation of aquatic systems[J].Aquaculture Engineering,1986,5(1):49-85.
[11]Jensen J O T,Schnute J,Alderdice D F.Assessing juvenile salmonid response to gas supersaturation using a general multivariate dose-response model[J].Canadian Journal of Fisheries and Aquatic Sciences,1986,43(9):1694-1709.
[12]Boyd C E,Watten B J,Goubier V.Gas supersaturation in surface waters of aquaculture ponds[J].Aquaculture Engineering,1994, 13(1):31-39.
[13]Grahn B H,Sangster C,Breaux C.Case report:clinical and pathologic manifestations of gas bubble disease in captive fish[J]. Journal of Exotic Pet Medicine,2007,16:104-112.
[14]Kulshrestha A K,Mandal P K.Pathology of gas bubble disease in two air-breathing catfishes(Clarias batrachus Linn.)and Heteopneustes fossilis Bloch.)[J].Aquaculture,1982,27(1):13-17.
[15]陈彦伶,牟群,潘连德,等.中华鳖药源性肝病模型的构建及其病理学观察[J].大连海洋大学学报,2013,28(1):1-6.
[16]葛海燕,刘小玲,罗贤奎,等.皮质醇混饲投喂对黄颡鱼幼鱼生长及外周血细胞的影响[J].淡水渔业,2007,37(1):43-47.
[17]Speare D J.Histopathology and ultrastructure of ocular lesions associated with gas bubble disease in salmonids[J].Journal of Comparative Pathology,1990,103(4):421-432.
[18]Noga E J.Fish disease:diagnosis and treatment[J].Journal of A-quatic Animal Health,1998,10(4):410-411.
Pathological observation of chronic gas bubble disease and influence of water stratification on the incidence in largemouth bass Micropterus salmoides
PENG Tian-hui1,2,PAN Lian-de1,TANG Shao-lin2
(1.Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education,Shanghai Ocean University,Shanghai 201306, China;2.Guangzhou Liyang Fishery Science and Technology Co.Ltd.,Guangzhou 505515,China)
The supersaturated oxygen levels was determined in the largemouth bass Micropterus salmoides culture ponds where natural gas bubble disease occurred.It was found that the chronic gas bubble disease was more often observed in the obviously stratified ponds than in the ponds without stratification under the similar dissolved oxygen levels.Then 100 largemouth bass juveniles with body weight of 50 g were randomly into 4 groups and reared in the simulated tanks with 50%-100%,100%-150%,150%-200%and 200%-250%saturation of dissolved oxygen for 20 days in a laboratory.Clinical examination and histopathological observation were carried out in the diseased juveniles with gas bubble disease in natural environment and simulated surroundings.The results showed that the same symptoms including exophthalmus,opaque of the cornea,and gas bubble in gill filaments,posterior eye and fin rays were found in the largemouth bass diseased in natural and simulated environments.Histopathological changes were also the same in the largemouth bass diseased in natural and simulated environments,including retina separated from choroid,retinal pigment hypertrophy and hyperplasia,then disappeare of necrosis,large quantity of bubbles produced from choroid plexus,cornea vascularized,vacuolization of cells from liver,kidney tubules,and intestinal microvillus,and stratified epithelium of gill filaments.In the diseased largemouth bass,the immature erythrocytes were increased in number and the deposit of hemosiderin due to fracture of erythrocytes led to the infiltration of inflammatory cells.
Micropterus salmoides;stratified water;chronic gas bubble disease;histopathology
S941.63
A
2013-03-15
上海市高校知识服务平台项目;上海市重点学科建设项目(Y1101)
彭天辉(1987-),男,硕士研究生。E-mail:pengtianhui97@126.com
潘连德(1960-),男,教授。E-mail:ldpan@shou.edu.cn
2095-1388(2013)06-0578-07

