凝胶剂中脂溶性茶多酚的含量测定
田永强,张 涛,陆 茜,Stephen Hsu,艾永循
(1.湖北中医药大学,湖北 武汉 430065; 2.江汉大学 医学院,湖北 武汉 430056;
3.江汉大学 化学与环境工程学院,湖北 武汉 430056;4.Georgia Health Science University,Augusta GA US 30912-1126)
凝胶剂中脂溶性茶多酚的含量测定
田永强1,2,张 涛2*,陆 茜3,Stephen Hsu4,艾永循2
(1.湖北中医药大学,湖北 武汉 430065; 2.江汉大学 医学院,湖北 武汉 430056;
3.江汉大学 化学与环境工程学院,湖北 武汉 430056;4.Georgia Health Science University,Augusta GA US 30912-1126)
目的:建立凝胶剂中脂溶性茶多酚的含量测定方法,为制定脂溶性茶多酚凝胶剂质量控制标准提供依据。方法:以无水乙醇为提取溶剂,酒石酸亚铁为显色剂,采用比色法,在540 nm处测定含量。结果:脂溶性茶多酚在0~250 mg·(100 mL)-1浓度范围内线性关系良好(R2=0.9991),平均回收率为102.80%,相对标准偏差为0.93%(n=9)。结论:本法简单、精确、重复性好,可用于凝胶剂中脂溶性茶多酚的含量测定。
脂溶性茶多酚;凝胶剂;比色法;含量测定
茶多酚(Green tea polyphenols,GTPs),即水溶性茶多酚,是茶叶中多酚类物质的总称,现代研究发现GTPs毒副作用极低[1],具有抗氧化、抗癌、抗病毒、降血压、对皮肤具有保护与治疗作用等多种药理作用[2-3]。
由于其结构特点,GTPs表现出脂溶性差、透皮吸收与透膜能力弱、易被氧化导致产品不稳定等弱点。为了克服GTPs上述弱点以进一步扩大其应用范围,人们在尽量保持其活性的前提下,通过化学改性研制出GTPs的酯化物——脂溶性茶多酚(Lipo-soluble tea polyphenols,LTPs),目前主要用作食品抗氧化剂,作为治疗性药物应用的报道较少[4-5]。
笔者在探索LTPs新的药理作用的研究中,研制出LTPs凝胶剂,制剂中LTPs的含量测定少见有报道。为了给制定LTPs凝胶剂质量控制标准提供依据,笔者探索了测定凝胶剂中LTPs含量的比色法,获得了较满意的结果,报道如下。
1 仪器与试药
1.1 仪器
紫外-可见分光光度计(UV—2401PC型,日本岛津);电子天平(FA1004型,上海精密科学仪器有限公司);离心机(TDL—40B型,上海安亭科学仪器厂);旋涡混合器(XH—B型,江苏康健医疗用品有限公司)。
1.2 试药
脂溶性茶多酚(LTPs,为茶多酚硬脂酸酯,余姚市惠德隆生物制品有限公司,批号20120425);卡波姆934P(廊坊聚通化工有限公司,批号120217);0.5%LTPs凝胶剂(江汉大学中医药研究所研制,批号:120615,120621,120625);空白凝胶剂(除不加LTPs外,按凝胶剂制法制备,江汉大学中医药研究所制备,批号:120625);硫酸亚铁、酒石酸钾钠、三乙醇胺、无水乙醇等均为分析纯;水为双蒸水。
2 方法与结果
2.1 试液的制备
2.1.1 三乙醇胺水溶液(1+1) 精密量取三乙醇胺50 mL,置100 mL容量瓶中,加双蒸水溶解并定容,即得。
2.1.2 酒石酸亚铁溶液 取硫酸亚铁1.0 g、酒石酸钾钠5.0 g,精密称定,置1 000 mL容量瓶中,加双蒸水溶解并定容,即得。
2.2 对照品溶液的制备
取LTPs于浓硫酸干燥器中干燥48 h,取250 mg,精密称定,用适量无水乙醇溶解并定容于100 mL容量瓶中,精密量取上述溶液0、2、4、6、8、10 mL分置于10 mL容量瓶中,用无水乙醇定容,即得每100 mL含LTPs 0、50、100、150、200、250 mg的不同浓度的对照品溶液。
2.3 供试品溶液的制备
取LTPs凝胶剂20 g,精密称定,置于烧杯中,加适量无水乙醇,充分搅拌,取混合物于离心机3 600 r/min离心30 min,分取上清液,重复提取3次,合并上清液,过滤,滤液移入100 mL容量瓶,用无水乙醇定容,即得。
2.4 测定波长的选择
精密量取对照品溶液[200 mg·(100 mL)-1]、凝胶剂供试品溶液(取凝胶剂40 g,按2.3项下方法制备)、空白凝胶剂供试品溶液(取空白凝胶剂40 g,按2.3项下方法制备)、无水乙醇各1 mL,分别置于25 mL比色管中,室温下各加入三乙醇胺水溶液1 mL混匀、加入酒石酸亚铁溶液5 mL混匀、加双蒸水定容至25 mL[6],依次编号为1~4号显色液,在400~800 nm波长范围内扫描,编号1、2的显色液扫描结果见图1,编号3、4的显色液扫描结果见图2。

图1 编号1、2的显色液可见光区扫描图
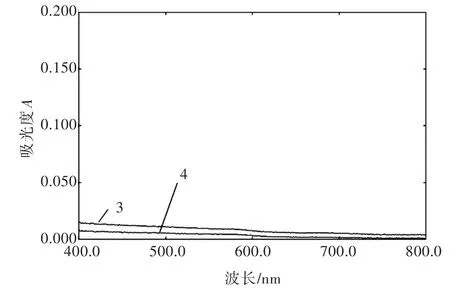
图2 编号3、4的显色液可见光区扫描图
由图1、图2可见,对照品溶液与凝胶剂供试品溶液二者的显色液均在540 nm波长处有最大吸收,而空白凝胶剂供试品溶液与无水乙醇二者的显色液在该波长处无吸收,对本法测定无干扰;故选择540 nm为测定波长。
2.5 测定方法
精密量取供试品溶液1 mL于25 mL比色管中,室温下加入三乙醇胺水溶液1 mL混匀,加入酒石酸亚铁溶液5 mL混匀,加双蒸水定容至25 mL;以空白试剂溶液做参比,在540 nm波长处用1 cm比色杯比色,测定吸光度[6]。
2.6 标准曲线
取2.2项下不同浓度的对照品溶液,按照2.5项下方法测定吸光度。以浓度C[mg·(100 mL)-1]为横坐标,吸光度A为纵坐标,绘制标准曲线,得回归方程为Y=0.0968X,线性系数R2=0.9997,LTPs在浓度0~250 mg·(100 mL)-1范围内,符合朗伯比尔定律,线性关系良好。
2.7 重复性试验
取2.2项下浓度为250 mg·(100 mL)-1的对照品溶液,按照2.5项下方法测定吸光度,重复测定6次,计算 LTPs相对百分含量,平均值为102.57%,相对标准偏差(RSD)为0.095%(n=6),重复性良好。
2.8 稳定性试验
取2.2项下浓度为250 mg·(100 mL)-1的溶液,按2.5项下方法分别于0、0.5、1、1.5、2、2.5 h测定吸光度,显色液吸光度在1.5 h内变化较小,表明显色液在1.5 h内基本稳定;1.5 h后随着时间推移吸光度有所升高。
2.9 回收率试验
取LTPs 160,200,240 mg,精密称定,分别用适量无水乙醇溶解,加入适量的空白凝胶剂中,使每份总重量为20 g,搅拌均匀,按2.3项下方法制备供试品溶液,以空白凝胶剂供试品溶液为参比,按2.5项下方法测定,每份样品测定3次,计算回收率,结果平均回收率为102.80%,RSD为0.93%(n=9)。
2.10 样品含量测定
取 0.5%LTPs凝胶剂(批号:120615,120621,120625)20 g,每批号取样3份,按2.3项下方法制备供试品溶液,以空白凝胶剂供试品溶液为参比,按2.5项下方法测定吸光度,按下式计算凝胶剂中LTPs百分含量,结果见表1。
凝胶剂中脂溶性茶多酚含量(%)=

式中A为测得的吸光度值,W样为被测凝胶剂的实际取样量。
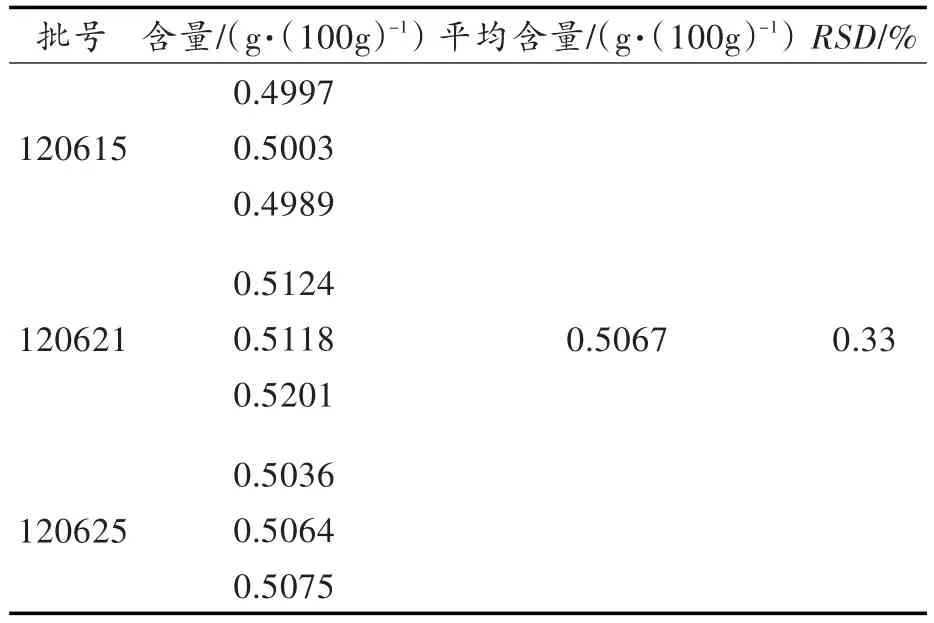
表1 凝胶剂中LTPs含量测定结果
3 讨论
目前市场上流通的LTPs是以GTPs为原料、分别采用氧酰化或碳酰化等不同的酯化方法获得的产品,每种LTPs产品组分均较为复杂。本研究采用的LTPs为氧酰化法生产的茶多酚硬脂酸酯,在没有合适标准物质的情况下,采用原料药为对照物质,测定结果更能反映凝胶剂中LTPs的实际含量;本方法简单、精确、重复性好,可用于凝胶剂中LTPs的含量测定。
曾采用文献[6]的方法与本文方法同时测定同一批号LTPs原料样品,结果文献方法测定含量的均值为45.75%,本文方法测定含量的均值为102.57%,相对本法而言,文献方法含量测定结果偏低,其原因值得进一步研究。
样品含量测定中需溶出凝胶剂中LTPs,由于基质卡波姆溶胀体积较大,制备样品溶液时需要一定时间,但是随着操作时间的延长,待测定液的吸光度值有所增加,测得的LTPs含量会相应增高,是LTPs中酯化基团的水解导致还是存在其他原因,有待进一步研究。
[1] 刘冬英,傅颖,梅松,等.茶多酚的毒理学安全性评价[J].毒理学杂志,2009(1):87-88.
[2] 徐芳芳,朱蓓德,姜国伟,等.茶多酚提取方法与药理作用研究进展[J].现代医药卫生,2012,28(7):1033-1035.
[3] 单媛媛,杨锐.皮肤细胞凋亡及其在化妆品开发中的应用[J].宁波大学学报:理工版,2007,20(4):463-467.
[4] 卢聪聪,邵卫梁,杭晓敏,等.两种茶多酚化学改性制备的脂溶性茶多酚抗氧化性能研究[J].安徽医药,2008,12(3):201-204.
[5] 应乐,张士康,王岳飞,等.茶多酚改性及其抗氧化性能研究进展[J].茶叶科学,2010,30(S1):511-515.
[6] 叶鹿鸣.脂溶性茶多酚含量测定方法的探讨[J].中国公共卫生,2001,17(9):836.
Determination of Content of Lipo Soluble Tea Polyphenols in Gel
TIAN Yong-qiang1,2,ZHANG Tao2,LU Qian3,Stephen Hsu4,AI Yong-xun2
(1.Hubei University of Traditional Chinese Medicine,Wuhan 430065,Hubei,China;2.School of Medicine,Jianghan University,Wuhan 430056,Hubei,China;3.School of Chemistry and Environmental Engineering,Jianghan University,Wuhan 430056,Hubei,China;4.Georgia Health Science University,Augusta GA US 30912-1126)
Objective:To establish the method of determining the content of lipo soluble tea polyphenols in gel for quality control standard.Methods:A colorimetric method was established for the determination of lipo soluble tea polyphenols in gel at 540 nm with ethanol as the extracting sol⁃vent and tartaric acid ferrous as the coloring reagent.Results:The linear relationship of lipo soluble tea polyphenols is good in the range of 0 to 250 mg·(100 mL)-1(R2=0.999 1)and the average recov⁃ery is 102.80%,the relative standard deviation(RSD)is 0.93%(n=9).Conclusion:This method is simple,accurate,repeatability good and can be used for determining the content of lipo soluble tea polyphenols in gel.
lipo soluble tea polyphenols;gel;colorimetry;content determination
R927.2
:A
:1673-0143(2013)01-0093-03
(责任编辑:范建凤)
2013-01-06
武汉市科技局江汉大学创新基地建设项目(201250499145-29)
田永强(1986—),男,硕士生,研究方向:中药及天然产物的化学与药理。
*通信作者:张 涛(1963—),男,教授,硕士,研究方向:中药及天然产物的化学与药理。E-mail:aa4633@163.com

