延髓背柱核在穴位敏化现象中的作用
荣培晶 李 霞 李 亮余玲玲 朱 兵
(中国中医科学院针灸研究所,北京,100072)
《灵枢·九针十二原》说:“五脏有疾也,应出十二原。”这说明脏腑有病可在体表一定部位出现病理反应。阿是穴也是患病时出现在体表的一种病理性反应点。我们以往的一些研究也证实有些背根神经有分支分别分布于心脏和相当于中医心经的体表区域。我们对内脏病理状态下穴位敏感程度的变化进行研究,观察电针刺激对延髓背柱核(DCN)神经元激活效应在正常和内脏伤害性传入情况下反应的量-效变化,以探讨穴位敏化的中枢机制。
1 研究背景
实验采用神经示踪法标识大鼠前肢内侧面(心经经脉循行线)与心脏的神经联系,表明C8-T3脊神经节的少量(6.8%)细胞的外周轴突有双分支现象,其一支分布于心脏,另一支分布于上肢内侧[1]。同样,在猫左前肢“天泉”穴区处和左侧星状神经节及左心下神经注入荧光标记物,背根节中也可见到少量(8%)双标的细胞,主要分布于C6~T2节段之间,其中尤以C8和T1节段最多[2]。然而这种轴突分支的现象毕竟为数不多,并不能完全解释复杂的体表内脏之间的相互作用。现代研究也表明内脏的信号能影响相对应的躯体,Jou 等[3]向大鼠心包内注射一种海藻类化合物可引起脊髓两侧肌肉的痉挛样收缩,切断左侧交感链和双侧迷走神经可分别减弱和加强这种肌电反应。他们认为,心绞痛牵涉痛的发生除躯体和内脏的传入在脊丘神经元上汇聚外,刺激心交感所诱发的痉挛样肌肉收缩引起的继发性疼痛也是一个因素。我们在实验中刺激大鼠心交感神经可引起心经穴位的最大反射性肌电反应,与肺经穴位相比有明显差异[1]。同样,电刺激猫左心下神经后,“曲泽”及“天泉”等心包经穴区肌电活动明显增加;而肺经上的穴位如“孔最”“尺泽”及“天府”穴区的肌电变化不明显。电刺激心下神经在心包经穴位上诱发出肌电所需的刺激阈值低于肺经穴位。电刺激心下神经亦可明显增加“天泉”穴区皮神经的放电活动。左冠状动脉前降支结扎造成急性心肌缺血后可降低刺激的阈值。依次切断T1~C7的背根和腹根后,刺激阈值逐步提高[2]。
内脏病理情况下出现的对脏器本身的伤害性刺激重要特征之一是其疼痛常反射到远隔损伤部位的某些体表区域,这种牵涉性疼痛常表现为尖锐、清晰和定位清楚,并常伴有痛觉过敏(触发点)或以对触觉刺激的反应性增高和痛阈降低为特征的继发性痛觉过敏,而不同于真性内脏痛所具有的深、钝、模糊和定位不明确等特征。尽管触发点大多位于牵涉痛的区域,但有些却离开牵涉痛部位一些距离。针灸刺激这些敏感点可以产生很好的镇痛效果。尽管牵涉痛的某些特征可用外周机制以及皮肤和内脏的传入在脊髓中的会聚和相互作用来解释,但痛觉过敏的机制尚不明了。因为脊丘束传统上被视为伤害性传入的主要通路,以往的许多疼痛研究中观察到该通路的伤害性传入可以被另外一个伤害性刺激的传入所抑制。
然而,最近的研究发现,背柱-内侧丘系在内脏伤害性信息传递过程中也发挥一定的作用,因而可以认为轻触的传入刺激与内脏伤害性传入可以被条件性触觉刺激发生以抑制为主的调控反应。延髓背柱核(DCN)神经元传统上被认为是躯体传入的高级中枢。近些年来的研究工作表明它在传递内脏伤害性传入信息到丘脑和皮层等高级中枢中起重要作用[4-7],这就为躯体与内脏传入信号会聚发生在DCN 水平提供了结构上的基础。
尽管有极少的解剖和生理学报道DCN 接受内脏的传入,DCN 传统上被认为是延髓的主要感觉中枢。但近些年来,越来越多的文献报道支持这样一种假说:DCN 在内脏伤害性传入到高级神经中枢如丘脑和皮层过程中起到特有的作用[6]。在本项研究中,我们将系统观察内脏刺激对延髓DCN 神经元伤害性信息传递过程的影响,探讨内脏伤害性传入对体表穴区感觉过敏现象的发生与发展过程,研究体表穴位与内脏相关联系的生物学基础,探讨穴位敏化的生物学机制。
2 方法
2.1 动物 实验选用健康成年Sprague-Dawley 雄性大鼠23只,体重250~300 g,清洁级。由军事医学科学院实验动物中心提供。动物实验前禁食12 h,不禁水,实验过程中对动物的处置遵循2006年科技部颁布的《关于善待实验动物的指导性意见》。
2.2 模型制备 大鼠用乌拉坦(urethane,1.0~1.2 g/kg)腹腔注射麻醉。外科手术在麻醉情况下进行。将动物仰卧在手术台上,于颈正中线切开皮肤,分离气管。在暴露的气管中下端顺气管软骨环作一横切口,插入气管导管,后用丝线结扎固定,以保持呼吸道通畅。然后分离颈总动脉和分离颈静脉,静脉插管用于输液,动脉插管用于监控实验过程中的血压变化。
为了使大鼠延髓能充分暴露,将大鼠双耳用耳棒固定于KOPF-900型立体定位仪上,于颅正中切开皮肤、皮下组织,去除骨膜;将鼠头向下屈曲60 度~70 度,用操纵杆垂直顶住颅骨,使大鼠头部处于屈曲状态,然而用牙托水泥将颅骨与操纵杆粘合在一起,保持鼠头位置稳定。沿项部中央切开皮肤,分离并剪除皮下筋膜和肌肉,然后用棉球钝性向下推除深部结缔组织,充分暴露枕骨大孔。用一次性8号注射针头的尖端斜面沿枕骨大孔将硬脊膜作环性切割,暴露出菱形窝,在显微镜下用游丝镊撕开软脑膜。手术完成后用剪开的皮瓣缝合成皮槽,暂用38℃左右的石腊油覆盖,以避免延髓干燥。在正式实验时插入记录微电极后皮槽中灌注2%的琼脂,以保护延髓、避免干燥和减少因呼吸产生的延髓振动。
2.3 数据记录 DCN(薄束核)神经元记录的座标为:延髓菱形窝底端(obex)开始,沿菱形窝边缘向上约0~3.0 mm 范围内,旁开约1.5~2.0 mm,延髓表面下100~500μm(见图1)。
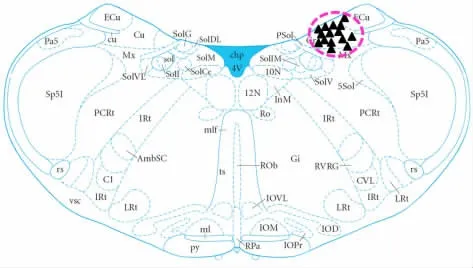
图1 ▲为部分记录的DCN 神经元在延髓的定位
单细胞活动的细胞外记录采用充灌2% Pontamine sky blue的0.1M 醋酸钠的玻璃微电极(尖端约5μm,阻抗约10~15 MΩ),在微电极操纵器控制下根据DCN的座标将记录微电极插入核团,寻找所需的神经元。细胞放电经微电极引入Spikes-2(Oxford)或Power-Lab 电生理仪系统,进行细胞放电的放大和信号处理。
所记录到的神经元都检查其外周感受野对机械刺激(包括触刺激、von Frey 毛反应敏感度、齿镊夹皮刺激)、手针刺激,观察它们的感受野分布范围、感受野大小,量化反应的性质及反应的强度。随后也试验这些神经元对直结肠扩张(Colorectal Distension,CRD)刺激的反应。只有对皮肤和CRD 刺激都发生反应的神经元才列入研究对象以确定这两种分别来自体表和内脏传入能否发生相互作用。
2.4 干预措施 内脏伤害性刺激采用直结肠扩张法,将一长约4~6 cm的气囊经肛门插入直结肠,插入的深度约为5~6 cm,为避免造成肠壁损伤与肛门刺激,置入时在气囊上涂抹润滑油。内脏伤害性传入由插入直肠内的气囊充气超过20~30 s 造成CRD,试验的直结肠压力一般控制在20~80 mmHg 之间,≥40 mmHg为伤害性[8];超过100 mmHg 易造成直结肠破裂。气囊用乳胶指套或安全套制作而成,捆绑在一外径约为4 mm的胶管上。如采用乳胶指套则需在实验前充气并留置过夜以克服气囊壁的张力。手动气囊通过T型管与压力换能器相连接。CRD 由通过血压计输出20~80 mmHg、持续20 s 或更长时间的压力充盈气囊来实现。为避免出现过度刺激以及结直肠可能的敏感化,重复CRD 刺激应为间隔10 min 以上。
选择引起Aδ 纤维反射阈值强度1.5 倍的电针刺激“足三里-上巨虚”穴区[具体方法参考我们以前的工作[9],平均引起Aδ 纤维反射阈值强度为(1.76±0.62)mA],然后给予20、40、60、80 mmHg的CRD,观察从非伤害性(20 mmHg)、伤害性(40 mmHg)、到强伤害性(60-80 mmHg)内脏刺激时穴位刺激引发该神经元敏化反应的量效关系。采用的标准条件性刺激的程序的设定是先记录的神经元背景活动,然后给予30 s的CRD 刺激,停止CRD 后立即给予30 s 感受野的手针刺激,观察CRD 前后针刺引发该神经元激活反应的变化。
2.5 统计学方法 用Power-Lab 计算机数据采集系统、Chart 5.0分析软件和SPSS13.0 数据统计软件进行数据整理分析,计算神经元每秒的放电个数和激活/抑制率,将干预前后的均值和差值做描述性统计(Descriptives)。组间比较采用配对t 检验。
单细胞记录程序结束后,用刺激器连通隔离器经微电极放大器向玻璃微电极通以20μA的负向直流电20~30 min,将玻璃微电极内的滂胺天蓝导入DCN 以标记电极记录位置。随后将动物处死,用4%的多聚甲醛做心脏灌流后取脑干,4%多聚甲醛固定,两天后取组织做冰冻切片和HE 染色观察,参考大鼠脑图谱(Paxinos及Watson,2007),确定记录点的位置。
2.6 实验动物生命体征的监控 整个实验过程中,动物体温通过一反馈型加热仪控制和维持在36~38℃之间。在监控动脉血压的实验中,平均动脉压都可维持在正常范围;但在条件化刺激过程中血压有一过性小幅度的、以升压为主的变化反应。
3 结果
3.1 DCN 神经元反应的一般特性 实验用23只SD雄性大鼠,记录的神经元均位于DCN的楔束核(接受来自下胸节以下的传入)。因只有部分DCN 神经元接受广泛的躯体和内脏传入,在记录的124个对躯体感受野触觉刺激发生反应的DCN 神经元中,仅27个能对CRD 发生反应,其中21个被兴奋,6个被抑制。本项研究所记录的DCN 神经元对躯体刺激与内脏伤害性刺激的感受野基本位于下肢(图2),与我们以往的报告相同[10]。少数神经元感受野非常大,而另一些则非常小,仅呈点分布。部分DCN 神经元有一定的自发性背景活动,但多为散在性或小簇状放电,自发放电的频率并不很高(3.42±0.86)峰电位/s;也有一些神经元缺乏背景放电,需给予不断地外周刺激才能寻找到神经元。神经元对刺激反应的阈值差别较大。与躯体刺激相比,仅有约9%的DCN 神经元对内脏伤害性传入(CRD)发生反应;而且,神经元对CRD的反应明显弱于对触觉刺激产生的反应。
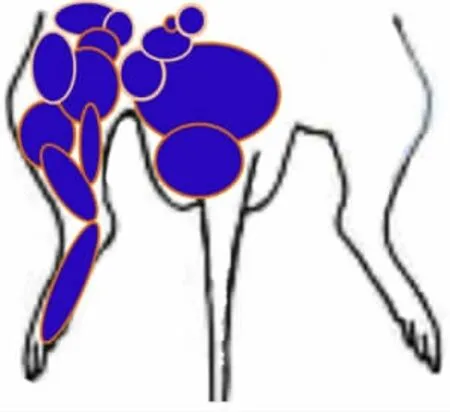
图2 部分DCN 神经元的外周感受野分布区域
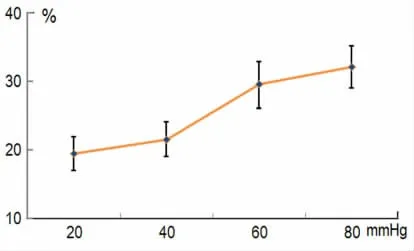
图3 DCN 神经元对分级直结肠扩张刺激反应
3.2 DCN 神经元对分级的内脏刺激引起的反应 在9个DCN 神经元系统观察了分级的CRD 刺激引起的反应,在20~80 mmHg 范围内,随着内脏扩张压力的升高,神经元反应的强度也随之增加,呈现出一定线性的量-效关系(参见图3)。但这种量效关系远远低于我们在脊髓观察到的结果,这种结果表明DCN 神经元对内脏感觉的分辨功能有限。在CRD 刺激达到60~80 mmHg 时,DCN 神经元细胞的放电数基本呈现平台趋势。
3.3 内脏伤害性传入敏化DCN 神经元对穴区刺激的反应 为了研究内脏伤害性传入对穴位敏化的影响,我们采用的标准条件性刺激的程序的设定是首先观察外周兴奋性感受野位于穴位电针刺激引发的DCN 神经元激活反应,单纯给予大鼠20~80 mmHg的强度CRD 刺激对该神经元引发的激活反应,然后观察CRD刺激30 s,之后停止CRD 刺激,紧跟着给予30 s的1.5倍Aδ 纤维阈值的穴位电针检验刺激引发的激活反应强度的变化,以此在DCN 水平研究内脏伤害性刺激诱发的穴位敏化反应和相关机制。
本实验电针部位选择外周感受野位于同侧“足三里-上巨虚”穴区的DCN 神经元,亦即该神经元分别对CRD 和针刺足三里-上巨虚穴区都发生激活反应。实验观察到持续30 s的20~80mmHg的CRD 刺激对延髓DCN 神经元有随着CRD 量的增加逐渐出现明显的激活作用。在CRD 刺激后给予单纯电针刺激,DCN神经元对电针的激活反应明显增强(参见表1 和图4),表明在给予大鼠持续的伤害性CRD 刺激造成内脏伤害性损伤后,腧穴的效应发生了敏化,这种穴位的敏化反应与内脏伤害性强度成正比。
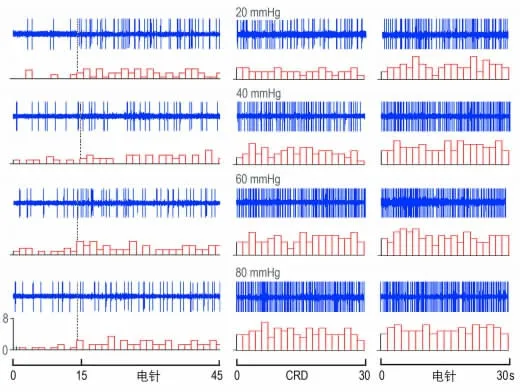
图4 电针在CRD 前后对DCN 神经元的激活作用(分别为20、40、60 和80 mmHg)。
表1 不同强度CRD 前后,电针引起的DCN 神经元的放电数()
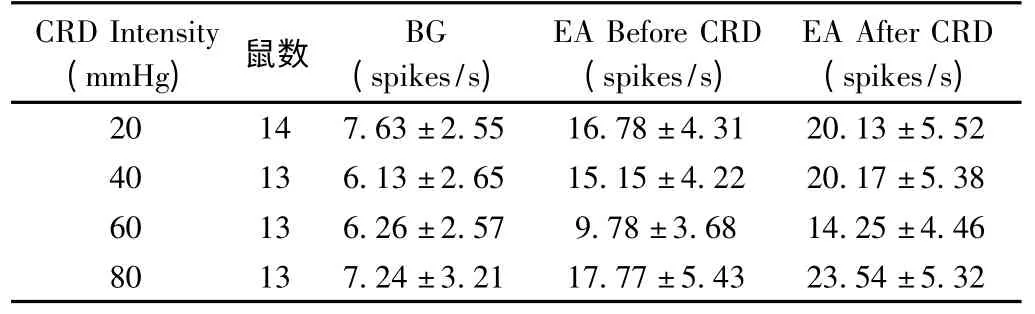
表1 不同强度CRD 前后,电针引起的DCN 神经元的放电数()
在14个DCN 神经元观察了20 mmHg CRD 时1.5倍Aδ 纤维激活强度电针刺激引起的激活反应,如图4所示:在20 mmHg 强度的CRD 前,电针刺激对DCN 神经元有明显的激活作用,和背景活动相比,电针引起的神经元的激活百分比增加了(119.74±14.57)%,结果显示有统计学意义(P<0.001);而给予CRD 刺激后,电针对DCN 神经元产生的激活反应有所升高,为CRD前电针激活效应的(119.45±12.84)%,有统计学意义(P<0.05)。
在13个DCN 神经元观察了40 mmHg 微伤害强度CRD 时同等强度电针刺激引起的激活反应,电针引起的神经元的激活反应在CRD 后增加了(21.52±4.89)%,统计学结果显示有统计学意义(P<0.05);而在60 和80 mmHg 伤害强度的CRD 后,电针激活DCN 神经元的程度分别增加了(29.51±5.78)% 和(32.07±6.32)%,都具有统计学意义(P<0.05)。在20~80 mmHg 强度的CRD 之间,同强度电针对DCN神经元激活反应的易化作用随着内脏扩张的伤害性强度的增加而增加,呈现一定的量效线性关系(见图5)。
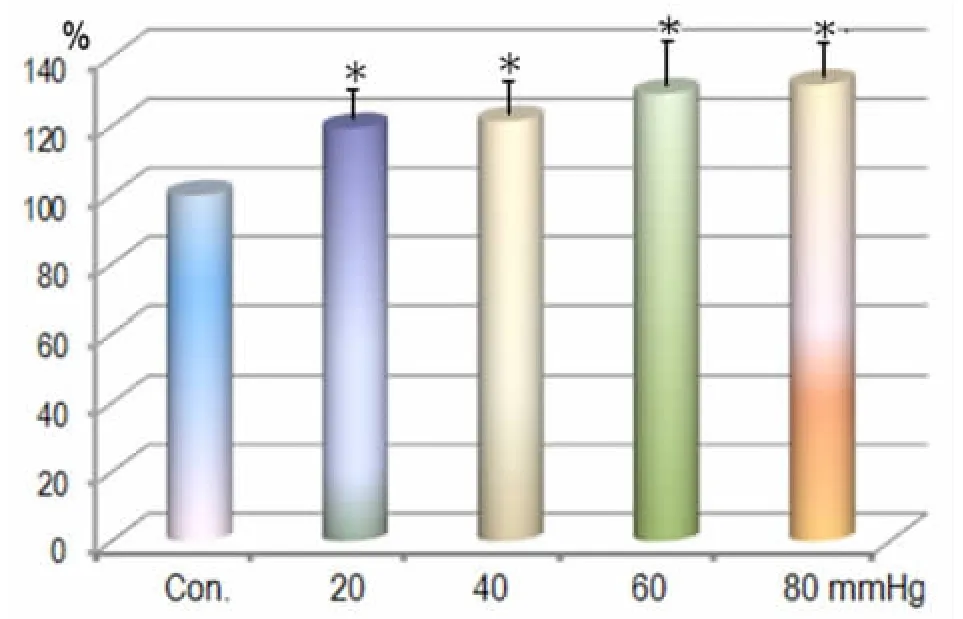
图5 不同强度CRD 前后电针对DCN 神经元激活作用的比较
这些结果表明:伤害性内脏扩张刺激可以敏化延髓的DCN 神经元,使其对穴位的电针传入产生更强烈的反应,DCN 神经元在内脏伤害性损伤后功能易化导致了穴位敏化的动态变化;而且,随着内脏伤害性刺激的强度加大,对穴位的敏化作用进一步加强,呈现出一定的量效敏化关系。这些结果表明延髓DCN 参与了腧穴敏化的动态变化过程。
4 讨论
背柱核(DCN)神经元传统上被认为是躯体传入的高级中枢。由脊髓背柱的上行粗大纤维组成内侧的薄束和外侧的楔束,薄束由来自T6以下节段的纤维组成,楔束由来自T6以上节段的纤维组成。薄束和楔束上行到达延髓背侧面分别终止于薄束核和楔束核。二者合称后索核,又称延髓背柱核(Dorsal Column Nuclei,DCN)。一般认为,DCN 主要接受来自脊神经节的一级传入纤维,但也接受来自脊髓背角的二级传入纤维。从DCN 发出的有髓纤维绕经中央管在其腹侧交叉,交叉后的纤维折向上行,组成内侧丘系,其纤维上达丘脑和大脑皮层。DCN 神经元对来自皮肤、关节以及肌肉感受器的冲动发生反应。
早在上个世纪50年代,Aidar 等[11]在猫的薄束核记录到刺激内脏大神经诱发的反应。Rigamonti 和Hancock[12-13]同样在猫的薄束核记录到刺激内脏神经引起的场电位反应和单个神经元的激活。解剖学的研究表明,薄束核接受来自内脏大神经的初级传入[14]和接受来自腰髓的非初级传入[15-17]。
皮肤震动的条件刺激不但可使DCN 神经元放电增加,在停止皮肤震动的条件刺激的即刻给予CRD 作为检验刺激,CRD的反应则反而有所抑制,虽然抑制率仅为13%左右。反过来,先给CRD 作为条件刺激(也可引起DCN 神经元放电增加),在停止CRD的即刻给予皮肤震动的检验刺激却可以易化神经元的反应,这种结果表明内脏痛时出现的体表相应神经节段的反应过敏及牵涉痛有关,也与中医针灸的阿是穴出现相关。在观察的20个DCN 神经元中,非感受野区穴位针刺刺对DCN 神经元CRD 反应的抑制率为23%。这些结果表明,在DCN 水平,针刺对CRD 引起这类神经元的兴奋反应有一定程度的抑制作用,统计学处理的结果表明具有统计学意义。可以认为,DCN在感受内脏伤害性反应的过程中,受到来自体表针刺的较弱而有效的抑制作用[10]。
Willis 研究组开始的实验是确定是否存在经背柱的内脏伤害感受的通路,他们采用记录丘脑腹后外侧核(VPL)单细胞活动的电生理学方法,直-结肠扩张(CRD)以及结肠炎症化可激活VPL 神经元;这些神经元同时也对皮肤的机械刺激发生反应。随后切断背柱发现可降低VPL 神经元60%~80%对CRD的反应,而切断脊-丘束的前外侧柱仅减少VPL 神经元20%对CRD的反应[16,18]。背柱切断还明显减少皮肤弱刺激引起的VPL 神经元激活反应,但对伤害性机械刺激反应影响较小;而切断脊-丘束的前外侧柱几乎完全阻断了皮肤伤害性机械刺激引起的VPL 神经元激活反应,但对非伤害性皮肤刺激反应影响较小。切断背柱也减小结肠炎症刺激而引起的VPL 神经元的敏化反应,而切断脊-丘束的前外侧柱则影响较小;用电解法或用海人酸损毁薄束核也减少CRD 激活的VPL 神经元激活反应[19]。这些工作表明在向VPL 传导直-结肠伤害性信息方面,背柱通路比脊-丘束通路更为重要。Berkley 和Hubscher[20]报告约有50%的DCN 神经元既对轻柔的皮肤刺激也对子宫和阴道的扩张刺激发生激活反应。Al-Chaer 等[18]在DCN 单细胞记录的实捡中发现能被丘脑腹后外侧核和内侧丘系逆向刺激激活的神经元也对皮肤和直-结肠的机械和化学刺激发生反应。他们认为,DCN 中来自皮肤的传入主要是初级感觉传入,而来自内脏的传入则很可能在初级传入与突触后背柱神经元之间存在突触传递。Al-Chaer 等[4-5]还进一步观察到内脏和皮肤传入到薄束核的反应可被T10 水平的背索切断而阻滞。
穴位敏化和穴位扩大的机制与外周和中枢的敏化机制密切相关。Handwerker 和Kobal[21]观察到在局部使用芥末油5 min 和/或辣椒素30 min 后对C-伤害感受器变得敏感,以致出现对先前不出现反应的刺激发生激活。另外,经过这种化学处理后,可使伤害感受野的领地扩大。据此作者认为,皮肤中的这种C-伤害感受器末梢存在“静寂分支”或是沉默神经元变成响应神经元,化学物质处理后使这些静寂分支发生敏化,从而使其感受野扩大化。各种病理因素引起外周或中枢敏化后,不同水平突触的活动依赖性的功能可塑性改变,降低离子通道激活阈值(如:从生理状态下的42℃降为炎症情况下的37℃)。突触功能加强和沉默突触活化,从正常突触传递(中间突触)转变为突触前传递增强或突触后传递敏化。中枢敏化的结果表现为损伤后自发活动增加,对伤害性刺激反应增加和外周感受野的扩大。神经元激活呈现“wind-up”现象,募集更多的神经元共同对伤害性刺激同步发生爆发性反应,导致损伤后或炎症时向高位中枢“净”传递功能加强[22]。
因此,根据我们的实验和他人的工作,内脏痛刺激之后对皮肤感受野或穴区对触觉刺激和电针刺激发生敏化反应,使穴位的效应发生了以敏化反应为主的动态改变;而且,随着内脏伤害性刺激的强度加大,对穴位的敏化作用进一步加强,呈现出明显的量效敏化关系。这些结果表明延髓DCN 参与了腧穴敏化的动态变化过程。DCN 作为分辨触觉和运动觉的中枢结构,也在传递内脏伤害性信息过程中起一定的作用[23],体表刺激、特别是针灸刺激能够受内脏的伤害性传入的影响,表明DCN 是一个重要的体表传入和内脏伤害性信息传导通路和整合中枢。
[1]荣培晶,朱兵.心经经脉、心源性牵涉痛与心脏相关联系的病理生理学机制研究[J].中国科学C 辑,2002,32:63-68.
[2]张建梁,陈淑萍,刘俊岭.心包经与心脏相互联系途径的研究[J].针刺研究,2002,27:124-129.
[3]Jou CJ,Farber JP,Qin C,et al.Afferent pathways for cardiac-somatic motor reflexes in rats [J].Am J Physiol Regul Integr Comp Physiol,2001,281:2096-2102.
[4]Al-Chaer ED,Lawand NB,Westlund KN,Willis WD.Visceral nociceptive input into the ventral posterolateral nucleus of the thalamus:a new function for the dorsal column pathway[J].J Neurophysiol,1996,76:2661-2674.
[5]Al-Chaer ED,Lawand NB,Westlund KN,et al.Pelvic visceral input into the nucleus gracilis is largely mediated by the postsynaptic dorsal column pathway[J].J Neurophysiol,1996,76:2675-2690.
[6]Al-Chaer ED,Westlund KN,Willis WD.Nucleus gracilis:an integrator for visceral and somatic information[J].J Neurophysiol,1998,78:521-527.
[7]Willis WD,Al-Chaer ED,Quast MJ,et al.A visceral pain pathway in the dorsal column of the spinal cord[J].PNAS,1999,96:7675-7679.
[8]Ness TJ,Metcalf AM,Gebhart GF.A psychophysiological study in humans using phasic colonic distension as a noxious visceral stimulus[J].Pain,1990,43:377-386.
[9]Zhu B,Xu WD,Rong PJ,et al.A C-fiber reflex inhibition induced by electroacupuncture with different intensities applied at homotopic and heterotopic acupoints in rats selectively destructive effects on myelinated and unmyelinated afferent fibers[J].Brain Res,2004,1011:228-37.
[10]Rong PJ,Zhang JL,Zhang HQ.Interactions between tactile and noxious visceral inputs in the rat nucleus gracilus[J].Neuroscience Letter,2004,362:162-165.
[11]Aidar O,Geohegan WA,Ungewitter LH.Splanchnic afferent pathways in the central nervous system[J].J Neurophysiol,1952,15:131-138.
[12]Rigamonti DD,Hancock MB.Analysis of field potentials elicited in the dorsal column nuclei by splanchnic nerve A-beta afferents[J].Brain Res,1974,77:326-329.
[13]Rigamonti DD,Hancock MB.Viscerosomatic convergence in the dorsal column nuclei[J].Exp.Neurol,1978,61:337-348.
[14]Kuo DC,De Groat WC.Primary afferent projections of the major splanchnic nerve to the spinal cord and the nucleus gracilis of the cat[J].J Comp Neurol,1985 231:421-434.
[15]Cliffer KD,Giesler GJJ.Postsynaptic dorsal column pathway of the rat.III.Distribution of ascending afferent fibers[J].J Neurosci,1989,9:3146-3168.
[16]Hirshberg RM,Al-Chaer ED,Lawand NB,et al.Is there a pathway in the posterior funiculus that signals visceral pain[J].Pain,1996,67:291-305.
[17]Rustioni A.Non-primary afferents to the nucleus gracilis from the lumbar cord of the cat[J].Brain Res,1973,51:81-95.
[18]Al-Chaer ED,Westlund KN,Willis WD.Potentiation of thalamic responses to colorectal distension by visceral inflammation[J].Neuroreport,1996,7:1635-9.
[19]Al-chaer ED,Karin N.Westlund KN,et al.Nucleus gracilis:an integrator for visceral and somatic information[J].J Neurophysiol,1997,78:521-527.
[20]Berkley KJ,Hubscher CH.Are there separate central nervous system pathways for touch and pain[J].Nature Med,1995,1:766-73.
[21]Handwerker HO,Kobal G.Psychophysiology of experimentally induced pain[J].Physiol Rev,1993,73:639-71.
[22]Kuner R.Central mechanisms of pathological pain[J].Nat Med,2010,16:1258-66.
[23]Palecek J.The role of dorsal columns pathway in visceral pain[J].Physiol Res,2004,53 Suppl 1:S125-30.

