戴氏绿僵菌变种拮抗耐甲氧西林金黄色葡萄球菌的作用
余 瑛,张孝彬,陈玉燕,杨艳红
(重庆理工大学药学与生物工程学院,重庆 400054)
虫草是一类复型真菌,其无性型产生的次级代谢产物具有抗菌、抗病毒、抗癌、杀虫、调节机体免疫、抗氧化[1]等作用,在医药领域有很大的应用潜力。戴氏绿僵菌变种Metarhizium taii var.chongqingensis nov(M.taii var)是一种低海拔地区虫草的无性型菌株。本文报道了M.taii var发酵产物拮抗耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus,MRSA)的初步研究结果。
1 材料与方法
1.1 材料
1.1.1 菌种
供试菌:M.taii var,由重庆理工大学杨艳红分离保存。
病原菌:MRSA标准菌株WHO2、临床分离的金黄色葡萄球菌(Staphylococcus aureus,SA)共10株,由第三军医大学西南医院惠赠。
1.1.2 培养基
1)PDA固体培养基:马铃薯200 g,葡萄糖20 g,琼脂 15 g,pH=7.0,去离子水定容至 1 000 mL。
2)细菌培养基:胰蛋白10 g,酵母粉5 g,氯化钠 5 g,Ph=7.0,去离子水定容至 1 000 mL。
3)抑菌平板培养基:胰蛋白10 g,酵母粉5 g、氯化钠5 g,琼脂30 g,去离子水定容至1 000 mL。
4)生长发酵培养基:NaNO30.5 g,KCl 0.5 g,蔗糖 30 g,蚕蛹粉 0.5 g,pH=6.5,去离子水定容至1 000 mL。
5)发酵培养基:葡萄糖10 g,蛋白胨2.5 g,酵母粉 5 g,pH 值为 6.0 ~7.0,去离子水定容至1 000 mL。
1.1.3 主要试剂
蛋白酶K,购自鼎国生物技术有限公司。
1.2 方法
1.2.1 供试菌种的活化
取-80℃冰箱保存的供试菌 M.taii var,在PDA平板上划线接种,于28℃培养14 d至孢子发育成熟。
1.2.2 供试菌的发酵培养
孢子悬液的制备:从PDA平板上刮取孢子,用无菌水重悬成孢子悬液后以4层无菌擦镜纸过滤孢子液,血球计数板计数孢子,并调整孢子悬液浓度为109cell/mL。
接种及发酵:取100 μL孢子悬液接种到100 mL生长培养基中。培养2 d后,按1∶10接种至发酵培养基中。发酵培养条件优化应用正交设计法,采用2组变量:发酵培养基 pH 值为5.5、6.0、6.5、7.0;培养温度为 25℃、28℃、30℃。发酵培养3~9 d,每日取发酵上清2 mL,10 000 r/min离心5 min,取上清进行抗WHO2的活性测定。
1.2.3 病原菌的培养
挑取活化的WHO2或各临床分离的SA单克隆分别接种于 100 mL细菌培养基,37℃,250 r/min过夜培养,备用。
1.2.4 抑菌活性测定
M.taii var发酵上清拮抗WHO2的活性测定采用琼脂扩散法[2]。将过夜培养的 WHO2,用血球计数板计数调整浓度为104个/mL,用移液枪吸取100 μL菌液,均匀涂布到抑菌平板培养基上。用打孔器在培养基上打孔,孔中加入发酵上清液150 μL,于37℃恒温培养箱中放置培养12 h,测定抑菌圈直径大小。
临床分离的SA对甲氧西林敏感性测定结果由西南医院提供。SA对M.taii var发酵上清的敏感性采用琼脂扩散法测定。
1.2.5 高温及蛋白酶K对M.taii var发酵上清活性的影响
将发酵液上清分别在45℃、65℃、85℃、100℃各处理5 min、10 min、15 min,测定抑菌活性。用未经高温处理的发酵液上清作对照。
分别在100 μL发酵液上清中加入质量体积分数为10 mg/mL蛋白酶 K 50μL,37℃各孵育30 min、60 min,测定抑菌活性。用未加入蛋白酶 K发酵液上清作对照。
2 结果与分析
2.1 发酵温度及pH对M.taii var发酵上清抗菌活性成分表达的影响
在前期已对培养基进行筛选的基础上,采用不同pH的发酵培养基和发酵温度进行培养,提取发酵上清测定抑菌活性,结果(见表1)表明:30℃,pH值为5.5~6.0条件最适合抑菌成分的表达,该条件下发酵上清的抑菌活性最先达到峰值,即发酵7 d时抑菌圈直径达到3.6 cm,其活性高于其他条件下的发酵上清。

表1 不同培养温度、pH条件下M.taii var发酵上清拮抗MRSA的活性
2.2 高温对M.taii var发酵上清抗菌活性的影响
将M.taii var发酵上清分别用45℃、65℃、85℃、100℃处理后,测定其抑菌活性变化,结果显示:不同温度处理后 M.taii var发酵上清拮抗WHO2的抑菌圈直径无显著变化(见图1),即M.taii var发酵上清中的抑菌成分在高温条件下活性稳定。
2.3 蛋白酶K对M.taii var发酵上清抗菌活性的影响
在M.taii var发酵上清中加入蛋白酶K,37℃孵育30 min或60 min后测定其抑菌活性变化,结果显示:处理后的M.taii var发酵上清拮抗WHO2的抑菌圈大小无显著变化(见图2),即蛋白酶K对M.taii var发酵上清中的抑菌成分活性无影响。
2.4 M.taii var发酵上清对各临床分离SA的拮抗作用
测定M.taii var发酵上清对各临床分离SA的抗菌活性,结果显示该发酵上清对临床分离的SA菌株均有拮抗作用,其抑菌圈直径在3.4~3.6 cm(表2未显示),这些被检测的SA中有对甲氧西林耐受菌株即MRSA菌株,也有对甲氧西林敏感的SA菌株(见表2)。

图1 M.taii var抑菌成分在高温处理后的稳定性

表2 M.taii var发酵上清对临床分离SA的抗菌活性
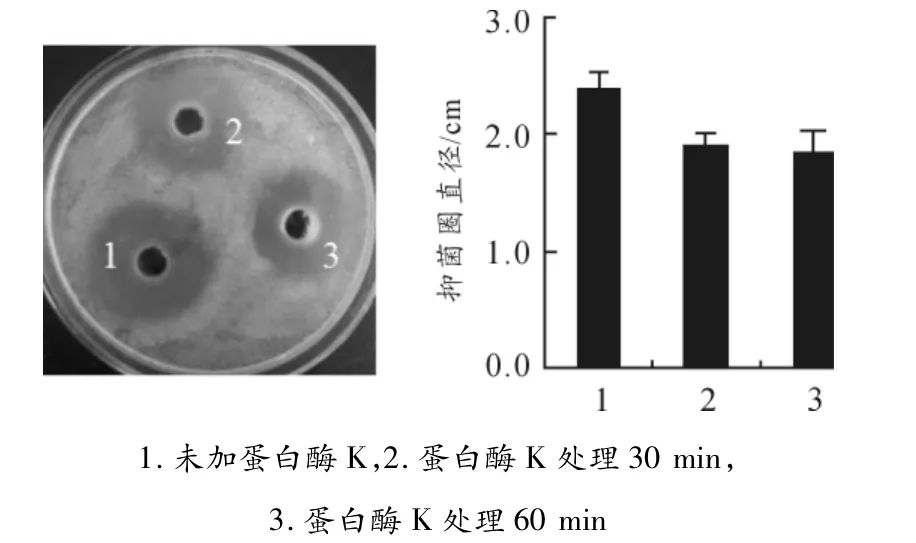
图2 M.taii var发酵上清抑菌成分经蛋白酶K消化后的活性
3 讨论
SA是引起细菌性食物中毒和化脓感染最常见的病原菌之一。自19世纪40年代青霉素问世以来,SA引起的感染性疾病受到较大的控制。但随着青霉素的广泛使用,有些SA产生了一种能水解β-内酰胺环的酶,可使青霉素无效,即产生了耐药性。随后推出的甲氧西林在临床使用2年后就出现了耐甲氧西林的菌株MRSA[3]。目前,MRSA已成为院内感染的重要病原菌之一。耐药菌株的不断出现,使得MRSA治疗药物变得日益匮乏,寻找新的抗MRSA活性物质来源是进行新型抗MRSA药物研发的工作基础。本研究研究证实M.taii var发酵上清对临床分离的不同MRSA菌株及普通SA菌株都有抗菌活性,表明M.taii var产生的抗菌成分与甲氧西林有不同的抗菌机制,该活性物该抗菌成分还有耐高温和抗蛋白酶K水解的特性,在pH值为5.6~6.0,温度为30℃时表达活性最高。已有的研究结果显示绿僵菌、白僵菌等真菌的次生代谢产物中含有一种结构为环肽的绿僵菌素(destruxins,Dtxs)[4-5],具有抗菌、抗虫、抗肿瘤、抗炎症、抗骨质疏松、免疫抑制等多种活性[6],Dtxs结构均由一个α-羟酸和5个氨基酸残基构成,不同菌株来源的Dtxs的α-羟酸类型、N-甲基化修饰、氨基酸侧链基团有所不同,均有耐高温、抗蛋白酶水解的特性[7]。M.taii var抗MRSA是否含有与先前报道的DTXs类似的结构仍需进一步研究。
[1]焦彦朝,梁宗琦,刘爱英.虫草生物活性物质研究概况[J].贵州农业科学,1990(3):53-58.
[2]周长林.微生物学实验与指导[M].北京:中国医药科技出版社,2008.
[3]Jensen J U S,Jensen E T,Larsen A R,et al.Control of a methicillin-resistant Staphylococcus aureus(MRSA)outbreak in a day-care institution[J].Journal of Hospital Infection,2006,63(1):84-92.
[4]Peng K C,Huang H S,Teng Y M,et al.Circular dichroism analysis of destruxins from Metarhizium anisopliae O-riginal Research Article[J].Journal of Biochemical and Biophysical Methods,2005,62(1):41-50.
[5]Morais-Urano R P,Chagas A C S,Berlinck R G S,et al.Acaricidal action of destruxins produced by a marine-derived Beauveria felina on the bovine tick Rhipicephalus(Boophilus)microplus[J].Experimental Parasitology,2012,132(3):362-366.
[6]Sarabia F,Chammaa S,Sánchez-Ruiz A,et al.Chemistry and biology of cyclic depsipeptides of medicinal and biological interest[J].Curr Med Chem,2004(11):1309.
[7]Asai T,Yamamoto T,Chung Y M,et al.Aromatic polyketide glycosides from an entomopathogenic fungus[J].Cordyceps indigotica Tetrahedron Letters,2012,53:277-280.

