MRC-5、Vero、Hep-2及 RD 细胞对柯萨奇A16病毒的敏感性比较
杨海玉,查 杰,马智龙
(泰州市疾病预防控制中心,江苏泰州225300)
手足口病是5岁以下儿童中发生的常见传染病,但目前尚无针对手足口病的预防性疫苗或治疗性药物。柯萨奇A16(CoxA16)病毒是引起儿童手足口病的重要病原体,其地方株的分离是对本病进行诊断和防治的基础,可以为我国对CoxA16的研究、毒株的鉴定提供参考和依据[1]。细胞培养是分离病毒的传统可靠方法,50%组织培养感染剂量法(TCID50法)指能在半数细胞培养板孔或试管内引起细胞病变(CPE)的病毒量,已被用于测定许多种病毒的滴度,与其他传统方法相比,具有速度较快、结果可重复、更稳定的优点,且能间接反映病毒的感染力。2012年9~12月,本研究通过观察MRC-5、Vero、Hep-2及RD细胞在相同条件下感染CoxA16后的TCID50,比较其对CoxA16的敏感性。现报告如下。
1 材料与方法
1.1 材料 Vero、MRC-5细胞由中科院上海细胞库提供,RD、Hep-2细胞由江苏省疾控中心流感室提供,均由本实验室稳定传代后保存。CoxA16病毒为泰州市2012年手足口病监测临床样本中分离,由Vero细胞传代扩增。随机选择3株用于实验,编号为 TZCoxA16-001、TZCoxA16-002、TZCoxA16-003。DMEM培养液、胎牛血清、青霉素链霉素双抗和EDTA-胰酶等为 Gibco产品,其他试剂均为国产分析纯。
1.2 方法
1.2.1 细胞传代培养 MRC-5、Vero、Hep-2及 RD细胞分别培养于含有10%胎牛血清的DMEM培养液中,37℃、5%CO2、饱和湿度传代,分数个T25细胞瓶。待细胞长成单片80%以上时,换培养液1次,总体积为6 mL。
1.2.2 敏感性检测 上述4种细胞经消化液消化后,800 r/min离心3 min,加10 mL培养液重新悬浮,吹打均匀,用排枪吸100μL加入96孔培养板,每加1次,剩下的细胞液要重新吹打均匀。细胞加完后,上下左右混合均匀,置于37℃、5%CO2、饱和湿度培养箱中培养12 h。弃去培养液,用D-hanks液清洗2遍。将3株CoxA16病毒毒株用病毒生长液分别作 10 倍系列稀释,取 10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8共 8 个稀释度,每个稀释度取0.1 mL 分别接种于长满单层的 MRC-5、Vero、Hep-2及RD细胞的96孔细胞培养板中,每个稀释度接种10孔,另设16孔只接种稀释液作为空白对照,0.1 mL/孔。置于37℃、5%CO2培养箱中培养120 h,每12 h观察各孔CPE情况,出现CPE为感染,即细胞圆缩、折光性增强、细胞核固缩、碎片增多,胞体逐渐空泡化直至破裂。见插页Ⅲ图4。及时记录细胞病变孔数,直到对照细胞老化脱落为止,取3株毒株培养板的平均值。“+”表示25%以内细胞出现CPE;“++”表示25% ~50%细胞出现CPE;“+++”表示50% ~75%细胞出现 CPE;“-”表示无CPE;“/”表示培养终止。按 Reed-Muench 法[2,3]计算各细胞培养96、108、120 h的TCID50。
2 结果
2.1 4种细胞接种后CoxA16病毒CPE情况 见表1。

表1 4种细胞接种CoxA16病毒后CPE情况
2.2 4种细胞不同培养时间的TCID50 见表2。
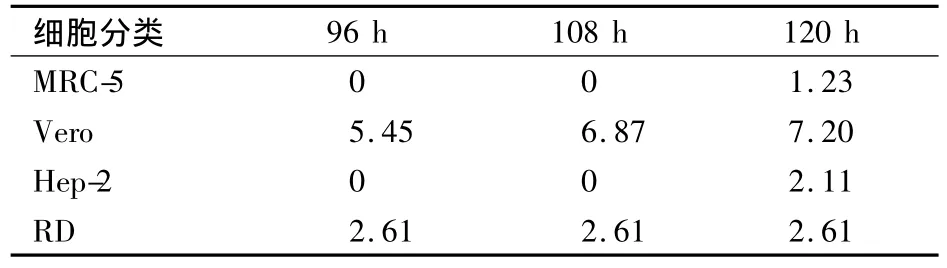
表2 4种细胞不同培养时间的TCID50
3 讨论
自2008年以来,我国儿童中手足口病流行趋势越来越严重。仅2010年国家卫生统计数据显示,我国内地共发生1 774 669例手足口病病例,造成905例死亡和超过2万例重症。CoxA16和人肠道病毒71型(EV71)是引起手足口病的主要病原体[4]。CoxA16病毒属于小核糖核酸(RNA)病毒科,肠道病毒属,可致人类多种疾病。自1948年从脊髓灰质炎患儿粪便中分离出该病毒以来,已在全世界引起多次爆发和流行,受到人们的广泛关注[5,6]。在CoxA16流行期间,虽然可通过血清中和试验和核酸扩增测序等手段进行鉴定分型,但病毒分离培养仍然是十分实用和可靠的诊断办法[7]。
分离肠道病毒所选用的细胞系一般都为人源或猴源细胞[8],本研究根据以往实验经验结合本实验室细胞库储存,选择了MRC-5、Vero、Hep-2及RD 4种细胞,通过几种细胞可引起CPE的出现时间及TCID50值来综合比较其对CoxA16的敏感性。结果显示,Vero和RD细胞在36 h即可出现肉眼可见的细胞病变,Vero和RD细胞96 h的TCID50分别是5.45、2.61。这提示 Vero细胞敏感性最好,病毒产量也最高,在感染后4~5 d可收获;而RD细胞出现细胞病变最快,一般在2~3 d,但病毒滴度不高。这和手足口病预防控制指南(2009版)中描述的RD细胞培养CoxA16病毒需要盲传一代[9]的说法一致,也可能和本实验室存储的RD细胞代次较低,敏感性下降有关。Hep-2细胞也能形成稳定的细胞病变,可作为CoxA16分离培养的可选细胞;MRC-5由于在体外传代数有限,且培养周期较长,故在实验室应用受到一定限制[10]。
本研究证明,4种细胞对CoxA16病毒的敏感性由高到低依次为 Vero、RD、Hep-2、MRC-5。因此,Vero细胞可作为当前本地区CoxA16病毒分离的首选细胞,为进一步研究提供了技术储备,但本研究是用CoxA16病毒毒株稀释后模拟样品进行实验,进一步的结论还需要大量不同时期样品的验证。
[1]李兰娟.手足口病[M].杭州:浙江科学技术出版社,2009:1-61.
[2]中华人民共和国农业部.中华人民共和国兽用生物制品质量标准(2001年版)[S].北京:中国农业科技出版社,2001:303.
[3]Gustafsson RK,Engdahl EE,Fogdell-Hahn A.Development and validation of a Q-PCR based TCID50 method for human herpesvirus 6[J].Virol J,2012,18(9):311.
[4]杨海玉,马智龙,查杰.泰州市2009年手足口病病原检测分析[J].中国热带医学,2010,10(1):65-111.
[5]王潇潇,郝春生,李懿,等.33株柯萨奇病毒A组16型分离株的全基因序列分析[J].中国生物制品学杂志,2013,26(3):309-314.
[6]武珊,王文瑞,海岩.柯萨奇病毒A组16型研究进展[J].疾病监测与控制杂志,2011,5(8):478-480.
[7]杨海玉.MDCK、Vero和Hep-2细胞共培养分离甲型H1N1型流感病毒[J].医学动物防制,2011(5):438-439.
[8]David MK,Peter MH.Fields Virology[M].5th ed.Philadelphia USA:Lippincott Williams and Wilkins,2007:845.
[9]卫生部.手足口病预防控制指南(2009版)[R].卫生部公报,2009,12:64.
[10]易波,顾文珍,贺天峰,等.宁波市2010年-2011年重症手足口病病原学及流行特征分析[J].中国卫生检验杂志,2012,22(7):1670-1673.

