紫外线诱导大肠杆菌产生对鲎素抗药性菌株的研究
洪 军,胡建业,牛亚菲,姬晓娜,赵安芳,王奕霞,黄琼琳,李光耀
(河南城建学院生物工程系,河南 平顶山 467036)
抗生素药物的滥用,导致了许多细菌、尤其是致病菌的抗药性问题.耐药性超强的“超级细菌”的出现更加重了人们对抗生素使用的担心,细菌的抗药性已成为困扰21 世纪人类医学、养殖业等发展的世界性难题,迫切需要产生一种新的抗菌药物来替代抗生素.而抗菌肽(Antimicrobial peptides,AMPs)是生物体抵御外源性病原微生物的入侵而产生的一类小分子多肽,因其抗菌谱广且不易使细菌产生抗药性,因而有望成为新一代抗菌药物[1,2].目前,它已广泛应用于转基因动植物、药物开发、临床治疗、食品防腐剂和饲料添加剂等,显示出良好的应用与发展前景.鲎素(TachyplesinI)是1988年由NAKAMURA 等人从中国鲎血细胞的酸性提取物中分离出来的一种具有典型环状β-折叠结构的抗菌肽(AMPs),它由17个氨基酸残基构成.研究发现,鲎素具有广谱抗菌活性,可抑杀细菌、真菌、病毒和原虫,还具有抑制肿瘤细胞增殖和诱导癌细胞分化的作用[3~8].因其潜在作用和较小的相对分子质量,在医药、畜牧和食品等领域有望成为新一代的抗生素替代品[9~11].在作者前期的研究中采用2种短期诱导方法,研究鲎素能否诱导细菌产生抗药性,结果表明,鲎素对大肠杆菌ATCC25922、致病性大肠杆菌F41和金黄色葡萄球菌ATCC25923 均未诱导出抗药性[12].紫外线、亚硝基胍、离子束辐射等理化因素均是微生物中常用的诱变剂,经这些诱变剂处理的细菌能引起基因突变,更易导致抗药性的产生.当紫外线直接照射细菌时,辐射引起正常DNA分子相邻胸腺嘧啶分子彼此结合形成二聚体,从而可能获得变异的抗药菌株.关于诱变细菌对鲎素耐受性的研究目前尚属空白.本研究以大肠杆菌JM109和ATCC25922为研究对象,通过紫外线诱变技术对原始菌株进行诱变,以相应的未诱变菌株作对照,并通过鲎素浓度梯度平板对大肠杆菌进行初筛.一方面对初筛到的抗鲎素菌株进行亚抑菌浓度鲎素的连续传代诱导,观察紫外线对大肠杆菌的生物学效应及其鲎素对紫外线诱变的细菌产生抗药性的难易程度;另一方面,通过抗生素对初筛到的抗鲎素菌株进行敏感性测定,观察抗生素与鲎素是否有交互抗性.
1 材料与方法
1.1 材料
1.1.1 试验材料 供试菌株:大肠杆菌ATCC25922 由广东省微生物保藏中心提供,大肠杆菌JM109 由河南城建学院生物工程系保存.抗菌剂:鲎素由吉尔化(上海)有限公司合成,纯度为95%以上,合成的鲎素含有2个二硫键,分别位于Cys-3和Cys-16 及Cys-7和Cys-12 之间;盐酸左氧氟沙星和氨苄青霉素,分别由康普药业股份有限公司和江西东风药业股份有限公司提供.
培养基:营养琼脂、酵母膏、胰蛋白胨由北京奥博星生物技术有限公司提供;琼脂糖由上海艾研生物科技有限公司提供;氯化钠由洛阳市化学试剂厂提供;MH 肉汤由杭州天和微生物试剂有限公司提供.
1.1.2 主要仪器设备 HZQ-F160型全温振荡培养箱(哈尔滨市东联电子技术开发有限公司),LRH-250F型生化培养箱(上海一恒科技有限公司),DG5033A型酶联免疫检测仪(南京华东电子集团医疗装备有限责任公司).
1.2 药敏试验
从斜面保存的菌种上挑取一环细菌,接种于灭菌三角瓶中的营养肉汤培养基中,在37℃250 r·min-1恒温摇床上过夜培养.第2天再按1∶100的菌液与培养基的比例转接,培养至2~3 h,将培养后的菌液用MH 肉汤培养基稀释成106个mL-1的菌悬液,向无菌的96 孔平板中的第1~11 列中各加入100μL 菌悬液,12 列不加菌液而加营养肉汤作为阴性对照.然后从1~10 列中逐一加入100μL 用新鲜MH 肉汤配制的抗菌肽(AMPs),11 列作为阳性对照孔不加AMPs,37℃,90 r·min-1恒温培养20 h.用DG5033A型酶联免疫检测仪在490 nm 下对平板进行扫描,按照低于50%对照孔(11 孔)生长以上的最小质量浓度计算抗菌剂的最小抑菌浓度(MIC)值[13].
1.3 大肠杆菌的紫外线诱变
在菌种诱变前,先打开8W的紫外灯预热30 min,使光波稳定,照射距离为40 cm.取无菌的带有磁力搅拌器的无菌培养皿,加入细胞密度为107~108个mL-1的菌悬液;将待处理的培养皿置于诱变箱内的磁力搅拌仪上,静止1 min后开启磁力搅拌仪旋纽进行搅拌,然后打开皿盖,分别处理0,30,60,90 ,120,150 s,照射完毕后先盖上皿盖,再关闭紫外灯和搅拌器;分别取对照组和不同处理时间的菌液0.5 mL 进行适当稀释(10-4,10-5,10-6),将这3个稀释度倾注在LB 固体培养基平板上(每个稀释度做3个重复),37℃避光培养20 h,进行平板活菌计数,用于计算紫外线诱变致死率[14].
1.4 浓度梯度平板法筛选抗鲎素菌株
将不同时间诱变后的部分菌液,分别涂布于从低到高浓度的鲎素梯度LB 琼脂糖培养基平板上,置于37℃恒温培养20 h后,分别挑取生长在高浓度鲎素平板上的大肠杆菌ATCC25922,JM109和对照平板上的单菌落,接种于MH 肉汤培养基中,37℃过夜培养,然后进行药敏试验,方法参考1.2.
1.5 抗药性的判定折点
文献关于细菌对AMPs 抗药性的判断折点不尽相同.MARTINEZ 等[15]通过测定诱导菌株与原始菌株的MIC,来判定其抗药性,把细菌对AMPs的抗药性定义为:诱导后菌株与对照组菌株的MIC值相比显著性提高.本研究中,通过鲎素对原始菌株、相应对照诱导菌株和诱导菌株的MIC 测定,如果诱导菌株与对照组菌株的MIC 值相比提高2倍以上,判断为诱导出抗药性,否则表明在此实验条件下鲎素不能诱导细菌产生抗药性.
1.6 对诱变菌株的进一步筛选
将通过紫外线诱导获得的抗鲎素耐药菌株,在含有1/2MIC 浓度鲎素的培养基中连续传代N次后,采集诱导不同代的诱导菌株,进行MIC 测定.与此同时,在相同条件下,每代设不加鲎素的培养基连续传代菌株,作为对照选择菌株,把添加鲎素诱导的菌株作为阳性选择菌株.参考上述1.5 方法,判定有无更高抗鲎素菌株的产生.
1.7 耐药稳定性测定
将获得的抗鲎素耐药菌株,在不含鲎素的MH肉汤培养基中继续传代,每20 h 转种1次,连续转种5次后,将每次转种形成的各子代菌株以15%甘油-70℃冰箱中保存,分别测定其MIC 值,以观察其耐药表型的稳定性.
1.8 抗生素对鲎素抗药菌株的敏感性测定
盐酸左氧氟沙星和注射用苄星青霉素对抗鲎素菌株的敏感性测定,参考1.4.
2 结果与分析
2.1 紫外线诱变大肠杆菌剂量的选择
由图1可知,随着诱变剂量的递增,大肠杆菌ATCC25922和JM109的致死率逐渐上升,表明诱变时间和大肠杆菌的存活率之间存在一定的正比关系.当诱变时间≥60 s 时,死亡率已经超过75%.在辐射强度和辐射距离一定的情况下,大肠杆菌ATCC25922和JM109的致死率与辐射时间成正比(图1).

图1 不同剂量紫外线照射大肠杆菌的致死率Fig.1 The death rate of Escherichia coli induced by different ultraviolet radiation dose
由靶子学说可知,紫外线在诱变作用之初,菌株数目很大,而此时的辐射剂量很少,辐射作用呈单击现象,此时紫外光照射作用的效率很高.随着照射时间的延长,存活的菌株逐渐减少,变异菌株逐渐增加,突变率增大.由图1可知,在照射90 s后,菌株已大部分死亡,照射时间的增加已不能引起更多的变异.这时死亡的菌株被多次击中的机会增加,以致大部分的能量被死亡的菌株吸收,突变率下降较快,效应曲线趋于平稳.因此,可将混合菌紫外照射的最佳时间确定在菌株存活率从急剧下降到趋向平稳的转折点上,即照射时间为90 s.紫外照射时间为90,120,150 s的菌种致死率均大于90%,因此,经初步筛选,挑选照射时间为60,90,120 s的菌株作进一步筛选.
2.2 抗鲎素菌株的筛选
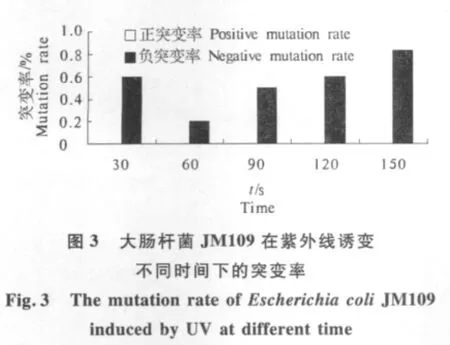
随机挑取生长在高鲎素浓度梯度培养基平板上诱变时间为60 s 9株,90 s 7株和120 s 8株的大肠杆菌ATCC25922 菌株,以及不同诱变时间的各9株JM109 菌株,分别与相应的对照组菌株进行MIC的测定.从大肠杆菌ATCC25922和JM109 药敏试验的结果可知,鲎素对大肠杆菌ATCC25922和JM109的MIC分别为5,10 mg·L-1.大肠杆菌ATCC25922 经紫外线诱变处理后,获得了MIC为10 mg·L-1的抗鲎素大肠杆菌ATCC25922-A1-90和大肠杆菌ATCC25922-A2-902株,以及MIC为20 mg·L-1的抗鲎素大肠杆菌ATCC25922-A1-601株;大肠杆菌JM109 经紫外线诱变处理后,它们中大部分呈负突变,MIC 值由10 mg·L-1降低为5 mg·L-1,一部分MIC 维持不变,如图2和图3.
从图2可知,大肠杆菌ATCC25922 在紫外线诱变时间为60,90 s 时,有正突变菌株产生,60 s的正突变率为14.29%,90 s的正突变率为22.22%,在紫外线诱变不同时间下的负突变率均大于正突变率.从图3可知,本试验条件下,大肠杆菌JM109在紫外线诱变不同时间均未获得抗鲎素的菌株.

对大肠杆菌ATCC25922 经紫外线诱变产生的ATCC25922-A1-90,ATCC25922-A2-90,ATCC25922-A1-603株低抗鲎素菌株,分别经过12 代1/2MIC 鲎素的连续传代,它们的MIC 与传代前均无变化,未诱导出更高抗药性.
2.3 抗药稳定性测定
对诱导出的3株低抗鲎素菌株大肠杆菌ATCC25922-A1-90、ATCC25922-A2-90 以及AT CC25922-A1-60,在无药MH 肉汤培养基中连续传代5次后,此3株菌株的MIC 值均无变化,结果表明,这3株低抗鲎素菌株的抗药性较稳定.
2.4 抗生素对低抗鲎素菌株的敏感性测定
抗生素对低抗鲎素菌株的敏感性测定结果如表1.由表1可知,注射用苄星青霉素对大肠杆菌JM109的MIC 是大肠杆菌ATCC25922的8倍,对大肠杆菌ATCC25922 经紫外诱导出来的3株低抗鲎素菌株的MIC 比原始菌株提高了128倍以上.大肠杆菌ATCC25922 无论是诱导菌株还是原始菌株,以及大肠杆菌JM109 均对盐酸左氧氟沙星敏感.总之,低抗鲎素菌株对苄星青霉素有显著抗药性,对盐酸左氧氟沙星仍然敏感.
3 讨论
AMPs 通常能快速杀死细菌并具有广谱抗菌活性,一些研究者认为它不易使细菌产生抗药性.但是随着对AMPs 研究的深入,发现细菌也同样会对某些AMPs 产生抗药性[16~18].研究表明,金黄色葡萄球菌能对防御素和人类AMPs 产生抗药性,并且金黄色葡萄球菌对防御素、细菌素和阳离子AMPs的抗药机制具有特异性[19].因此,一种新的AMPs 产品细菌是否对其产生抗药性成为问题的关键性.
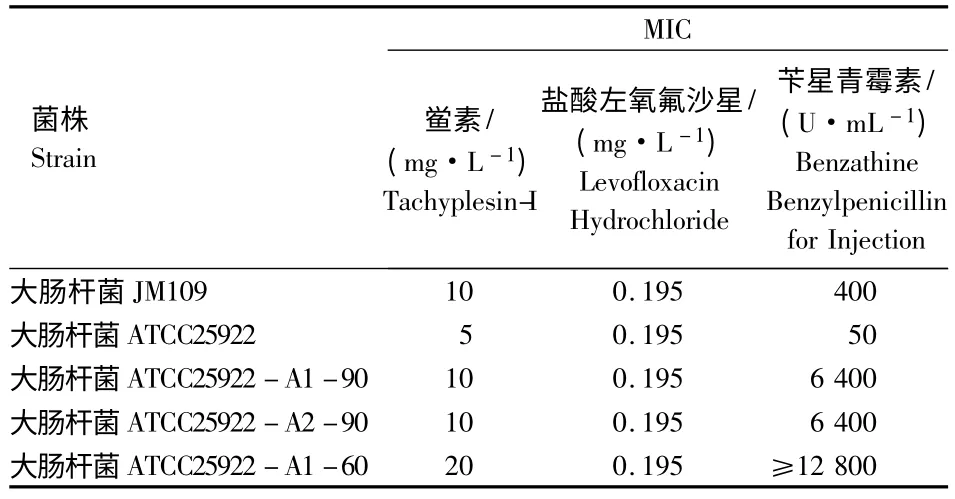
表1 3种抗菌剂对大肠杆菌MIC 比较Table 1 MIC comparison of three agents for Escherichia coli
紫外线作为一种物理诱变因子,具有诱变效果明显和方法简单等优点,是诱发微生物突变的一种非常有用的工具,在生产和科研中可利用它获得性能优良的突变株.目前,紫外诱变在生物防治方面应用较多,如田连生等[20,21]2006年采用紫外线诱变处理与药物培养基驯化培养相结合的方法,分离筛选出对速克灵有显著抗性的突变型木霉菌株UT-4,和对多菌灵具有明显耐药性的菌株T24-4和T24-6;詹儒林等[22]通过紫外线诱变获得了对多菌灵的抗性菌株,试验证明其抗性可提高120倍以上.Pexiganan 是一种阳离子AMPs magainin的类似物,GE[23]对大肠杆菌和铜绿假单胞菌通过化学诱变或者紫外诱变方法,均未诱导出对Pexiganan抗药性的菌株.
而本研究中,通过紫外线诱变大肠杆菌ATCC25922 筛选抗鲎素菌株,获得3株低抗鲎素菌株,对于JM109 未诱导出抗鲎素菌株.对诱导菌株和原始菌株进行抗生素和鲎素的敏感性测定,结果发现诱导菌株对鲎素的抗药性仅有轻微的提高,但对注射用苄星青霉素的抗药性显著性提高,对于此3株低抗鲎素菌株抗药性机制有待进一步深入研究.因其AMPs的杀菌机制的独特性,与抗生素相比,此结果进一步暗示大肠杆菌通过诱变更易对抗生素产生抗药性.
在抗生素耐药性日益严重、病毒病和肿瘤仍未攻克的今天,AMPs的出现无疑为人们寻找理想的抗菌、抗病毒和抗肿瘤药物提供了新的领域,AMPs的应用将给解决细菌抗药性、药物残留等关键问题带来希望.
[1]ZASLOFF M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415:389-395.
[2]BROGDEN K A.Antimicrobial peptides:Pore formers or metabolic inhibitors in bacteria[J].Nature Reviews Microbiology,2005,3(3):238-250.
[3]IWANAGA S.The molecular basis of innate immunity in the horseshoecrab[J].Curt Opin Lnmaunol,2002,14(1):87-95.
[4]MIYATA T,TOKUNAGA F,YONEYA T,et al.Antimicrobial peptides,isolated from horseshoe crab hemocytes,tachyplesin II,and polyphemusins I and II:chemical structures and biological activity[J].Journal of biochemistry,1989,106:663-668.
[5]MORIMOTO M,MORI H,OTAKE T,et al.Inhibitory effect of tachyplesin-I on the proliferation of human-immunodeficiency virus in vitro[J].Experimental Chemotherapy,1991,37(3):206-211.
[6]MORVAN A,IWANAGA S,COMPS,et al.In vitro activity of the Limulus antimicrobial peptide tachyplesin I on marine bivalve pathogens[J].Journal of invertebrate pathology,1997,69:177-182.
[7]李祺福,李长友,欧阳高亮,等.中国鲎鲎素对人胃腺癌BGC-823 细胞形态和超微结构的影响[J].厦门大学学报,2000,39(6):837-841.
[8]李祺福,欧阳高亮,洪水根,等.中国鲎鲎素对人肝癌SMMC-7721 细胞增殖的抑制作用[J].中国海洋药物杂志,2002(2):22-25.
[9]NAKAMURA T,FURUNAKA H,MIYATA T,et al.Tachyplesin,a class of antimicrobial peptide from the hemocytes of the horseshoe crab (Tachypleus tridentatus)isolation and chemical structure[J].Journal of Biological Chemistry,1988,263:16709-16713.
[10]HIRAKURA Y,KOBAYASHI S,MATSUZAKI K.Specific interactions of the antimicrobial peptide cyclic[beta]-sheet tachyplesin I with lipopolysaccharides[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,2002,1562:32-36.
[11]DAI J G,XIE H W,JIN G,et al.Preliminary study on high-level expression of tandem-arranged tachyplesin-encoding gene in Bacillus subtilis Wb800 and its antibacterial activity[J].Marine Biotechnology,2009,11:109-117.
[12]HONG J,DAI J G ,GUAN W T,et al.Tachyplesin l induce drug resistance in bacteria in vitro[J].Journal of Animal and Veterinary Advances,2012,11 (7):939-945.
[13]GIACOMETTI A,CIRIONI O,BARCHIESI F,et al.In vitro susceptibility tests for cationic peptides:comparison of broth microdilution methods for bacteria that grow aerobically[J].Antimicrobial agents and chemotherapy,2000,44:1694-1696.
[14]张君胜,张 力,张 尧.紫外线诱变纤维素酶高产菌株的筛选及其酶活力[J].贵州农业科学,2011,39(10):125-127.
[15]MARTINEZ J,BAQUERO F.Mutation frequencies and antibiotic resistance[J].Antimicrobial agents and chemotherapy,2000,44:1771-1777.
[16]BREUER B,RADLER F.Inducible resistance against nisin in lactobacillus casei[J].Archives of Microbiology,1996,165(2):114-118.
[17]PERRON G,ZASLOFF M,Bell G.Experimental evolution of resistance to an antimicrobial peptide[J].Proceedings of the Royal Society B,2006,273:251-256.
[18]PRANTING M,NEGREA A,RHEN M et al.Mechanism and fitness costs of pr-39 resistance in salmonella enterica serovar typhimurium lt2[J].Antimicrobial agents and chemotherapy,2008,52(8):2734-2741.
[19]PESCHEL A,OTTO M,JACK R et al.Inactivation of the dlt operon in staphylococcus aureus confers sensitivity to defensins,protegrins,and other antimicrobial peptides[J].Journal of Biological Chemistry,1999,274(13):8405-8410.
[20]田连生,李贵香.紫外光诱导木霉产生对速克灵抗药性菌株的研究[J].中国植保导刊,2006(6):18-20.
[21]田连生.紫外光诱导哈茨木霉产生对多茵灵抗药性的菌株[J].环境科学学报,2007,26(1):318-321.
[22]詹儒林,许天委,黄俊生.紫外光的照射与绿缰菌对多菌灵敏感性变化的关系[J].热带作物学报,2006,27(4):91-94.
[23]GE Y,MACDONALD D,HOLROYD K et al.In vitro antibacterial properties of pexiganan,an analog of magainin[J].Antimicrobial agents and chemotherapy.1999,43(4):782-788.

