HDGF和VEGF在胃癌组织中的表达及其与肿瘤血管生成的关系
周 强 何 庆
(乐山市第二人民医院普外科,四川 乐山 614000)
HDGF和VEGF在胃癌组织中的表达及其与肿瘤血管生成的关系
周 强 何 庆
(乐山市第二人民医院普外科,四川 乐山 614000)
目的探讨肝癌衍生生长因子(HDGF)、血管内皮生长因子(VEGF)在胃癌组织中的表达与肿瘤组织微血管密度(MVD)之间的关系和临床意义。方法通过免疫组化SP法检测83例胃癌组织、35例正常胃组织中HDGF、VEGF和CD105标记的MVD表达情况,分析它们与胃癌临床病理特征的关系。结果HDGF、VEGF在胃癌组织中的阳性表达率分别为:66.1%和80.7%,明显高于正常对照组的阳性表达率17.1%和11.4%(P<0.05),胃癌组织中的MVD值为:(33.56±7.59)明显高于常对照组(10.7±3.8 )(P<0.05)。HDGF、VEGF的表达强度以及MVD值和肿瘤浸润深度、临床分期、淋巴结转移有明显的相关性(P<0.05)。两者在胃癌组织中的表达存在着正相关(P<0.05)。HDGF、VEGF阳性表达胃癌组织的MVD值明显高于阴性表达的MVD值(P<0.05)。结论HDGF、VEGF的过表达和微血管生成可能与肿瘤的发生和恶性行为有关,检测该指标对预测胃癌的预后和指导治疗有一定的参考价值。
肝癌衍生生长因子;血管内皮生长因子;微血管密度;免疫组化法;胃癌
胃癌是我国高发肿瘤,病死率占我国恶性肿瘤第一位,对患者的生命健康造成了很大的危害。胃癌的发生是涉及多基因的复杂过程,研究发现多种因子参与肿瘤的发生和发展,因此,深入研究与胃癌有关的基因及其在胃癌中的作用机制,对胃癌的早期诊断、早期治疗及预后判断具有重要意义。肝癌衍生生长因子是1994年Nakamura等[1]从人肝癌细胞系HuH-7培养的细胞液中分离提纯到的一种新的细胞增长因子。相关研究表明HDGF在多种肿瘤组织中高表达,如肝癌、胃癌、结直肠癌、非小细胞肺癌、乳腺癌、胰腺癌、食道癌等[2-8],并且与肿瘤的生长浸润转移以及预后密切相关。肿瘤的血管生成是肿瘤发生、发展、浸润、转移的重要影响因素。在肿瘤的血管生成中VEGF起着关键作用,血管内皮生长因子是目前所知的作用最强的促血管生成因子,肿瘤血管生成能力是由微血管密度测定的。本研究采用免疫组织化学SP法检测胃癌组织中HDGF、VEGF蛋白表达,并用抗-CD34抗体标记肿瘤组织MVD,探讨胃癌组织中HDGF和VEGF的表达与胃癌血管形成的关系,并讨论其意义。
1 材料与方法
1.1 临床资料
选取四川省乐市第二人民医院2006年1月至2012年3月手术切除的83例胃癌。受检者术前均未接受化疗、放疗及生物调节治疗等,所有标本经病理组织学切片证实。其中男性53例,女性30例;年龄43~67(53.4±6.2)岁。年龄:≥50岁者63例,<50岁者20例;高-中分化者41例,低-未分化者42例;T1~T2 46例,T3~T4 37例;肿瘤<3cm的30例,≥3cm的53例;淋巴结无转移的36例,淋巴结转移的47例;TNM分期Ⅰ~Ⅱ期50例,Ⅲ期以上33例。取35例良性病变胃大部分标本的正常胃组织作为阴性对照组。
1.2 主要试剂
HDGF兔抗人多克隆抗体购于北京博奥森生物技术有限公司产(bs-6537R),一抗工作液浓度1∶100。鼠抗人VEGF单克隆抗体(即用液)、鼠抗人CD34单克隆抗体(即用液)、SP免疫组化试剂盒、DAB显色试剂盒购自北京中杉金桥生物有限公司。
1.3 方法
采用免疫组化SP法存档石蜡组织行4μm厚切片,常规脱蜡,梯度酒精脱水,内源性过氧化物酶阻断10min,高压抗原修复,HDGF 单克隆抗体37℃孵育60min后4℃过夜,二抗孵育45min,链霉菌抗生物素蛋白过氧化物酶孵育45min,DAB显色5~10min,苏木素复染后脱水、透明,封固后光镜下观察。HDGF用血管内皮细胞的核染色作为阳性对照。VEGF和CD34染色用已知阳性片作阳性对照,PBS分别代替HDGF、VEGF、CD34单克隆抗体作为阴性对照。
1.4 结果判定
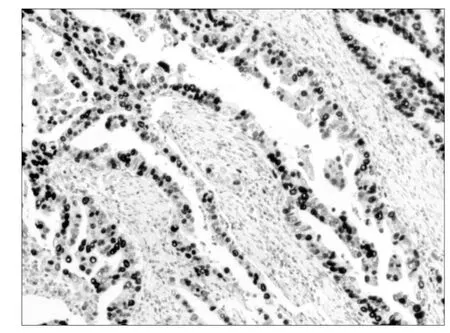
图1 HDGF在胃癌细胞核和细胞浆中的阳性表达SP×200

表1 正常胃组织和胃癌组织中HDGF和VEGF表达以及MVD的比较
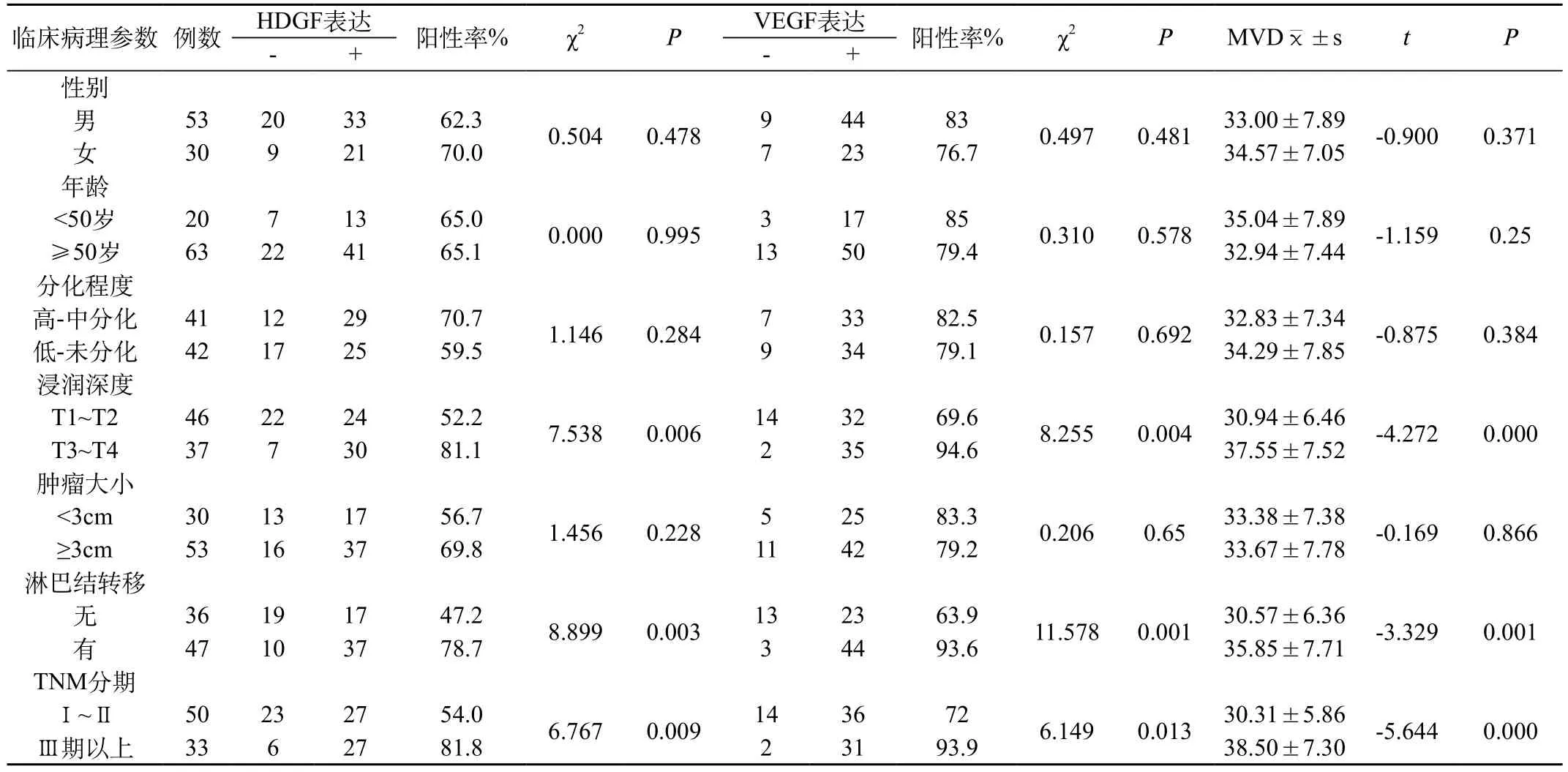
表2 胃癌HDGF和VEGF表达以及MVD和临床病理参数的关系
所有切片均有两名病理科高年资医师在盲法原则下进行评估:HDGF染色主要位于细胞核,以血管内皮细胞的核染色作为内对照和强度评分依据。VEGF染色主要位于细胞浆内,均以出现黄色或黄褐色颗粒为阳性细胞。以染色强度与阳性细胞的百分比的乘积作为定性标准。染色强度:0分为无色;1分为:黄色;2分为棕黄色;3分为棕褐色(深浅与背景色相对比)。阳性细胞所 占的百分比:1分为阳性细胞≤10%;2分为阳性细胞11%~50%;3分为51%~75%;4分为>76%。染色强度与阳性细胞所占的百分比的乘积0~3分为阴性(-);>3分为阳性。MVD评分方法:采用Weidner等报道的计数方法,首先在低倍镜下(×100)选取微血管密度最高的3个区域即热点(hotspot),再在每一个区域的高倍镜下(×400)计数微血管数(与毗邻微血管、肿瘤细胞及其他结缔组织不相连的任何棕色染色的血管内皮细胞均作为一个独立的微血管计数);取3个区域的均值为该组织的MVD以均数为分界分为阴性和阳性[9]。
1.5 统计学方法
用SPSS16.0软件进行统计学分析,计量资料用t检验,计数资料用χ2检验,HDGF和VEGF之间的关系用Spearman相关分析。检验水准α=0.05。以P<0.05为有统计学意义。
2 结 果
2.1 HDGF和VEGF在胃癌组织与正常胃组织中的表达与MVD
HDGF主要表达于细胞核中,细胞浆有部分表达,VEGF主要表达于细胞浆中(图1、2)。胃癌组织和正常胃黏膜组织中HDGF阳性表达率分别为:66.1%和17.1%。二者之间的差别有统计学意义(P<0.05)。VEGF阳性表达率分别为:11.4%和80.7%。二者之间的差别有统计学意义(P<0.05)。CD34主要表达于血管内皮细胞上(图3),以CD34标记的MVD值在正常胃组织和胃癌组织中分别为:(10.7± 3.81)和(33.56±7.59)。二者之间的差别有统计学意义(P<0.05)。见表2。
2.2 胃癌组织中HDGF和VEGF表达以及MVD与临床病理因素之间的关系
胃癌组织中HDGF和VEGF表达与MVD均与患者性别、年龄、肿瘤分化程度、肿瘤大小无关(P>0.05),而均与肿瘤浸润深度、淋巴结转移、临床分期有关(P<0.05)。见表2。
2.3 胃癌组织中HDGF和VEGF表达的相关性
在54例HDGF阳性的胃癌组织中,VEGF阳性者51例,占94.4%,29例HDGF阴性胃癌组织中,VEGF 阳性者16例,占55.17%,r=0.475,P<0.05,经Spearman分析,胃组织中HDGF和VEGF表达呈正相关。见表3。

表3 胃癌组织中HDGF和VEGF表达的相关性
2.4 胃癌组织中HDGF和VEGF表达与MVD的关系
HDGF阴性表达组MVD为(28.55±7.61),HDGF阳性表达组MVD为(36.26±6.11),(t=-5.022,P<0.05),二者之间的差别有统计学意义。VEGF阴性表达组MVD为(23.79±5.13),VEGF阳性表达组MVD为(35.90±6.07),t=-7.360(P<0.001),二者之间的差别有统计学意义。见表4。
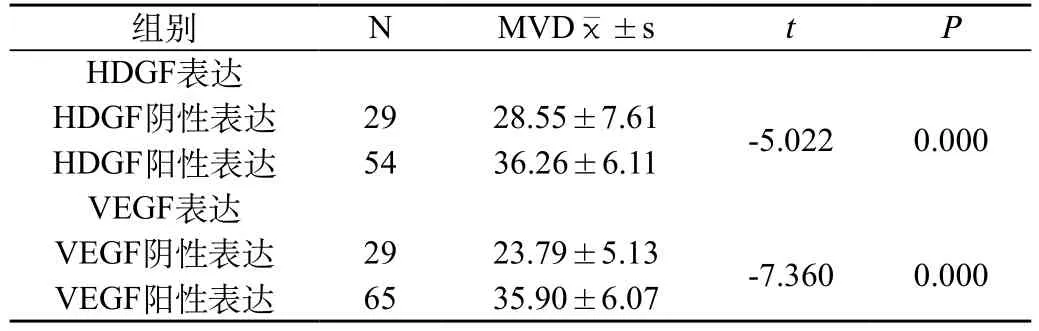
表4 胃癌组织中HDGF和VEGF表达与MVD的关系
3 讨 论
HDGF最初是从人肝癌细胞株HuH-7培养液中纯化的一种酸性肝素结合蛋白。在多种组织器官均有表达,如肝脏、心脏、肺脏、骨骼肌、胎盘等,主要在多种组织器官发育的早期阶段出现,随着细胞的分化成熟,其表达水平会逐渐降低。HDGF可以通过自分泌和旁分泌在细胞内促进相关基因的启动和表达。HDGF具有促进细胞增殖[10]、促进血管的生成[10]、抑制细胞凋亡[11]、参与创伤修复[12]等生物学功能。大量研究表明HDGF与恶性肿瘤的发生、发展密切相关,它在多种肿瘤细胞系以及多种肿瘤组织中高表达。HDGF参与恶性肿瘤侵袭、转移,其过表达是肿瘤患者预后不良的一个指标[2,5,13]。本研究使用免疫组化SP法检测了胃癌组织和正常胃组织中HDGF蛋白的表达情况,结果显示胃癌组织中的HDGF表达明显高于正常对照组(P<0.05),实验结果与其他类型的恶性肿瘤相似,说明HDGF在多种恶性肿瘤中可能存在高表达,HDGF与肿瘤的发生密切相关。Mao等[14]研究结果显示HDGF的表达随着胃黏膜的癌变进程逐渐升高,并与胃癌患者的淋巴结转移、浸润深度、UICC分期相关。Yamamoto等[3]研究显示,HDGF表达水平与胃癌血管、淋巴管浸润、淋巴结转移以及无瘤生存期密切相关。我们的研究分析了HDGF表达与胃癌临床病理因素的关系,发现HDGF阳性表达与患者性别、年龄、肿瘤分化程度、肿瘤大小无关(P>0.05),与肿瘤浸润深度、淋巴结转移、临床分期有关。与相关的研究结果基本一致,提示HDGF阳性表达与胃癌的浸润、转移等生物学特性有关。
肿瘤的血管生成是肿瘤生长转移中最基本的因素,肿瘤血管为肿瘤组织提供新陈代谢所必需的氧气和营养,从而使肿瘤得以迅速的生长并同时为肿瘤的远处转移提供转运。根据Folkman的理论:肿瘤生长分为两个阶段,第一个阶段是血管前期,肿瘤无血供,肿瘤大小在1~2mm之间,该阶段仅靠弥散获取营养,肿瘤处于静息期。第二个阶段为血管期,在该阶段内,肿瘤的继续生长需要肿瘤新生血管的形成才能够提供足够的营养和氧气。在该阶段内VEGF起着关键的作用。肿瘤细胞分泌大量VEGF,促使肿瘤血管生成,使肿瘤迅速生长并可发生侵袭、转移。VEGF又称血管通透性因子(vascular permeability factor,VPF),为分子量34~45kD的同源二聚体糖蛋白。VEGF通过旁分泌机制作用于血管内皮细胞上的相应受体发挥重要作用。VEGF促进肿瘤发生、发展的机制有:①特异地作用于血管内皮细胞,促进血管内皮细胞分裂、增殖、迁移进而促进肿瘤血管生成。②加快基底膜降解、增强血管壁的通透性,以利于癌细胞进入血管腔或向邻近的纤维蛋白和结缔组织基质扩散,为肿瘤细胞的浸润和转移创造有利条件。③作用于淋巴管内皮细胞,促进淋巴管形成,有利于肿瘤淋巴转移;④作用于免疫细胞,抑制机体免疫反应,促进肿瘤细胞免疫逃逸。大量研究显示VEGF与大多数实体肿瘤的生长、转移、病理分级和预后等密切相关。恶性肿瘤血管生成数量测定的金标准是微血管密度[15]。多数学者证实了MVD与恶性肿瘤的发生、发展的相关性,认为MVD是反映恶性肿瘤生物学行为的重要指标。并通过实验揭示了MVD与多种恶性肿瘤的发生、发展及浸润、侵袭转移呈正相关。本研究显示胃癌组织中VEGF表达水平以及MVD值明显高于正常组织(P<0.05),说明肿瘤的血管生成为肿瘤的生长提供了必需的氧气及营养,从而可以促进肿瘤的继续发展。本研究中VEGF阳性表达的MVD值高于VEGF阴性表达的MVD值(P<0.05),更进一步印证了VEGF在肿瘤血管生成中的重要作用。进一步分析了VEGF阳性表达和MVD值与胃癌临床病理因素的联系,发现VEGF阳性表达和MVD值与肿瘤患者性别、年龄、肿瘤大小、分化程度无关(P>0.05),而与肿瘤浸润深度、肿瘤大小、临床分期有关(P<0.05),试验结果与大部分相关文献报道结果相似,说明肿瘤血管生成与胃癌发展、侵袭、转移密切相关。
本研究结果显示在胃癌组织中HDGF阳性表达的MVD值高于HDGF阴性表达的MVD值(P<0.05),说明HDGF参与了胃癌的微血管生成。HDGF表达与VEGF表达呈正相关(r=0.475,P<0.05),说明两者在胃癌血管生成中可能存在某种相互调节机制。Okuday等[10]研究发现HDGF在促进血管生成的同时能检测到VEGF的基因转录活性也明显增强,组织中VEGF的表达也明显增高,“外源性”VEGF可明显抑制HDGF的表达,说明HDGF可能通过诱导VEGF的生成而参与肿瘤血管的生成调节。Everett等[16]的研究显示HDGF在促进血管生成方面与VEGF不同,HDGF具有促进血管内皮细胞有丝分裂、调节内皮细胞的迁移从而促进血管形成的能力。
综上所述,HDGF和VEGF的高表达以及肿瘤微血管生成可能在胃癌的发生及侵袭、转移过程中起着重要的作用。二者在胃癌的发生、发展和血管生成中可能起相互协调作用。HDGF和VEGF有望成为治疗胃癌的靶点,靶向HDGF和VEGF有可能抑制胃癌的血管生成,从而抑制肿瘤的生长、转移,提高胃癌患者的疗效。但是HDGF诱导VEGF生成的详细过程仍不清楚,而且对于HDGF是否可以作为VEGF的上游调节因子尚需进一步的研究。
[1] Nakamura H,Izumoto Y,Kambe H,et al.Molecular cloning of complementary DNA for a novel human hepatoma-derived growth factor: its homology with high mobility group-1 protein [J].J Biol Chem,1994,269(40):25143-25149.
[2] Yoshida K,Tomita Y,Okuda Y,et al.Hepatoma-derived growth factor is a novel prognostic factor for hepatocellular carcinoma[J]. Ann Surg Oncol,2006,13(2):159-167.
[3] Yamamoto S,Tomita Y,Hoshida Y,et al.Expression of hepatomaderived growth factor is correlated with lymph node metastasis and prognosis of gastric carcinoma[J].Clin Cancer Res,2006,12(1):117-122.
[4] 吕莉,董卫国,余琼芳,等.肝细胞瘤衍化生长因子在结直肠腺癌中的表达及与血管形成关系的研究[J].中华消化杂志,2007,27 (3):195-196.
[5] 张军,祁娟,郭艳,等.HDGF在手术切除非小细胞肺癌中的异常表达及其在预测预后中的意义[J].中国肺癌杂志,2011,14(3): 211-218.
[6] 潘宇亮,曹培国,张隽,等.肝癌衍生生长因子在乳腺癌中的表达及其临床意义[J].肿瘤防治研究,2011,38(8): 926-929.
[7] Uyama H,Tomita Y,Nakamura H,et al.Hepatoma-derived growth factor is a novel prognostic factor for patients with pancreatic cancer[J].Clin Cancer Res,2006,12(20 Pt 1): 6043- 6048.
[8] Yamamoto S,Tomita Y,Hoshida Y,et al.Expression level of hepatoma-derived growth factor correlates with tumor recurrence of esophageal carcinoma[J].Ann Surg Oncol,2007,14(7): 2141-2149.
[9] Weidner N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma [J].N Engl J Med,1991,324(1): 1-8.
[10] Okuda Y,Nakamura H,Yoshida K,et al.Hepatoma-derived growth factor induces tumorigenesis in vivo through both direct angiogenic activity and induction of vascular endothelial growth factor [J]. Cancer Sci,2003,94(12):1034-1041.
[11] Tsang TY,Tang WY,Tsang WP,et al.Mechanistic study on growth suppression and apoptosis induction by targeting hepatomaderived growth factor in human hepatocellular carcinoma HepG2 cells[J].Cell Physiol Bio-chem,2009,24(3/4): 253-262.
[12] Mori M,Morishita H,Nakamura H,et al.Hepatoma-derived growth factor is involved in lung remodeling by stimulating epithelial growth[J].Am J Respir Cell Mol Biol,2004,30(4): 459-469.
[13] Chang KC,Tai MH,Lin JW,et al.Hepatoma-derived growth factor is a novel prognostic factor for gastrointestinal stromal tumors [J]. Int J Cancer,2007,121(5):1059-1065.
[14] Mao JS,Xu ZF,Fang YM,et al.Hepatoma-derived growth factor involved in the carcinogenesis of gastric epithelial cells through promotion of cell proliferation by ERK1/2 activation [J].Cancer Sci,2008,99(11):2120-2127.
[15] Fox SH,Whalen GF,Sanders MM,et al.Angiogenesis in normal tissue adjacent to colon cancer [J].J Surg Oncol,1998,69(4):230-234.
[16] Everett AD,Narron JV,Stoops T,et al.Hepatoma-derived growth factor is a pulmonary endothelial cell- expressed angiogenic factor[J].Am J Physiol Lung Cell Mol Physiol,2004,286(6): L1194-1201.
Relationship of HDGF and VEGF Expression with Gastric Cancer Angiogenesis
ZHOU Qiang, HE Qing
(Department of General Surgery, Leshan No.2 People’s Hospital, Leshan 614000, China)
ObjectiveTo investigate the relationship between the expression of hepatoma-derived growth factor (HDGF) and vascular endothelial growth factor (VEGF) and microvessel density of gastric cancer and its significance.MethodsThe expressions of HDGF, VEGF and MVD in 83 cases of gastric cancer and 35 cases of normal gastric tissue were detected by SP immunohistochemical method, and then their correlations with clinicopathological characteristics were analyzed.ResultsPositive rates of HDGF (66.1%) and VEGF expressions (80.7%) were significantly higher in gastric cancer tissues than those in the normal gastric tissues (17.1% and 11.4% respectively, P<0.05) and so did the MVD which was (33.56±7.59) in gastric cancer and (10.7±3.81) in the normal gastric tissues (P<0.05). The expression of HDGF, VEGF and MVD were closely correlated to the invasive depth, lymph node metastasis and TNM staging of gastric cancer(P<0.05). The expressions of HDGF were positively correlated with the expressions of VEGF (P<0.05). The values of MVD in cases with positive expression of HDGF and VEGF were significantly higher than in cases with negative expression of them(P<0.05).ConclusionOverexp ression of HDGF and VEGF and angiogenesis might contribute to the tumorigenesis and malignant behaviors of gastric cancer. Detecting the expression of HDGF, VEGF and MVD value probably can predict the prognosis of gastric cancer.
Hepatoma derived growth factor; Vascular endothelial growth factor; Microvessel density; Immunohistochemical method; Gastric cancer
R735.2
B
1671-8194(2013)12-0067-04

