哺乳动物毛囊结构特征及调控机制
马 馨,陈 洋,姜怀志
(吉林农业大学动物科学技术学院,长春 130118)
哺乳动物的毛囊是皮肤的重要附属结构,也是控制被毛生长的重要器官,它的性状和组织结构决定着动物被毛的品质和产量。同时毛囊还是哺乳动物机体在生后为数不多具有周期性变化的器官,其周期性变化决定着被毛周期性的生长与脱落,而毛囊的周期性发育则受多种因素的影响,并在一系列信号分子的调节下完成。
1 哺乳动物毛囊的结构特征
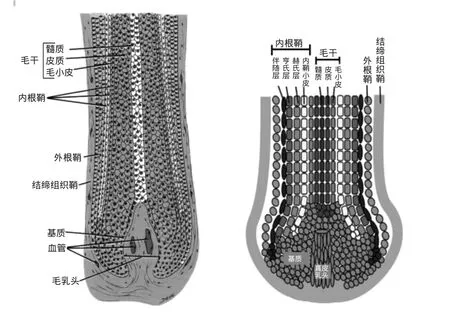
图1 毛囊的组织形态结构
哺乳动物被毛形态虽然差异较大,但其“发源地”——皮肤毛囊(hair follicle,HF)的基本结构都是相同的[1],由连接组织鞘(connective tissue sheath,CTS)、内根鞘(inner root sheath,IRS)、外根鞘 (outer root sheath,ORS)、毛球(hair bulb)和毛干(hair shaft)等构成(见图1)。毛球内包围着一些密集的真皮纤维细胞,内陷深入部分称为毛乳头(dermal papilla,DP),是一个发送和接收信号的诱导结构[2],DP由位于成群分布在毛囊基底部的真皮源性细胞,即真皮毛乳头细胞(dermal papilla cell,DPC)组成,其主要功能是诱导毛囊再生[3]。IRS是由鞘小皮、Huxley′s层和 Henle′s层组成的包围毛干的刚硬结构,决定了毛干的形状。IRS外是由厚厚的细胞组成的外根鞘,它包裹着整个IRS和毛干。在毛囊的最外面是由几层成纤维细胞组成的连接组织鞘,它将毛囊与真皮层隔离开[4]。从毛囊的组成看,毛囊由上皮(毛母质与外根鞘)和真皮(毛乳头和结缔组织鞘)两大部分组成,其中包括20余种细胞,包括角质形成细胞、黑色素细胞、Langerhans′细胞、Mekel细胞、真皮鞘细胞和毛乳头细胞。
绝大多数哺乳动物毛囊分为初级毛囊(primary hair follicle,PF)和次级毛囊(secondary hair follicle,SF)2 类,PF发生较早,毛球大,毛囊较长、较粗,有2个发达的皮脂腺(sebaceous gland,SG),毛干一般有髓质;SF 发生较晚,毛球小,毛囊短而细,无或仅有一个不发达的皮脂腺,毛干没有髓质。大多数成年的哺乳动物毛囊都是成群分布的,形成毛囊群结构,每个毛囊群一般由1~5个初级毛囊和围绕其周围的若干个次级毛囊组成。
2 哺乳动物毛囊的形成与发育过程
哺乳动物的毛囊是表皮向真皮凹陷后形成的能控制被毛生长的皮肤器官。胚胎期的毛囊形态学发生是由凝集的真皮成纤维细胞诱导的[5]。Paus 等[6]以小鼠为模型详细地研究了毛囊从发生到发育成熟的整个过程,并将其分为3个时期8个阶段(见图2)。
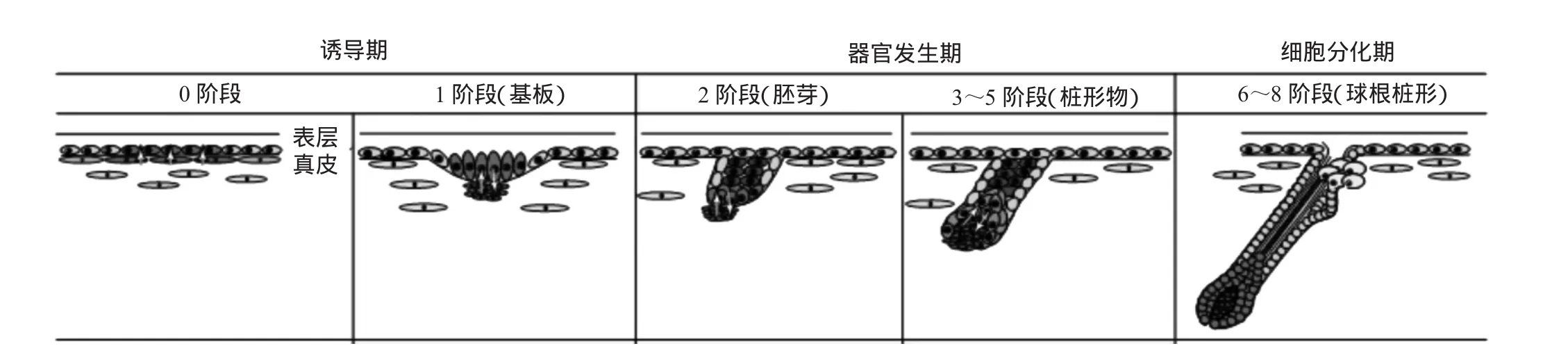
图2 小鼠毛囊的发育变化过程
哺乳动物胎儿期毛囊的发生是表皮与真皮之间所发生的一系列复杂的的相互作用过程。毛囊发生的第1阶段是胎儿表皮内陷形成基板(placode),它是胎儿表皮内陷的结果;第2阶段为局部的基底层细胞向真皮内突出形成毛芽,在毛芽的的下方,真皮细胞也开始聚集成一丛,形成后来的毛乳头。3~5阶段则是毛芽继续向真皮层深入,形成一个实性的柱状结构,其末端由许多真皮成纤维细胞包围着,形成一个类似“帽状”的结构,至此完成了毛囊的器官发生期。随即进入细胞分化期即进入毛囊形成的6~8阶段,这一时期,柱状结构进一步生长,末端膨大成毛球。毛球内凹,周围的一部分成纤维细胞和间充质成分陷入形成毛乳头,其他部分成纤维细胞形成连接组织鞘。在毛囊向下生长的同时,毛母质细胞开始快速地分裂并向上迁移,分化出IRS和毛干。随着毛囊的生长,毛囊达到真皮深部,它的附属结构皮脂腺、竖毛肌等也完全出现,分化出的毛干逐渐向上生长,最后传出体表。此时,毛囊发育已经完全成熟,形成完整的结构。在毛囊的形态发生过程中,凝集的真皮成纤维细胞分化为DPC,而其他未发生凝集的成纤维细胞则形成连接组织鞘,表明凝集作用对DP的形成非常重要。DPC在毛囊形态发生调控中处于中心环节,同调控毛母质细胞的生长分化来控制毛发的大小和性状。
3 毛乳头结构及其在哺乳动物毛囊形成中的作用
毛乳头是位于毛囊底部被毛母质细胞所包绕的真皮源性细胞,为含血管的间充质成分,主要来自于真皮成纤维细胞。毛乳头细胞在毛囊的形态学发生及其周期性生长调控中处于中心环节,其显著的生物学特性是在体内外表现为凝集性的生长方式及体内外具有诱导毛囊形成的能力[4],既提供毛囊生长和分化必需的信号因子和营养支持,也决定毛囊的分化方向[5]。毛乳头细胞产生和分泌多种生长因子及信号分子构成细胞外基质(ECM)成分,ECM分子被转运到毛母质细胞而刺激其增生和分化[7]。毛乳头是毛囊中的一个区域性干细胞生长因子(stem cell growth factor,SCF)库,同时还能分泌血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、类胰岛素生长因子结合蛋白(IGFBP)、FGF 等[8]。在这些因子中 SCF对上皮细胞、黑色素细胞具有调节作用,VEGF则起到调剂毛乳头和毛囊周围血管内皮细胞增殖的作用[9]。
4 哺乳动物毛囊周期性变化
哺乳动物的毛囊是个再生器官,在其整个生命过程中由于毛囊上皮细胞和真皮间充质细胞的相互作用,促使毛囊反复经历生长期、退行期和休止期的过程[10]。根据毛囊不同部位在生长过程中的变化,将其分为恒定部和循环部2部分,恒定部即毛囊的上段,包括皮脂腺和竖毛肌附着部——隆突部,一般不发生凋亡和再生;循环部包括隆突部以下的毛囊和毛球,毛囊的周期性变化主要发生在这个部位。Alonso等对不同时期的毛囊形态特征进行了描述(以人和小鼠为例,见表 1)[11]。

表1 毛囊周期性变化的形态特征
有关毛囊生长周期的机理目前尚不清楚,但Stenn等[12]对这个机理提出几个假说,分别是表皮学说(该学说的主要内容是在毛囊隆突部位的细胞控制着毛囊周期)、毛乳头形态发生学说(该学说的主要内容是毛乳头通过周期性表达和释放生长相关因子来控制毛囊周期)、隆突激活学说(该学说的主要内容是毛乳头的生长因子通过隆突部位的干细胞来调控毛囊周期)、共谐学说(该学说的主要内容是毛囊周期受毛囊各成分细胞共同作用产生的生物钟所调控)、震动信号学说(该学说的主要内容是毛囊类似石英钟,处于休止期的细胞在特定时间接到震动信号而进入生长期)、胚胎周期学说(该学说的主要内容是毛发周期的生物钟是在胚胎形成中建立并可持续终生)、抑制-去抑制学说(该学说的主要内容是在毛囊生长周期中,一种内源性的有丝分裂抑制剂逐渐积聚于隆突部,当其达到一定浓度时,毛囊细胞的生长即停止。而在休止期,其浓度降低到一定程度,毛囊又重新开始生长)。
不同类别哺乳动物的毛囊周期性变化是不同的,人头发的毛囊生长期可持续3~4年,而眉毛、睫毛则仅为2个月[8];大鼠的毛发周期为 28 d,其中 1~18 d 为生长期,19~22 d 为退化期,23~28d 为静止期[13]。而中国的绒山羊其毛囊生长期一般为6~8个月、退行期1~4个月、休止期 2~3 个月[14]。张燕军等[15]对绒山羊毛囊的生长期、休止期、退行期的形态变化进行了系统性的研究,发现绒山羊不同时期的毛囊形态变化有较大的差异性。
虽然国内外对各类哺乳动物的毛囊周期进行了大量的研究,但仍有较多问题尚属未知领域,如毛囊的周期从何处开始?起始刺激信号是什么?起始信号如何作用其靶标?如何影响毛发生长?即使现在已经发现毛囊形成的第一个信号是来自于间充质,但具体是哪种因子驱使成熟毛囊从休止期进入生长期及其来源仍存在争议[16]。
5 哺乳动物毛囊形成及周期性发育的相关信号通路
哺乳动物毛囊的形成及周期性发育是一个分子调控的过程,需要由不同信号通路组成的复杂网络来控制,这个网络中促进毛囊发育因子与抑制毛囊发育因子处于严格的平衡状态,进而将最终信息传递到毛囊及毛囊周围组织,实现对毛囊发育、毛囊活动的启动与休止及毛囊有丝分裂速率的调节。
5.1 参与毛囊形态发生及生长期的相关信号通路
参与毛囊形态发生及生长期的信号通路主要有Wnt信号通路、Hedgehog信号通路和Notch信号通路。Wnt信号通路是一种参与控制胚胎发育、进化上保守的信号传导途径,目前在生物体内已发现100多种Wnt基因,广泛地参与了毛囊形态发生和周期性变化的各个环节,对于所有类型毛囊发育的起始阶段和毛囊形态发生都非常重要,尤其是在毛囊发生的起始阶段起到重要作用[17]。在Wnt众多的信号通路中研究最多的,也是对毛囊形态发生、毛囊发育及相关细胞分化起调节作用的Wnt/βcatenin信号通路,β-catenin主要表达于上皮细胞和间质细胞上,其主要功能是促进毛囊细胞的形成[18]。Hedgehog家族中只有Shh(sonichedgehog)是其中唯一在毛囊中表达的成员,在毛囊形态发生时起到影响上皮细胞和真皮细胞增殖,调控上皮细胞进一步向下生长和毛乳头形成的功能,而在毛囊发育时则起控制毛囊休止期向生长期转换的作用[19]。Notch信号通路由 Notch受体、Notch配体和CSL-DNA结合蛋白3部分组成,Notch信号是多种组织和器官早期发育所必须的细胞间调节信号,主要参与毛囊早期发育过程中的毛囊细胞定向分化或毛乳头对上皮细胞的训导过程,并可促使毛囊由休止期转向生长期[20-21]。
5.2 参与毛囊退行期的相关信号通路
参与毛囊退行期的相关信号通路主要有转化生长因子(TGF-β)信号通路和表皮生长因子家族(EGF)信号通路。TGF-β 信号通路由 TGF-β1,2,33 个同功型家族成员组成,其中在毛囊发育中起主要作用的是TGF-β1,它的主要作用是促使毛囊由生长期转换到退行期[21]。EGF信号通路是以EGF-EGFR信号通路系统参与了毛囊发育和生长期向最想去的转化的[22]。
5.3 参与毛囊休止期的相关信号通路
参与毛囊发育休止期的相关信号通路主要由成纤维细胞生长因子(FGF)家族和骨形成蛋白(BMP)家族。FGF家族中的FGF5是一个较强的生长抑制因子,主要分布于毛囊的外根鞘上,在毛囊生长期结束前,外根鞘上旁分泌的FGF5终止毛囊细胞分裂引起生长期停止[23]。BMP家族成员在毛囊形态发生过程中主要起抑制性作用,BMP2和BMP4主要抑制毛囊基板的形成;而在毛囊的休止期BMP家族成员占绝对优势,是毛囊生长期启动的抑制剂,阻止毛囊细胞增殖,进而阻止毛囊的发育[19]。
5.4 调控毛囊发育的其他因子
对哺乳动物毛囊发育起到调控作用的信号通路和细胞因子除了上述传统的,研究较多的细胞因子外,近些年来还发现了一些新的因子,主要有:解整联蛋白和金属蛋白酶 10(adisintegrinandmetalloprotease10,ADAM10)和解整联蛋白和金属蛋白酶11(adisintegrin and metalloprotease 10,ADAM12)、神经元-奥综合征蛋白质(neuronal Wiskott-Aldrich syndrome protein,N-WASP)、多胺、β转化生长因子活化激酶1(transfoming growth factor β activated kinase1 TAK1)、十六酰化修饰、微 RNA(microRNA)、含Distal-less同源异型框转录因子3(Distal-less3,Dlx3)、与秃发症有关的基因家族的 Gasdermin3(Gsdm3)基因、昼夜节律钟基因等。此外类胰岛素生长因子家族、内皮肽-1(endothelin-1)、角蛋白关联蛋白(keratin-associated proteins,KAP)、角质化细胞生长因子、干细胞生长因子、血小板衍生生长因子、血管内皮细胞生长因子和神经生长因子等[24]。
6 结束语
在哺乳动物中,有相当一部分物种的被毛具有较高的经济价值,如细毛羊、绒山羊等,其被毛质量的优劣、产毛(绒)量的高低与其毛囊结构及发育具有密切的关系,尤其毛囊生长期的长短对其绒毛品质和产量具有较大影响。虽然目前在哺乳动物的毛囊研究特别是毛囊发育的分子机制研究方面取得了较大进展,但对毛囊发育的机制尚有很多未知领域,如毛囊周期性变化机制等。因此,对哺乳动物毛囊的深入研究不仅可以指导绒山羊类毛用动物的选育进程,而且对于发展有效治疗脱发性疾病的药物开发可以提供新的研究思路和治疗手段。
[1]Paus R,Cotsarelis G.The biology of hair follicles[J].The New England Journal of Medicine,1999,341(7):491-497.
[2]Harmon C S,Nevins T D.Hair fibre production by human hair follicles in whole-organ culture[J].Br J Dermatol,1994,130:415-423.
[3]Moore G P M,Du Cross D L.Hair growth induction:roles of growth factors[J].Acad Sci,1991,642:308-3251.
[4]杨卫兵,郝飞.毛乳头细胞在毛囊形态学发生和生长调控中的作用[J].国外医学皮肤性病学分册,2003,29(5):312-313.
[5]Jahoda C A,Oliver R F,Reynolds A J,et al.Trans species hair growth induction by human hair follicle papillae[J].Exp Dermatol,2001,10:229-237.
[6]Paus R,Muller-Rover S,Van Der Veen C,et al.A comprehensive guide for the recognition and classification of distinct stages of hair folliclemorphogenesis[J].Invest Dermatol,1999(113):523-532.
[7]Matstzaki T,Yoshizato K.Role of hair papilla cells on induction and regeneration processes of hair follicles[J].Wound Repair Regen,1998,6(6):524-530.
[8]邹锋,郝飞.毛囊生物学特性的某些研究进展[J].中华医学美学美容杂志,2006,12(5):315-317.
[9]姜怀志,陈洋,常青.血管内皮生长因子在哺乳动物皮肤毛囊周围血管新生过程中的调控作用[J].中国畜牧兽医,2010,37(5):47-49.
[10]吕中法.毛乳头细胞与毛囊生长周期[J].重庆医学,2000,29(2):161-163.
[11]Alonso L,Fuchs E.The hair cycle[J].Journal Cell Science,2006,119:391-293.
[12]Stenm K S,Paus R.Controls of hair follicle cycling[J].Physiol Rev,2001,81:449.
[13]张艺,杨恬,王韵.β-连环蛋白在毛囊周期中基因表达的实验研究[J].现代医药卫生,2004,20(21):2208-2209.
[14]姜怀志.中国绒山羊的毛囊结构特性与发育机制[J].吉林农业大学学报,2012.
[15]张燕军,尹俊,李金泉.内蒙古阿尔巴斯绒山羊毛囊形态结构及发生过程的研究[J].中国农业科学,2007,40(5):1017-1023.
[16]宋志强,郝飞.毛乳头及毛囊生长调控的若干研究进展[J].重庆医学,2003,32(8):1087-1090.
[17]武晓英,任有蛇,张春香,等.毛囊周期发育相关信号通路的研究进展[J].中国兽医杂志,2010,46(6):69-71.
[18]谷博,孙丽敏,姜怀志.β-catenin基因在辽宁绒山羊皮肤毛囊中表达的研究[J].经济动物学报,2012,16(3):144-147.
[19]Wang L,Liu Z Y,Gambardella L,et al.Regular articles:conditional disruption of hedgehog signaling pathway defines it scritonal role in hair development and regeneration[J].J Invest Dermatol,2000,114(5):901-908.
[20]Crowe R,Henrique D,Horowicz D,et al.A new role for Notch and Delta in cell fate decisions patterning the feather array[J].Development,1998,125(4):767-775.
[21]Wollina u,Lange D,Funa K,et al.Expression of transforming growth factor beta isoforms and their receptors during hair growth phases in mice[J].Histol Histopathol,1996,11(2):431-436.
[22]Murillas R,Larcher F,Conti C J,et al.Expression of a dominant negative mutant of epidermal growth factor receptor in the epidermis of transgenic mice elicits striking alterations in hair follicle development and skin structure[J].EMBO J,1995,14(21):5216-5223.
[23]Suzuki S,Ota Y,Ozawa K,et al.Dual-mode regulation of hair growth cycle by two fgf-5 gene products[J].J Invest Dermatol,2000,114(3):456-463.
[24]苏立宁,李华,旭日干,等.毛囊发育分子调控机制[J].生命的化学,2011,31(3):455-460.

