Se(Ⅳ)对赤子爱胜蚓Sb(Ⅲ)中毒的拮抗作用
梁淑轩,王凯,耿梦娇,李璠
(河北大学化学与环境科学学院,河北保定 071002)
Se(Ⅳ)对赤子爱胜蚓Sb(Ⅲ)中毒的拮抗作用
梁淑轩,王凯,耿梦娇,李璠
(河北大学化学与环境科学学院,河北保定 071002)
为研究Se(Ⅳ)的加入是否能够缓解蚯蚓体内Sb(Ⅲ)毒性,且阐述蚯蚓体内Se(Ⅳ)与Sb(Ⅲ)的相互作用.实验将蚯蚓置于不同含量Se(Ⅳ)与Sb(Ⅲ)供试土壤中,分别在不同暴露时间后取出蚯蚓,用ICP-MS测量蚯蚓体内Se(Ⅳ)与Sb(Ⅲ)含量.通过研究表明,高含量Se(Ⅳ)对Sb(Ⅲ)首先表现为协同作用,随着暴露时间推移,Se(Ⅳ)对Sb(Ⅲ)起到了解毒作用.适量Se(Ⅳ)(2~10mg/kg)在一定程度上能缓解金属Sb(Ⅲ)对蚯蚓的毒害,且随着Se(Ⅳ)含量增加,蚯蚓体内起到解毒作用的时间也由4d缩短到2d.
蚯蚓;Se(Ⅳ);Sb(Ⅲ);拮抗作用;协同作用
许多研究证明Sb(Ⅲ)对人体及生物具有慢性毒性及致癌性,且Sb(Ⅲ)及其化合物被美国环保局及欧盟列为优先污染物[1].Se(Ⅳ)对动物及人体来说是一种必需的生命元素[2],在低含量条件下能够作为一种抗氧化剂来降低氧化胁迫对动植物产生的危害,而在高浓度下,它却是一种氧化强化剂[3-4].另外,Se(Ⅳ)也是一种解毒剂,能够降低许多对植物有害元素的毒性[5-8].
当多种元素同时进入生物体内时,引起的生物毒性效应与这些元素在生物体内的联合作用有关.Se(Ⅳ)作为带负电荷的非金属离子,在生物体内可以与带正电荷的有害金属离子相结合,形成金属-硒-蛋白质复合物,起到解毒排毒作用,从而保护生物体的生理系统[9],这实质上是Se(Ⅳ)本身改变了金属对生物大分子活性点位(生物活性点位是生物大分子中具有生物活性的基团和物质)的亲和力,而使这些金属转移到对生物生理和代谢有利的位置上.
生物体内诸多元素之间存在着拮抗和协同关系,对于这种极其复杂的关系,国内外开展了很多研究,但以Se(Ⅳ)对重金属胁迫植物抗性的研究为主,动物研究报道为辅.为研究各元素在动物体内的相互关系,本文选择Se(Ⅳ)和Sb(Ⅲ)这2种有益和有害的元素,利用土培法,研究这2种元素在蚯蚓体内的相互作用.通过研究蚯蚓体内Se(Ⅳ)与Sb(Ⅲ)的变化规律,为了解各元素在生物体内的毒害作用及其解毒机制提供依据.
1 材料与仪器
1.1 实验动物
赤子爱胜蚓(Eisenia foetida)由天津贾立明蚯蚓养殖有限公司提供,挑选环带明显、体态相似的健康成蚓进行实验.
1.2 仪器与试剂
PHB-10型笔式pH计(上海虹益仪表仪器有限公司);MARS X press微波消解仪(美国CEM公司);BHW-09C赶酸仪(上海博通化学科技有限公司);X series2型电感耦合等离子体质谱(ICP-MS)仪(赛默飞世尔公司).
一次去离子水(由Molecular超纯水装置制备),0.1mol/L的K2Cr2O7溶液,FeSO4溶液,邻菲啰啉指示剂,Sb(Ⅲ)标准溶液(国家钢铁材料测试中心钢铁研究总院),酒石酸锑钾(分析纯,天津市科密欧化学试剂有限公司),亚硒酸钠(分析纯,天津市华东化学试剂厂),Se(Ⅳ)标准溶液(国家钢铁材料测试中心钢铁研究总院),浓硝酸(MOS级,北京化学试剂研究所),高氯酸(分析纯,天津市鑫源化工有限公司).
1.3 培养基
供试土壤采自河北省保定市河北大学校内(0~15cm).土壤主要理化性质如下:土壤pH为8.25,V(土)∶V(水)=2∶5,土壤含水量为11%(质量分数),通过稀释热法测得土壤有机碳为12.18g/kg,土壤有机质为21.00g/kg.供试土壤中总Sb(Ⅲ)未检出,总Se(Ⅳ)为2.36μg/kg.
2 实验方法
2.1 实验设计
将风干的供试土样过筛,选取规格为30cm×15cm×20cm的玻璃缸洗净晾干,每个缸中放置2kg土,然后在缸中加入100mL标准溶液,分成6组(每组平行3次).本实验质量浓度设置如表1所示.
表1 实验设计Tab.1 Experimental design
2.2 蚯蚓的染毒和取样
将用去离子水清洗干净的赤子爱胜蚓置于装有污染土壤的玻璃缸中饲养,实验期间保持室内温度18~24℃,分别在12,24,48,96,168h各取4条,用水冲洗干净,置于采样袋中使之排泄.
2.3 蚯蚓体内重金属含量的测定
将排泄10h后的蚯蚓取出,用蒸馏水洗净,拭干后准确称重,冰冻致死,于烘箱中80℃烘4h,冷却后研磨,过180目(孔径0.088mm)筛,制成粉备用.
称取适量蚯蚓粉末于聚四氟乙烯消解罐中,加20mL浓硝酸静置过夜后加入5mL高氯酸,放于消解仪中按表2所设置的升温程序进行消解,消解完毕后赶酸,冷却后加1mL浓硝酸和少量水,转入50mL的比色管中,定容后过滤[10].与此同时做样品空白,然后采用ICP-MS(仪器参数如表3)测定其体内Sb(Ⅲ)与Se(Ⅳ)含量.

表2 微波消解仪的工作条件Tab.2 Optimal parameters of microwave digestion
3 结果与讨论
3.1 仪器工作条件的选择
使用调谐液调整仪器各项指标,使仪器灵敏度、分辨率等各项指标均达到测试要求.
ICP-MS选用Xt标准模式时,由于Se(Ⅳ)的高电离性质,决定了此方法具有很高的灵敏度,但对于Se(Ⅳ)来说丰度较大的几个同位素又不能用质谱来检测,因为其干扰严重,而使用几乎无干扰的82Se(Ⅳ)检测,其天然丰度又较低(9.2%),因此与其他元素相比,较难测定[11].所以在本次实验当中,在确定实验的相对标准偏差小于5%下,改变仪器的采集时间,发现采样时间在2.5s时,Se(Ⅳ)的干扰最小,实验的准确度与灵敏度可达到最佳.选定的ICP-MS仪器工作参数列于表3.

表3 ICP-MS的工作条件Tab.3 Operating parameters of ICP-MS
3.2 测定方法的线性以及回收率
分别配制1~100μg/L线性内Sb(Ⅲ)与Se(Ⅳ)标准溶液,结果测得Sb(Ⅲ)和Se(Ⅳ)标准曲线的相关系数分别为0.999 948,0.999 981.在样品中分别加入5,10μg/L 2个质量浓度的Sb(Ⅲ)与Se(Ⅳ)标准品,测得该方法的平均回收率为88.4%~112.6%,RSD均在5%之内.说明该测定方法准确可靠.
3.3 土壤中不同质量分数的Se(Ⅳ)对蚯蚓体内Sb(Ⅲ)与Se(Ⅳ)含量影响
实验分别在不同暴露时间下取不同质量的蚯蚓进行处理,并选用表3中ICP-MS的工作条件同时测定处理样品中Sb(Ⅲ)与Se(Ⅳ)含量,所得结果如图1所示.
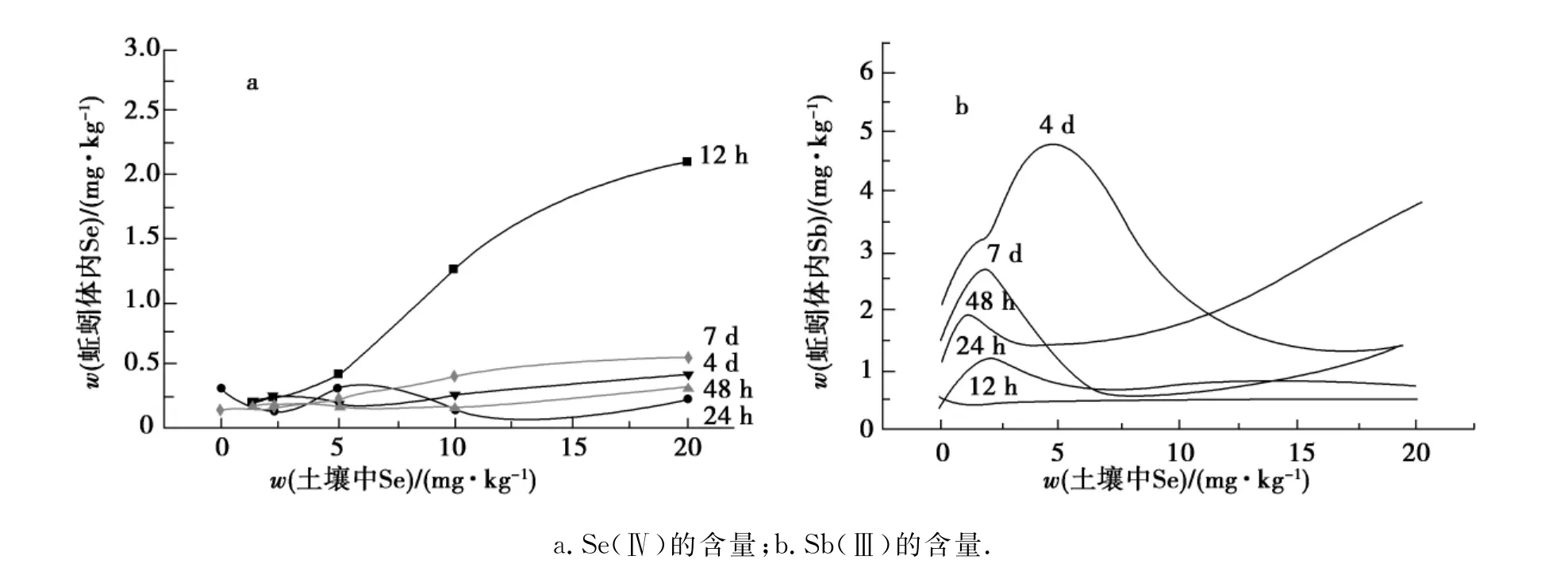
图1 不同质量浓度Se(Ⅳ)处理下蚯蚓体内Se(Ⅳ)与Sb(Ⅲ)含量的变化Fig.1 Changes of Sb(Ⅲ)and Se(Ⅳ)in earthworm with different mass concentrations of Se(Ⅳ)
由图1可以看出,12h时,蚯蚓体内Se(Ⅳ)含量随土壤中Se(Ⅳ)含量的增加呈现上升趋势,而蚯蚓体内Sb(Ⅲ)含量趋于平稳,说明在12h时,Se(Ⅳ)对Sb(Ⅲ)并未起到解毒作用.12h后蚯蚓体内Se(Ⅳ)随土壤中Se(Ⅳ)含量的增加基本趋于稳定,而Sb(Ⅲ)的含量则存在一个临界点,说明在此临界点之前,蚯蚓体内Se(Ⅳ)与Sb(Ⅲ)呈现的是协同作用,超过临界点,随着土壤中Se(Ⅳ)含量的推移对蚯蚓体内Sb(Ⅲ)起到抑制作用,有研究表明这些作用与形成金属配位体的结合态有关,故明显地呈现出金属与非金属间的拮抗作用[].
12h后Se(Ⅳ)对Sb(Ⅲ)胁迫下蚯蚓的生长产生了影响,其生物效应与含量的关系遵循Weinberg原理,即低含量Se(Ⅳ)能够减少蚯蚓体内Sb(Ⅲ)含量,高含量Se(Ⅳ)则能促进蚯蚓对Sb(Ⅲ)的吸收,当Se(Ⅳ)的含量处于一定范围时,对蚯蚓体内Sb(Ⅲ)起到了很好的解毒作用,这与吴永尧[13]研究水稻的结果一致.本研究表明,当Se(Ⅳ)处于一个较低水平(低于2mg/kg)或者较高水平时(高于10mg/kg),蚯蚓体内Sb(Ⅲ)与Se(Ⅳ)呈现协同作用;而当Se(Ⅳ)的质量分数处于一定水平时(2~10mg/kg),蚯蚓体内Sb(Ⅲ)与Se(Ⅳ)呈现拮抗作用,在此范围内,Se(Ⅳ)对蚯蚓体内的Sb(Ⅲ)起到解毒作用.
3.4 不同的暴露时间下蚯蚓体内Sb(Ⅲ)/Se(Ⅳ)质量比值的变化
同一含量下,不同的暴露时间对蚯蚓体内Sb(Ⅲ)/Se(Ⅳ)质量比值的变化如图2所示.
如图2所示,在未加入Se(Ⅳ)的土壤中饲养蚯蚓,蚯蚓体内Sb(Ⅲ)/Se(Ⅳ)值随着暴露时间推移呈现持续上升趋势,说明随着时间推移,蚯蚓体内自身的Se(Ⅳ)并不足以抵御外来源Sb(Ⅲ)的侵入使得Sb(Ⅲ)在蚯蚓体内积累.
当土壤中Se(Ⅳ)质量分数为1~5mg/kg时,在最初4d时间里,Se(Ⅳ)并未减弱Sb(Ⅲ)对蚯蚓的毒害,蚯蚓体内Sb(Ⅲ)/Se(Ⅳ)值升高.然而4d之后,蚯蚓体内Sb(Ⅲ)/Se(Ⅳ)值呈现下降趋势,在此时间段内这2种元素在蚯蚓体内呈现出了拮抗作用.这可能是由于在初始阶段由于Sb(Ⅲ)的吸附能力比Se(Ⅳ)强,所以在蚯蚓体内相互竞争进入细胞中,并起到了毒害作用.随着时间推移,Se(Ⅳ)结合在细胞上,然后被损害的细胞所利用,起到了解毒作用,这可能就是Sb(Ⅲ)与Se(Ⅳ)起到了拮抗作用.
当土壤中Se(Ⅳ)的质量分数为5~20mg/kg时,Se(Ⅳ)从第2天开始就对蚯蚓体内的Sb(Ⅲ)起到了解毒作用,在这个时间后,这2种元素在蚯蚓体内是拮抗作用.总之,随着暴露时间的增长,Sb(Ⅲ)的质量分数较空白对照减少19.6%~89.7%.而且随着土壤中Se(Ⅳ)含量的增加,Se(Ⅳ)对蚯蚓开始起解毒作用的时间也在发生变化,由之前4d缩短到2d.

图2 不同暴露时间下,蚯蚓体内m(Sb)/m(Se)值Fig.2 m(Sb)/m(Se)value of earthworm body after different exposure period
综上所述,当Sb(Ⅲ)与Se(Ⅳ)同时存在时,它们在蚯蚓体内的相互作用是拮抗与协同并存.有研究表明,当2种元素同时存在,首先进入的元素吸附到细胞壁上,此时细胞壁形成一个酸性结合部位,之后这2种元素在此结合部位相互竞争,这种物理化学过程解释了元素之间的拮抗作用,但目前还没有机理能很好解释元素之间的协同作用[14-15].
4 结论
通过以上实验发现,Se(Ⅳ)对Sb(Ⅲ)胁迫下蚯蚓的生长产生了影响,其生物效应与含量的关系遵循Weinberg原理,即当Se(Ⅳ)质量分数处于一个较低水平(低于2mg/kg)或者较高水平时(高于10mg/kg),蚯蚓体内Sb(Ⅲ)与Se(Ⅳ)呈现协同作用;而当Se(Ⅳ)质量分数处于一定水平时(2~10mg/kg),蚯蚓体内Sb(Ⅲ)与Se(Ⅳ)呈现拮抗作用,在此范围,Se(Ⅳ)对蚯蚓体内Sb(Ⅲ)起到解毒作用.
随着暴露时间推移,蚯蚓体内Sb(Ⅲ)含量减少,相对减少19.6%~89.7%.而且随着土壤中Se(Ⅳ)含量的增加,Se(Ⅳ)在蚯蚓体内起到解毒作用的时间缩短,由4d缩短到2d.
[1] 何孟常,万红艳.环境中锑的分布、存在形态及毒性和生物有效性[J].化学进展,2004,16(1):1312-1317.
HE Mengchang,WAN Hongyan.Distribution,speciation,toxicity and bioavailability of antimony in the environment[J].Progress in Chemistry,2004,16(1):1312-1317.
[2] LYONS G,ORTIZ-MONASTERIO I,STANGOULIS J,et al.Selenium concentration in wheat grain:Is there sufficient genotypic variation to use in breeding[J].Plant Soil,2005,269(1-2):369-380.
[3] HARTIKAINEN H,XUE T L,PIIRONEN V.Selenium as an anti-oxidant and pro-oxidant in ryegrass[J].Plant Soil,2000,225(1-2):193-200.
[4] MORA M,PINILLA L,ROSAS A,et al.Selenium uptake and its influence on the antioxidative system of white clover as affected by lime and phosphorus fertilization[J].Plant Soil,2008,303(1-2):139-149.
[5] GARCIA-BARRERA T,GOMEZ-ARIZA J L,GONZALEZ-FERNANDEZ M,et al.Biological responses related to antagonistic and synergistic interactions of chemical species[J].Analytical and bioanalytical chemistry,2012,403(8):2237-2253.
[6] ORDIANO-FLORES A,ROSITES-MAETINEZ R,GALVAN-MAGANA F.Biomagnifications of mercury and its antagonistic interaction with selenium in yellowfin tuna Thunus albacares in the trophic web of Baja California Sur Mexico[J].Ecotoxicology and Environmental Safety,2012,86:182-187.
[7] HE P P,LV X Z,WANG G Y.Effects of Se and Zn supplementation on the antagonism against Pb and Cd in vegetables[J].Environment International,2004,30(2):167-172.
[8] YATHAVAKILLA S,CARUSO J.A study of Se-Hg antagonism in Glycine max(soybean)roots by size exclusion and reversed phase HPLC-ICP-MS[J].Analytical and bioanalytical chemistry,2007,389(3):715-723.
[9] 廖自基.微量元素的环境化学及生物效应[M].北京:中国环境科学出版社,1992.
LIAO Ziji.Environmental chemistry and biological effect of trace element[M].Beijing:China Environmental Science Press,1992.
[10] 伏小勇,秦赏,杨柳,等.蚯蚓对土壤中重金属的富集作用研究[J].农业环境科学学报,2009,28(1):78-83.FU Xiaoyong,QIN Shang,YANG Liu,et al.Effects of earthworm accumulation of heavy metals in soil matrix[J].Journal of Agro-Environment Science,2009,28(1):78-83.
[11] 董银根,沈惠君.石墨炉原子吸收光谱法测定奶牛血清中硒[J].光谱学与光谱分析,2002,22(4):691-692.
DONG Yingen,SHEN Huijun.Determination of selenium in serum of dairy cows by graphite furnace atomic absorption spectrometry[J].Spectroscopy and Spectral Analysis,2002,22(4):691-692.
[12] 王丽鑫,胡晓荣,谭智勇,等.生物体内汞与硒的相互作用[J].重庆环境科学,2002(2):73-75.
WANG Lixin,HU Xiaorong,TAN Zhiyong,et al.Correlations between mercury and selenium in organisms[J].Chong Qing Environmental Science,2002(2):73-75.
[13] 吴永尧,卢向阳,彭振坤,等.硒在水稻中的生物生化作用探讨[J].中国农业科学,2000,33(1):100-103.
WU Yongyao,LU Xiangyang,PENG Zhenkun,et al.Effect of Se on physiological and biochemical characters of paddy rice[J].Scientia Agricultura Sinica,2000,33(1):100-103.
[14] CARPENE E,GEORGE S G.Absorption by gills of Mytilus edulis[L].Molecular and Physiological,1981(1):23-34.
[15] SAKAGUCHI T,TSUJI T,NAKAJIMA A,et al.Accumulation of cadmium by green microalgae[J].Applied Microbiology and Biotechnology,1979(8):207-215.
(责任编辑:梁俊红)
Antagonistic effect of Se(Ⅳ)on the Eisenia foetida against Sb(Ⅲ)
LlANG Shuxuan,WANG Kai,GENG Mengjiao,Ll Fan
(College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China)
Detoxication effect of selenium on antimony in earthworms(Eisenia Foetida)body was investigated in this study.The interaction of selenium and antimony of different dosages in earthworms was determinatied.The earthworms were breed in artificial soil with different concentration of selenium and antimony after 12hours to 7days.The whole earthworm was freezed to death and grinded into powder samples respectively.The sample concentration of selenium and antimony was determined by inductively coupled plasma mass spectrometry(ICP-MS).The results revealed that selenium alleviated the toxicity of antimony obviously in suitable concentration.High levels of selenium were synergy on antimony,but with the extension of exposure time,selenium also showed the detoxification effect.The antagonistic effect was obvious when selenium concentration was in the range of 2to 10mg/kg.With the increasing of the selenium concentration,the detoxification time in earthworms was shortening from 4dto 2d.
Eisenia foetida;selenium;antimony;antagonism;synerg y
X174
A
1000-1565(2013)03-0264-06
10.3969/j.issn.1000-1565.2013.03.008
- 河北大学学报(自然科学版)的其它文章
- 黄芩根围AM真菌优势种
——网状球囊霉的培养 - 基于单应性矩阵分解的视觉控制器设计及仿真
- 介质阻挡放电中的八边形结构

