前庭习服对运动病大鼠前庭核和海马细胞c-Fos表达的影响*
张云峰 ,李 霞 ,姜正林 **
(1南通大学附属医院神经内科,江苏 226001;2南通大学航海医学研究所)
运动病是指机体在受到异常运动刺激时,眼、前庭感受器和肌肉本体感受器等感觉传入信息间失去平衡,或新的运动感觉与原有感觉经验不一致,表现出恶心,呕吐,异食癖等一系列胃肠道症状[1]。随着航海航空航天事业的发展,有关运动病的研究越来越被人们重视。前庭习服是防治运动病的一项重要的干预手段[2-3],它是指在运动环境中进行适应性锻炼,继而对某一特定运动刺激的耐受力提高的行为学表现。阐明机体对前庭刺激的适应机制,不仅可以更好地理解运动病发生的病理生理机制,且还助于人类探寻更有效的防治运动病的新方法。但到目前为止,前庭习服的机制尚不清楚。早在1994年Wood等[2]曾指出习服就是中枢神经系统对反复出现的同一种刺激方式慢慢形成的积极有效的反应,其过程与条件反射相似,但它又是一种特殊的条件性唤醒和“学习行为”,但前庭习服行为过程中学习记忆的参与及其具体机制少有报道。
c-Fos基因是即早基因的一种,正常情况下表达很低,多种刺激可引起其在脑内快速而短暂的表达增高,形成大量c-Fos蛋白。作为核内反式作用因子,可将细胞外信息传递到核内,通过与核蛋白Jun通过“亮氨酸拉链”形成Fos/Jun二聚体,即激活蛋白(activator protein-1,AP-1)[4-5]。AP-1 可特异地结合某些基因的特异位点TGACTA,诱导靶基因表达。将c-Fos的反义ODN注射到大鼠海马,发现动物的长时程记忆(long term memory,LTM)降低40%以上,提示c-Fos在LTM中起重要作用[6]。研究还发现在动物的记忆过程中都伴有c-Fos的表达,提示c-Fos表达与记忆可能存在密切关系[7]。本研究采用免疫组化法对习服前后运动病敏感组大鼠,脑内前庭核和海马脑区c-Fos阳性神经元在旋转刺激后数量的统计分析,深入探讨海马神经元在前庭习服中可能发挥的作用,为习服机制的基础性研究提供细胞学线索。
1 材料和方法
1.1 材料 (1)动物:SD大鼠36只,雌雄各半,体重220~250g,由南通大学实验动物中心提供。(2)试剂:兔抗c-Fos抗体(Santa Cruz公司)、生物素化的羊抗兔IgG(Sigma公司)、DAB显色Kit(Vector公司)。
1.2 方法 (1)条件性厌食症大鼠运动病模型制作:旋转刺激装置根据Crampton等的报道仿制而成[8]。实验时将大鼠无束缚地放入旋转装置的有机玻璃笼内,绕水平轴顺时针旋转。以16°/s2角加速度加速,达最高速度 120°/s2后,立即以 48°/s2的角减速度减速,直至旋转停止为1个周期,历时10s,如此反复刺激30min。观察旋转刺激后动物对0.15%糖精水饮用量的减少情况,判定大鼠的运动病耐受力。(2)前庭习服模型制作:将运动病模型大鼠每隔1日给予上述旋转刺激,每次30min,如此持续锻炼28d,用旋转刺激诱导条件性味觉厌恶的方法,判定这种锻炼提高大鼠的运动病耐力的程度,来表明动物是否获得前庭功能习服。(3)免疫组织化学法:观察正常组、习服前刺激组、习服后刺激组大鼠脑内前庭核和海马脑区c-Fos阳性神经元的情况并进行比较。每只实验动物接受相应刺激后立即按0.2mL/100g的标准,以复合麻醉剂腹腔麻醉,经左心室向升主动脉快速灌注生理盐水150mL,然后用4%PFA灌注。切片采用冰冻切片机(Leica CM 1950,Germany),片厚10μm。免疫组化染色:一抗(按 1∶250 稀释),于 4℃冰箱中孵育过夜;HRP标记的二抗 (按1∶1 000稀释),室温下2h;后倾去液体,用0.01M PBS洗3次每次10min,再用DAB显色Kit进行显色,中性树脂封片后备用。图像采集使用Olympus光学显微镜,并对相关脑区c-Fos阳性细胞进行计数,图像分析使用软件 ImageJ(美国 NIH)。
1.3 统计学处理 采用Sigmaplot 12.0数据分析软件。实验数据以x¯±s表示。用 Sigmastat 2.0 进行 t检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 习服锻炼对旋转刺激后大鼠糖精水饮用量影响 根据旋转刺激后糖精水饮用量减少的幅度对36只大鼠进行运动病敏感性评价。具体如下:先不予旋转刺激,挑选出连续3天0.15%糖精水饮用量变化不大的大鼠,29只大鼠(90.6%)符合要求。旋转刺激后发现14只大鼠糖精水饮用量较旋转前显著性减少,幅度达到20%以上。将这部分大鼠划为运动病敏感组,其中6只作为旋转刺激组,另外8只接受前庭习服训练。并分别于 0d、7d、14d、21d、28d 旋转锻炼后进行糖精水饮用量的测量。通过比较锻炼不同时间后,大鼠糖精水饮用量旋转前后的减少百分比,对大鼠的前庭习服进行动态评价。理论上该数值越接近0,习服效果越好。我们发现8只大鼠接受14次锻炼后,有7只大鼠在锻炼第28天的糖精水饮用量旋转前后差异降低显著。其中1只大鼠经过28d旋转锻炼后,旋转前后糖精水饮用量的减少百分比由31.6%下降至16.7%,呈降低趋势,但并未降至10%以下或者习服前后减少的百分比未超过20%,剔除习服效果不佳者。对习服效果好的7只大鼠,饮用0.15%糖精水旋转后减少百分比进行统计。在训练7d、14d和21d后,旋转后大鼠糖精水饮用量减少幅度与锻炼前(0d)比较,由30.8%分别下降至19.71%、16.46%和 11.96%,差异有统计学意义(P<0.05)(见图 1)。训练到 28d 时,大鼠对运动病完全习服,旋转后大鼠糖精水饮用量减少幅度与锻炼前(0d)比较,显著性下降至 1.84%(P<0.01),基本上回到基础水平(图1)。由此可见,前庭锻炼可大大提高大鼠对运动病的耐受力,实现前庭习服,模型成功。
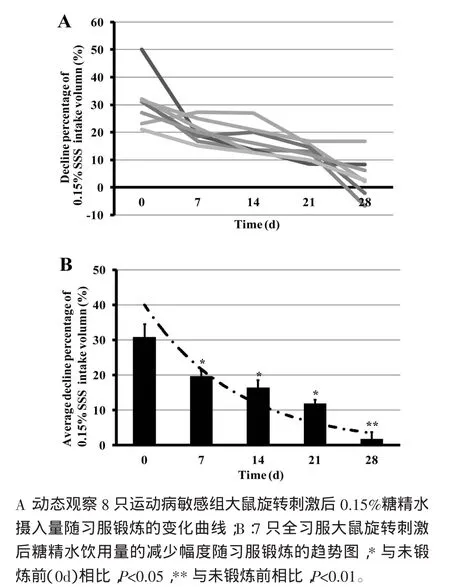
图1 前庭习服锻炼对旋转刺激后大鼠0.15%糖精水饮用量的影响
2.2 习服锻炼对前庭核和海马脑区c-Fos阳性神经元表达的影响 通过比较基础状态(未受旋转刺激),对照组和全习服组在接受锻炼前后旋转刺激对前庭核团c-Fos免疫标记阳性神经元数量的变化(表1和图2),我们发现运动病敏感组大鼠未经习服锻炼前,与基础状态组(n=3)相比,旋转刺激组(n=3)大鼠前庭核团c-Fos阳性神经元数量明显增加(P<0.01),但是当大鼠经过了长达28d为期14次的习服锻炼后,对7只全习服大鼠前庭核团c-Fos阳性神经元数目的观察结果显示免疫阳性细胞数目明显减少,与基础水平比较差异无统计学意义(P>0.05)。与前庭核团不同(表 1),在未习服锻炼前,海马脑区c-Fos阳性神经元数量在旋转刺激后较刺激前有增高的趋势(P>0.05),随着习服训练的完成,全习服化的7只大鼠海马脑区c-Fos阳性神经细胞数明显增多差异有统计学意义(P<0.01)。

表1 习服锻炼前后前庭核团与海马脑区c-Fos免疫阳性反应神经细胞数量受旋转刺激影响
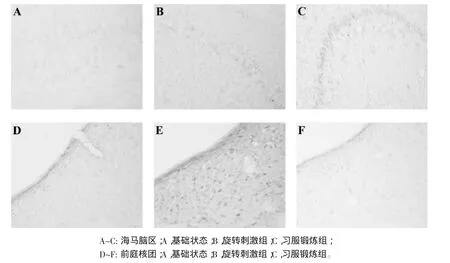
图2 习服锻炼前后前庭核团与海马脑区c-Fos免疫阳性反应神经细胞变化
3 讨 论
前庭习服作为防治运动病的重要手段其形式繁多,可经常乘坐交通工具以获得一定的适应。也可进行荡秋千、滚轮、过山车和某些特殊体育运动,来锻炼前庭功能以获得适应[3]。虽然其具体效果会受到运动刺激的频率、持续时间及强度和类型的影响,但因其无副作用且长期疗效稳固,在航空、航天与航海领域备受关注。
习服具体有两种形式,一种是快速耐受,即通过持续地暴露于同一运动刺激条件下,经3~4d形成对该运动刺激的习服。另一种是阶段性耐受即适应性前庭功能锻炼,通过对某一运动刺激方式间断地反复地暴露而产生适应。它可有效地降低机体对运动病的敏感性,对运动病的发生起到很好的预防作用。这一过程其实是对某种学习内容的唤醒,其发生很可能与脑内某些特定中枢受前庭刺激后代偿性的激活有关[2]。作为信息传递的“第三信使”,c-Fos在神经系统的信号传递中通过促使应激刺激后机体内某些特定基因表达改变,使得短时程信号发挥长时程效应,继而激发了脑内相应核团神经元产生可塑性改变[9-11]。本研究显示海马作为参与学习记忆环路的重要脑区,在通过隔天的反复适应性前庭功能锻炼后,大鼠对前庭刺激完全耐受。此时c-Fos在海马脑区的表达明显增高,提示海马脑区在习服后发生激活,参与到前庭习服形成的神经可塑性环路中。同时前庭核团本身在习服后,c-Fos标记阳性细胞数量的降低也说明,前庭核团的神经元活动在大鼠对前庭刺激耐受的情况下,发生了可塑性改变。这些均支持前庭习服与学习记忆,及海马神经元突触可塑性间存在密切联系的观点。乙酰胆碱是与学习记忆密切相关的神经递质,Takeda[12]认为与运动病发生密切相关的中枢乙酰胆碱能神经递质系统,可能参与前庭习服的发生。研究发现抗胆碱能药物东莨菪胆碱,一方面可通过调节Ach的含量,以减弱脑内中枢神经递质系统不平衡的现象,从而达到预防运动病的发生。另一方面还可通过易化或敏化前庭适应或前庭习服的过程来发挥作用,这在去甲肾上腺素能和组胺能中枢递质系统与运动病关系的研究中尚无报道。那么,这是否提示乙酰胆碱或M型胆碱受体可能是受c-Fos激活后AP-1调节的下游靶基因影响,继而参与前庭习服过程的敏化,具体的机制还有待进一步研究。
本研究从c-Fos蛋白入手,将神经环路可塑性与前庭习服的机制联系起来,为进一步探讨运动病前庭习服的调控机制及生理意义奠定了实验基础。
[1]Cordick N,Parker LA,Ossenkopp KP.Rotation-induced conditioned rejection in the taste reactivity test[J].Neuroreport,1999,10(7):1557-1559.
[2]Wood CD,Stewart JJ,Wood MJ,et al.Habituation and motion sickness[J].J Clin Pharmacol,1994,34(6):628-634.
[3]Shupak A,Gordon CR.Motion sickness:advances in pathogenesis,prediction,prevention,and treatment[J].Aviat Space Environ Med,2006,77(12):1213-1223.
[4]Ceccatelli S,Villar MJ,Goldstein M,et al.Expression of c-Fos immunoreactivity in transmitter-characterized neurons after stress[J].Proc Natl Acad Sci USA,1989,86(23):9569-9573.
[5]Weinberg MS,Girotti M,Spencer RL.Restraint-induced fra-2 and c-fos expression in the rat forebrain:relationship to stress duration[J].Neuroscience,2007,150(2):478-486.
[6]Countryman RA,Kaban NL,Colombo PJ.Hippocampal c-fos is necessary for long-term memory of a socially transmitted food preference[J].Neurobiol Learn Mem,2005,84(3):175-183.[7]Mayer U,Watanabe S,Bischof HJ.Hippocampal activation of immediate early genes Zenk and c-Fos in zebra finches(Taeniopygia guttata)during learning and recall of a spatial memory task[J].Neurobiol Learn Mem,2010,93(3):322-329.[8]Crampton GH,Lucot JB.Habituation of motion sickness in the cat[J].Aviat Space Environ Med,1991,62(3):212-215.
[9]Kaczmarek L,Nikolajew E.C-fos protooncogene expression and neuronal plasticity[J].Acta Neurobiol Exp(Wars),1990,50(4-5):173-179.
[10]Wu J,Hu Q,Huang D,et al.Effect of electrical stimulation of sciatic nerve on synaptic plasticity of spinal dorsal Horn and spinal c-fos expression in neonatal,juvenile and adult rats[J].Brain Res,2012,1448:11-19.
[11]Vanelzakker MB,Zoladz PR,Thompson VM,et al.Influence of Pre-Training predator stress on the expression of cfos mRNA in the hippocampus,amygdala,and striatum following Long-Term spatial memory retrieval[J].Front Behav Neurosci,2011,5:30.
[12]Takeda N,Morita M,Horii A,et al.Neural mechanisms of motion sickness[J].J Med Invest,2001,48(1-2):44-59.

