Hedgehog 信号通路中Gli-1 蛋白在食管鳞癌中的表达及意义
鞠雷,甄伟,臧东钰
(1.辽宁医学院附属第三医院,辽宁 锦州 121001;2.盘锦市中心医院,辽宁 盘锦 124000;3.辽东学院,辽宁 丹东 118000)
我国食管癌的发病率和死亡率高居世界首位[1]。尽管我国食管癌的诊断和治疗水平处于世界领先地位,但综合5 年生存率也在30% 左右,其根本原因还是无法做到早期诊断、早期治疗。Hedgehog (Hh)信号传导通路是一个经典的胚胎发育信号通路[2],近年研究发现它在多种肿瘤的发生、分化、侵袭和转移中起关键性作用[3]。本实验应用免疫组织化学技术,探讨Hh 信号通路中核转录因子Gli-1 的异常激活与食管鳞癌间的关系,力争为食管鳞癌的早期诊断和治疗提供新的思路和线索。
1 材料和方法
1.1 材料与试剂 50 例食管鳞癌及癌旁组织标本取自辽宁医学院附属第三和第一医院2010—2012年手术切除存档蜡块。患者均为男性,年龄49~75 岁,平均62 岁。Gli-1 兔多克隆抗体购自美国Santa Cruz 公司,SABC 试剂盒购自武汉博士德生物制品有限公司。
1.2 免疫组织化学染色 所有石蜡切片脱蜡水化,抗原修复,3%H2O2孵育,滴加一抗(1 ∶50),4℃湿盒过夜,滴加二抗,37 ℃温箱20 min,滴加SABC 液,37 ℃温箱30 min,DAB 显色,苏木素复染细胞核,脱水,透明,二甲苯封片。用已知的阳性对照片做阳性对照,PBS 代替一抗作阴性对照,光学显微镜下观察并摄片。
1.3 结果判定 Gli-1 蛋白以胞质或胞核出现浅黄色至深棕色颗粒判断为阳性细胞。随机选取10个高倍视野,分别计数200 个细胞。以染色强度结合阳性细胞百分比综合计分进行定性分析。(1)计数阳性细胞占细胞总数的百分比并分级,0~5%、5~25%、25~50%和>50%分别对应0、1、2 和3 分;(2)根据阳性细胞的着色强弱分级,阴性、浅黄色、棕色和深棕色分别对应0、1、2 和3 分。两项评分相加后进行判断,0 分、1~2 分、3~4 分和5~6 分分别对应- (阴性)、 + (弱阳性)、+ + (中度阳性)和+ + + (强阳性)。我们判定+ + / + + +为异常表达。
1.4 统计学处理 应用SPSS13.0 统计软件进行卡方检验。
2 结 果
2.1 免疫组织化学结果 Gli-1 蛋白主要表达在胞质或胞核,它在癌旁组织中表达较弱,但在鳞癌中表达明显增强,二者比较有显著性差异(图1)。
2.2 Gli-1 在ESC 中的表达与临床病例特征的关系 Gli-1 在ESC 及PC 中的表达与患者的年龄、病变部位无显著相关(P >0.05),但Gli-1 在ESC 中的表达与肿瘤分化程度、TNM 分期密切相关(表1)。
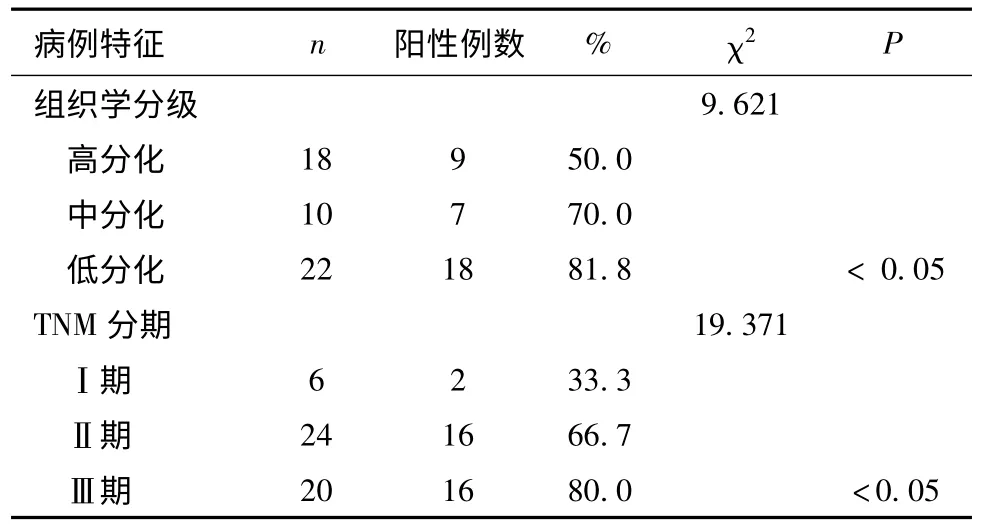
表1 50例患者Gli-1 蛋白在食管鳞癌及癌旁组织中的表达与临床病例特征的关系
3 讨 论
近年来发现,一些在胚胎发育、细胞分化过程中起重要调控作用的信号传导通路 (如Wnt、Norch、TGF 及Hedghoge 等),在食管癌的发生、发展中也起着重要作用。Hh 信号传导通路是一个经典的胚胎发育信号通路,但在多种肿瘤组织中都存在Hh 信号通路的异常激活[4-6],尤其是其上游配体Shh 和下游转录因子Gli-1 不同程度的激活,可以使得肿瘤细胞更具有侵袭性和转移能力[7]。因此本实验采用免疫组织化学技术并结合临床资料,研究Hh 通路中Gli-1 蛋白在食管鳞癌中的表达及意义,以探讨Hh 信号转导通路的异常激活与食管鳞癌之间的关系。
Hh 信号通路主要由Hh 配体与膜蛋白受体Ptch 及Smo 组成复合物,其下游包含Gli、Fu、Su(Fu)等许多分子。当Hh 大量存在时,Ptch 可与Shh 结合并解除对Smo 的抑制作用,Smo 可与信号通路下游的因子SU、FU 及Gli 等结合,使Gli 活化并进入细胞核,进而调节多种靶基因的表达。Gli 家族在脊椎动物中包括Gli-1、Gli-2 和Gli-3 三种转录因子。Gli-1 主要起激活目的基因转录的作用,同时也是该信号通路下游的目的基因分子,肿瘤组织中Gli-1mRNA 表达上调是该信号通路异常活化的标志[8]。Kogerman 等[9]报道,阻止Gli-1 入核可以抑制目标基因的转录激活,表明Gli-1 入核对于Hh 信号通路运作非常重要。本实验结果发现,Gli-1 蛋白主要表达在胞质和胞核,它在癌旁食管组织中表达较低,但在癌组织中的表达明显增强,而且随着分化程度的降低和TNM 分期的升高,Gli-1 蛋白的表达逐渐增强。因此我们认为,在食管鳞癌的发生、发展过程中可能存在Hh 信号通路的异常激活。
许多参与肿瘤细胞增殖与扩散的效应分子均源于Hh 信号通路的靶基因或下游分子,且Hh 信号通路与其它调控肿瘤细胞分化、增殖的信号通路也有着交叉作用。因此,深入研究Hh 信号传导通路与食管癌发生、发展的关系,对进一步提高食管癌的诊断和治疗水平具有重要意义。
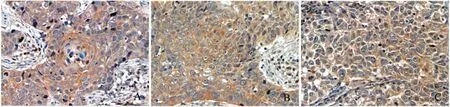
图1 Gli-1 在食管鳞癌中的表达 ×400
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61:69-90.
[2]Nusslein-Volhard C,Lohs-Schardin M,Sander K,et al.A dorso-ventral shift of embryonic primordia in a new maternal-effect mutant of Drosophila[J].Nature,1980,283 (5746):474-476.
[3]Theunissen JW,de Sauvage FJ.Paracrine Hedgehog signaling in cancer [J].Cancer Res,2009,69 (15):6007-6010.
[4]Barakat MT,Humke EW,Scott MP.Learning from Jekyll to control Hyde:Hedgehog signaling in development and cancer[J].Trends Mol Med,2010,16 (8):337-348.
[5]Caro I,Low JA.The role of the hedgehog signaling pathway in the development of basal cell carcinoma and opportunities for treatment [J].Clin Cancer Res,2010,16:3335-3339.
[6]Bisht S,Brossart P,Maitra A,et al.Agents targeting the Hedgehog pathway for pancreatic cancer treatment [J].Curr Opin Investig Drugs,2010,11:1387-1398.
[7]Tada M,Kanai F,Tanaka Y,et al.Down- regulation of hedgehog-interacting protein through genetic and epigenetic alterations in human hepatocellular carcinoma [J].Clin Cancer Res,2008,14:3768-3776.
[8]Monnier V,Ho KS,Sanial M,et al.Hedgehog signal transduction Proteins:contacts of the Fused kinase and Ci transcription factor with the kinesin-related Protein Costal2 [J].BMC Dev Biol,2002,2:4.
[9]Kogerman P,Grimm T,Kogerman L,et al.Mammalian suppressor of- Fused- modulates nuclear cytoplasmic shuttling of Gli-1 [J].Nat Cell Biol,1999,1 (5):312-319.

