异常高表达TCTP通过上调Bcl-xL抑制胰腺癌细胞的细胞凋亡
张飞王瑧张萍张波杨文涛李影奕
1.复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海200032;
2.复旦大学附属肿瘤医院胰腺肝胆外科,复旦大学上海医学院肿瘤学系,上海200032;
3.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海200032
异常高表达TCTP通过上调Bcl-xL抑制胰腺癌细胞的细胞凋亡
张飞1王瑧1张萍1张波2杨文涛3李影奕1
1.复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海200032;
2.复旦大学附属肿瘤医院胰腺肝胆外科,复旦大学上海医学院肿瘤学系,上海200032;
3.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:胰腺癌是一种常见的恶性肿瘤,病死率高,5年生存率<5%,目前尚无很好的治疗方法。翻译控制肿瘤蛋白(translationally controlled tumor protein,TCTP)是一个生长相关的蛋白质,有促进肿瘤生长,抗细胞凋亡的作用,目前有研究显示TCTP在肝癌、结直肠癌中异常高表达,但其在胰腺癌中的相关研究报道较少。本研究通过对TCTP在胰腺癌细胞中的表达及其生物学作用机制分析,致力于寻找新的肿瘤分子靶点,为胰腺癌的靶向治疗提供依据。方法:采用免疫组织化学方法检测胰腺癌组织中TCTP表达情况;RT-PCR检测胰腺癌细胞株中TCTP的mRNA表达,Western blot方法检测胰腺癌细胞株中TCTP和Bcl-xL蛋白表达水平;免疫荧光染色方法检测TCTP在胰腺癌细胞中的定位;小分子RNA干扰技术沉默胰腺癌细胞中TCTP表达后,利用CCK-8试剂盒检测细胞增殖,流式细胞仪检测胰腺癌细胞的细胞周期和细胞凋亡等生物学指标。结果:与正常胰腺组织相比,胰腺癌组织中TCTP异常高表达,并且主要位于胰腺癌细胞的细胞质中;不同胰腺癌细胞株中TCTP也呈高表达;siRNA沉默胰腺癌细胞中的TCTP,显著抑制细胞的增殖速度和细胞周期进程,促进细胞的凋亡;在胰腺癌细胞中Bcl-xL表达与TCTP表达呈正相关,沉默TCTP可以下调Bcl-xL的蛋白表达。结论:异常高表达TCTP,通过上调Bcl-xL抑制细胞凋亡,从而促进胰腺癌的发生和发展。
翻译控制肿瘤蛋白;胰腺癌;Bcl-xL;siRNA
胰腺癌是全球范围内常见恶性肿瘤,生存期短,病死率居恶性肿瘤的第4位[1],早期胰腺癌患者主要接受手术、化学药物及放射治疗,其5年生存率约20%。晚期胰腺癌患者已经失去了根治性手术切除的机会,中位生存期仅为 3~6个月,5年生存率<5%[2]。因此,寻找新的调节胰腺癌发生、发展的关键靶基因及相关分子生物学机制,对于胰腺癌的治疗及预后评估具有重要的转化应用价值。
翻译控制肿瘤蛋白(translationally controlled tumor protein,TCTP)是一个高度保守的亲水性蛋白[3],广泛存在于真核生物包括真菌、酵母、昆虫、植物和哺乳动物[4]。TCTP又被称为IgE依赖的组胺释放因子(HRF)、fortilin、P21、P23和TPT-1[5-7]。TCTP最早发现于肿瘤细胞,由于其mRNA具有翻译控制mRNA的所有序列和结构,所以称之为翻译控制肿瘤蛋白[8]。TCTP基因定位于13q12—q14[9],由5个外显子和6个内含子构成,全长3 819个核苷酸,编码172个氨基酸[10]。TCTP是一个生长相关的蛋白质,有促进肿瘤生长、抗细胞凋亡的作用,阻断该蛋白表达能抑制肿瘤细胞的恶性表型[11]。TCTP在肝癌、结直肠癌中异常高表达[12-13],但其在胰腺癌中的相关研究报道较少。本研究通过对TCTP在胰腺癌中的表达及其作用分子机制解析,致力于寻找新的肿瘤分子靶点,为胰腺癌的靶向治疗提供依据。
1 材料和方法
1.1 细胞系
人胰腺癌细胞株PCI35、PCI55、Miapaca-2、PANC-1、L3.6pL培养于37 ℃,CO2体积分数为5%,含10%胎牛血清的RPMI-1640培养基中,BxPc-3、人胚肾HEK293细胞培养于37 ℃,CO2体积分数为5%,含10%胎牛血清的DMEM培养基(培养基和血清均购自Gibco公司)。
1.2 试剂
具体抗体试剂包括兔抗TCTP抗体(Epitomics公司)、鼠抗Bcl-xL抗体(ProteinTech公司)、羊抗兔HRP抗体、羊抗鼠HRP抗体(Santa Cruz Biotechnology公司)和绿色荧光抗兔HRP抗体(Jackson ImmunoResearch公司)。PCR反应试剂盒购自TaKaRa公司,免疫组化试剂盒GTvision DAB试剂盒购自Gene Tech公司,CCK-8试剂盒购自Dojindo公司,细胞周期和Annexin Ⅴ/PI凋亡试剂盒购自Invitrogen。LipofectamineTM2000转染试剂购自Invitrogen公司。
1.3 免疫组化染色
人胰腺癌组织来自复旦大学附属肿瘤医院,并且经过患者知情同意,距离癌组织2 cm以上的胰腺组织被视为正常胰腺组织用来做阴性对照组。组织经过脱蜡,用3%H2O2消除内源性过氧化物酶,正常羊血清常温封闭1 h,抗TCTP抗体(1∶500)4 ℃温育过夜,二抗(1∶100)37 ℃温育1 h,GTvision DAB kit免疫组化试剂盒显色。显微镜下观察结果,棕色颗粒定位于细胞质中。
1.4 逆转录PCR(reverse transcription PCR,RT-PCR)
根据GenBank数据库提供的TCTP基因序列信息,采用Premier 5.0软件设计特异性引物,经BLAST分析,由上海捷瑞公司合成。GAPDH引物为:上游5’-TGTGATGGTGGGAATGGGC -3’;下游5’-TTTGATGTCACGCACGATTTC -3’。TCTP引物为:上游5’-GGGGAAGATGGTCAGTAG-3’;下游5’-TCACGGTAGTCCAATAGAG -3’。
培养胰腺癌PCI35、PCI55、MiaPaca-2、BxPc-3、PANC-1、L3.6pL细胞和人胚肾HEK 293细胞,用TRIzol试剂提取细胞总RNA,并逆转录为cDNA,用PCR试剂盒进行扩增。GAPDH循环次数为25,退火温度为60 ℃,TCTP循环次数为30,退火温度为58 ℃。PCR产物经1.5%琼脂糖凝胶电泳分离目的条带和内参,条带经紫外光显色灰度扫描,半定量检测胰腺癌细胞系及HEK293细胞中TCTP基因表达水平。
1.5 蛋白质印迹法(Western blot)检测
收集胰腺癌PCI35、PCI55、Miapaca-2 BxPc-3、PANC-1、L3.6pL细胞和人胚肾HEK 293细胞,提取细胞总蛋白,BCA法测定蛋白浓度后,每个样品上样30 g,行蛋白电泳,电转移到PVDF膜(美国MiLLipore公司)上,封闭后顺序加一抗(1∶1 000),二抗(1∶5 000),进行杂交,ECL化学发光试剂盒(美国MiLLipore公司)检测杂交信号。
1.6 免疫荧光染色
将PCI55和MiaPaca-2细胞培养于载玻片上,4%的多聚甲醛固定,3%羊血清封闭1 h,一抗(抗TCTP抗体1∶100)4 ℃过夜,荧光二抗(1∶100)37 ℃温育1 h,细胞核用DAPI染色15 min,激光共聚焦(莱卡)检测荧光信号。
1.7 siRNA干扰TCTP蛋白表达
合成TCTP小分子干扰RNA(siRNA),TCTP siRNA序列为5’-AAGGTACCGAAAGCACAGT-3’,对照Scramble siRNA 序列为5’-UUCUCCGAACGUGUCACGUTT-3’。PCI55和MiaPaca-2细胞传代第2天用LipofectamineTM2000转染试剂(Invitrogen)按照说明书要求,将TCTP siRNA和 Scramble siRNA分别转入PCI55细胞中。
1.8 细胞活力检测
转染24 h后,将表达TCTP siRNA和 scramble siRNA的PCI55,MiaPaca-2细胞消化,分别以每孔3 000个细胞的密度接种于96孔培养板,每个时间点做5个平行样本,将培养板在37 ℃,CO2体积分数为5%的条件下培养。分别于图示时间向每孔加入10 μL CCK-8检测试剂,在培养箱内温育2 h。用酶标仪测定在450 nm处的吸光度值(A),计算每5孔的A值的平均值和标准差,绘制细胞生长曲线。
1.9 细胞周期与凋亡分析
PCI55和MiaPaca-2细胞分别以每孔2×105密度接种于6孔培养板,每孔细胞悬液体积2 mL。将细胞分别转染TCTP siRNA和 scramble siRNA,在37 ℃,CO2体积分数为5%的条件下培养48 h后,胰酶消化收集细胞(培养基上清液一起收集),1 000 r/min,离心5 min,然后细胞用预冷的PBS洗两遍。用1倍结合缓冲液重悬细胞,调节细胞浓度到1×106个细胞/mL。接着加入5 μL Annexin V-FITC及1 μL 100 μg/mL的PI工作液,轻轻混匀,避光室温反应15 min。最后加入1倍结合缓冲液400 μL,轻轻混匀,用流式细胞检测仪器检测细胞凋亡。
2 结 果
2.1 TCTP在胰腺癌组织中异常高表达
胰腺癌组织免疫组化染色结果显示,TCTP存在于胰腺癌细胞的细胞质中,在胰腺导管癌上皮细胞中异常高表达,而在癌旁正常的胰腺导管上皮细胞中则不表达(图1A,B)。当用兔IgG来代替抗TCTP抗体作为阴性对照时,结果并没有阳性反应,说明上述免疫组化染色反应具有特异性(图1C)。
2.2 TCTP在胰腺癌细胞中异常高表达
因为TCTP在胰腺癌组织中异常高表达,因此我们进一步检测了人胰腺癌细胞系PCI35、PCI55、MiaPaca-2、BxPc-3、PANC-1和L3.6pL中TCTP的表达情况。RT-PCR和蛋白免疫杂交结果显示,实验的6株胰腺癌细胞中,在mRNA水平和蛋白表达水平均检测到TCTP的表达,并且不同的胰腺癌细胞系中TCTP的表达不尽相同,但是都明显高于正常HEK293细胞(图2A,B)。免疫荧光染色结果进一步显示TCTP存在于PCI55细胞的细胞质中,成颗粒状分布(图 2C)。
2.3 沉默TCTP表达通过阻滞细胞周期进程和促进细胞凋亡从而抑制细胞增殖
利用siRNA技术沉默胰腺癌细胞中TCTP,观察其对胰腺癌细胞增殖、周期、凋亡的影响。PCI55细胞转染TCTP siRNA和scramble siRNA后,Western blot检测两组细胞中的TCTP含量,结果显示,干扰组中的TCTP蛋白表达明显低于对照组(图3A),沉默率达95%以上,说明沉默胰腺癌细胞中TCTP实验成功。沉默TCTP的PCI55细胞增殖速度显著慢于scramble对照组(图3B)。同时PCI55细胞中TCTP被沉默后,细胞G0/ G1期比例显著增加,S期、G2/M期细胞比例显著降低(图3C),伴随凋亡细胞数明显增加(图3D)。在MiaPaca-2胰腺癌细胞中得到了相似的结果。

图 1 免疫组化检测TCTP在胰腺癌组织中表达情况(400×)Fig. 1 Aberrant expression of TCTP in human pancreatic cancer tissue detected by immunohistochemistry (400×).
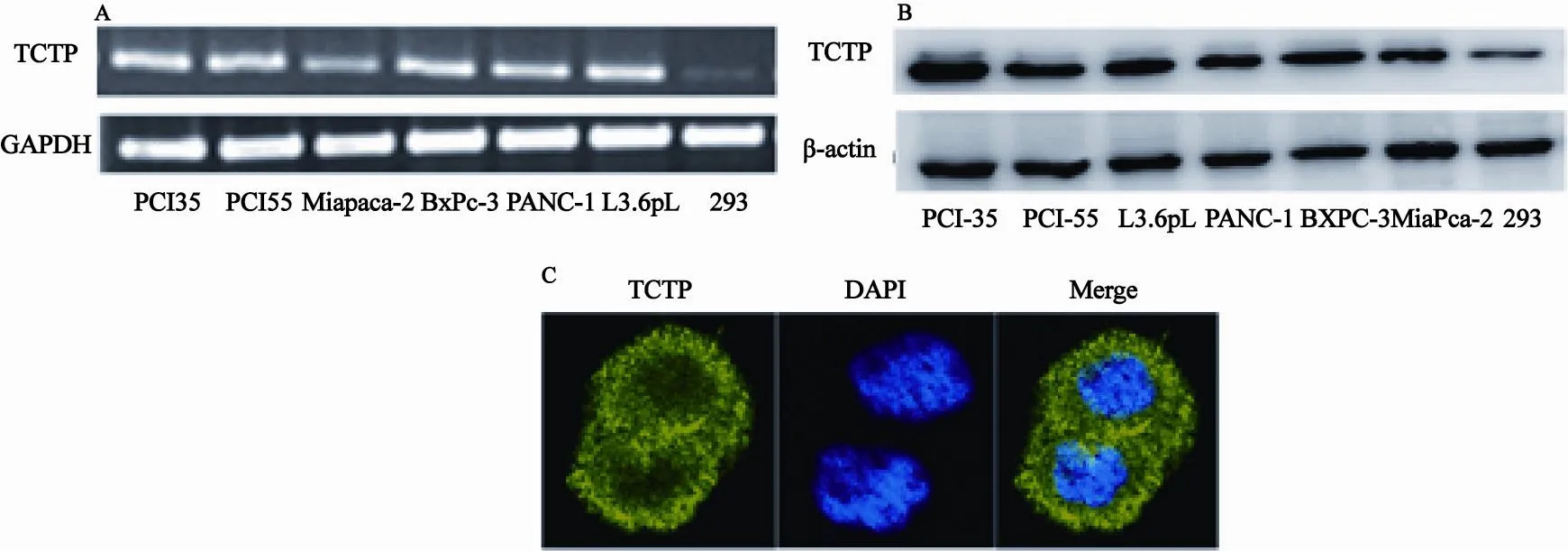
图 2 TCTP 在胰腺癌细胞中的表达情况Fig. 2 Constitutive expression of TCTP in human pancreatic cancer cell lines
2.4 TCTP通过上调Bcl-xL的表达抑制细胞凋亡
Western blot结果显示,在胰腺癌细胞株PCT55、PCI35、PANC-1、和MiaPaca-2中的TCTP表达量依次递减的同时,Bcl-xL在上述细胞中的蛋白表达量也呈相应的递减趋势(图4A),提示在胰腺癌细胞中TCTP可能影响Bcl-xL的表达。当用TCTP siRNA沉默PCI55和MiaPaca-2细胞中的TCTP后,Bcl-xL表达量也随之下降(图4B)。
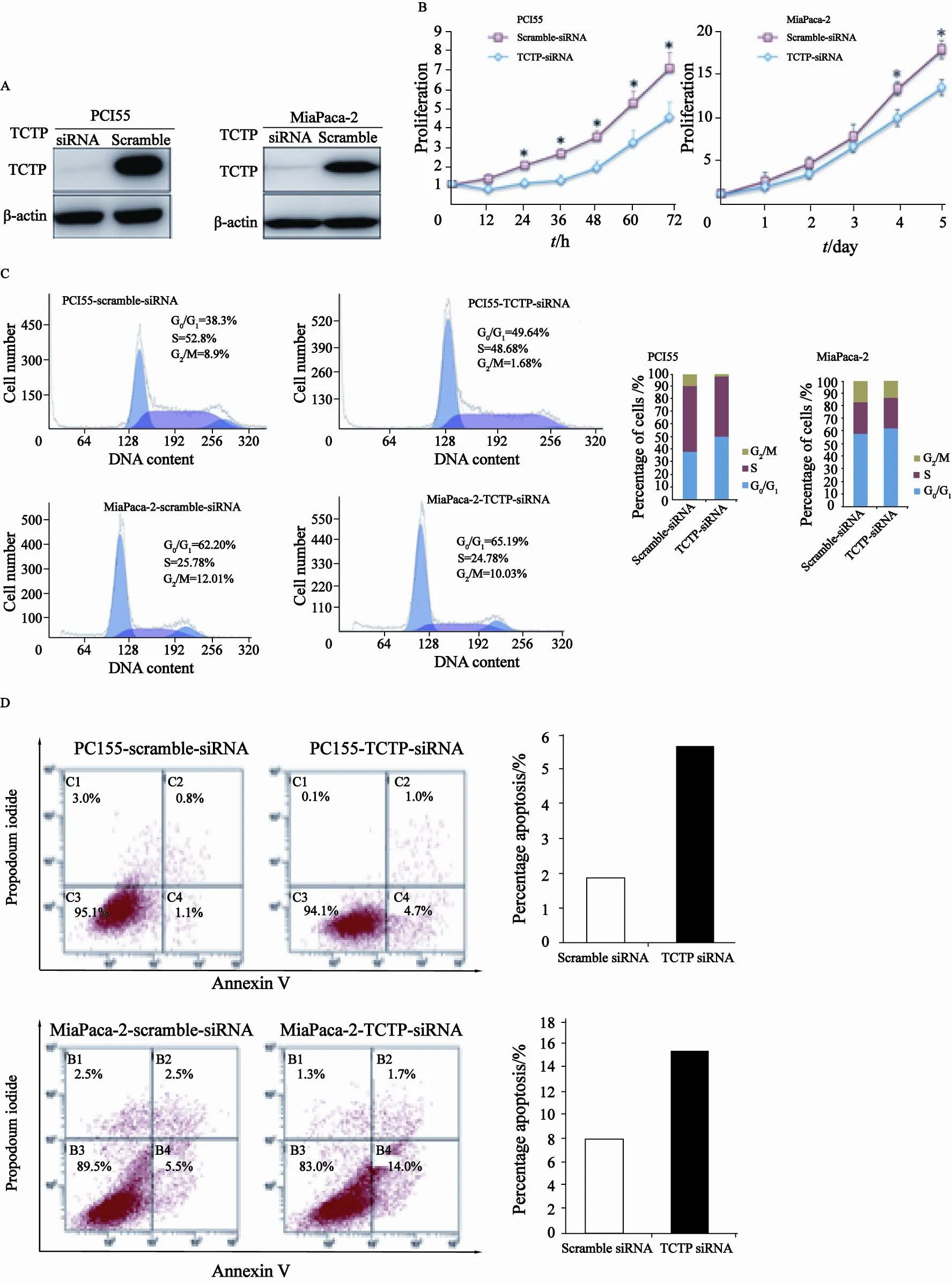
图 3 沉默TCTP表达对胰腺癌细胞的生物学行为影响Fig. 3 The effect of TCTP silence on biological behavior of pancreatic cancer cell lines PCI55 and MiaPaca-2

图 4 TCTP 对Bcl-xL表达的影响Fig. 4 The effect of TCTP on Bcl-xL expression
3 讨 论
胰腺癌是一种常见的恶性肿瘤,病死率高,5年生存率<5%,由于大多数患者诊断时已属晚期,无法进行手术和放射治疗,几种常用的化疗药物也并不能取得很好的疗效,并且容易产生耐药,所以亟待开发新的、有效的分子靶向药物治疗胰腺癌。
目前为止,TCTP 已被证明在肝癌、结直肠癌中发挥重要作用,本研究结果发现,TCTP在胰腺癌组织和胰腺癌细胞株中异常高表达,而在正常的胰腺导管上皮细胞中不表达。因此,我们推测TCTP在胰腺癌中也发挥着重要的作用。
TCTP在肿瘤的发生,细胞增殖和凋亡的调节,应激反应,基因调节,热休克反应,甚至是免疫反应方面发挥着一系列重要的生物学作用[14,15]。在HeLa 细胞中过表达 TCTP能够部分抑制 Na-K-ATPase的活性使EGFR的磷酸化增强,激活Ras/Raf/ERK信号通路;同时可以激活PI3K/Akt 信号通路和使 PLC 的磷酸化增强。这些信号通路对细胞的生长和增殖具有很重要的调控作用[16]。Chfr是一个细胞周期检验点蛋白,在细胞周期进程和肿瘤抑制上起着重要的作用,TCTP在体内能与 Chfr 相互作用,通过调节Chfr的稳定性调节细胞周期进程[17]。利用 RNAi下调TCTP的表达,明显减少细胞的数量,而不影响细胞的大小,说明细胞有丝分裂明显变慢。进一步研究显示,下调TCTP 的表达使细胞周期 G1期明显延长,而G2/M 期的标志蛋白 cyclin A1和cyclin B1 的表达明显降低和延迟[18]。除此之外,TCTP还能和微管蛋白结合,参与细胞的有丝分裂过程[19]。因此,TCTP对细胞的周期调控起着非常重要的作用。过表达TCTP能够抑制依托泊苷(etoposide)诱导的细胞凋亡;干扰 TCTP 可以诱导细胞凋亡[3,20]。在细胞内 TCTP能与抗凋亡蛋白Mcl1相互作用,通过抑制MCL-1的泛素化降解增强MCL-1的稳定性,从而发挥抗凋亡作用[4]。最近的研究也证实了TCTP能够与TSC-22和p53 相互作用,促进TSC-22和p53的降解,从而抑制由TSC-22和p53介导的细胞凋亡[21-22]。我们的研究结果显示,沉默胰腺癌细胞中内源性TCTP蛋白表达,显著抑制细胞增殖,阻止细胞周期进程,增加细胞凋亡。
Bcl-xL是Bcl-2家族的重要成员,是一类具有抗凋亡作用的蛋白,在维持细胞生存中起关键作用。有报道显示,在T细胞激活过程中,TCTP蛋白与Bcl-xL蛋白同时表达上调;而且通过反义核酸技术降低T细胞中的TCTP时,T细胞的凋亡显著增加。此外,TCTP蛋白的N末端是TCTP与Bcl-xL相互结合和发挥抗凋亡作用必不可少的[23]。本研究结果发现,TCTP异常高表达的胰腺癌细胞株中,Bcl-xL也呈高表达状态。沉默PCI55和MiaPaca-2胰腺癌细胞中的TCTP蛋白,可下调Bcl-xL蛋白表达,进而促进细胞凋亡,抑制细胞增殖。说明在胰腺癌细胞中异常高表达的TCTP通过上调Bcl-xL表达发挥抗凋亡作用,从而促进胰腺癌的发生、发展。
综上所述,本研究结果证实,在胰腺癌中存在一条新的抗凋亡途径TCTP-Bcl-xL,并且在胰腺癌发生、发展中发挥着重要的调控作用。通过靶向分子阻断TCTP-Bcl-xL途径,可能为临床治疗胰腺癌提供新的思路。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] HOCHSTER H S, HALLER D G, DE GRAMONT A, et al. Consensus report of the international society of gastrointestinal oncology on therapeutic progress in advanced pancreatic cancer [J]. Cancer, 2006, 107(4): 676-685.
[3] LI F, ZHANG D, FUJISE K. Characterization of fortilin, a novel antiapoptotic protein[J]. J Biol Chem, 2001, 276(50): 47542-47549.
[4] LIU H, PENG H W, CHENG Y S, et al. Stabilization and enhancement of the antiapoptotic activity of mcl-1 by TCTP[J]. Mol Cell Biol, 2005, 25(8): 3117-3126.
[5] BOHM H, BENNDORF R, GAESTEL M, et al. The growthrelated protein P23 of the Ehrlich ascites tumor: translational control, cloning and primary structure [J]. Biochem Int, 1989, 19(2): 277-286.
[6] GROSS B, GAESTEL M, BOHM H, et al. cDNA sequence coding for a translationally controlled human tumor protein[J]. Nucleic Acids Res, 1989, 17(20): 8367.
[7] CHITPATIMA S T, MAKRIDES S, BANDYOPADHYAY R, et al. Nucleotide sequence of a major messenger RNA for a 21 kilodalton polypeptide that is under translational control in mouse tumor cells [J]. Nucleic Acids Res, 1988, 16(5): 2350.
[8] THOMAS G, THOMAS G, LUTHER H. Transcriptional and translational control of cytoplasmic proteins after serum stimulation of quiescent Swiss 3T3 cells [J]. Proc Natl Acad Sci U S A,1981, 78(9): 5712-5716.
[9] MACDONALD S M, PAZNEKAS W A, JABS E W. Chromosomal localization of tumor protein, translationallycontrolled 1 (TPT1) encoding the human histamine releasing factor (HRF) to 13q12-->q14 [J]. Cytogenet Cell Genet, 1999, 84(1-2): 128-129.
[10] THIELE H, BERGER M, LENZNER C, et al. Structure of the promoter and complete sequence of the gene coding for the rabbit translationally controlled tumor protein (TCTP) P23[J]. Eur J Biochem, 1998, 257(1): 62-68.
[11] TUYNDER M, SUSINI L, PRIEUR S, et al. Biological models and genes of tumor reversion: cellular reprogramming through tpt1/TCTP and SIAH-1 [J]. Proc Natl Acad Sci U S A, 2002, 99(23): 14976-14981.
[12] CHAN T H, CHEN L, LIU M, et al. Translationally controlled tumor protein induces mitotic defects and chromosome missegregation in hepatocellular carcinoma development[J]. Hepatology, 2012, 55(2): 491-505.
[13] CHUNG S, KIM M, CHOI W, et al. Expression of translationally controlled tumor protein mRNA in human colon cancer [J]. Cancer Lett, 2000, 156(2): 185-190.
[14] KOZIOL M J, GURDON J B. TCTP in development and cancer[J]. Biochem Res Int, 2012, 2012: 105203.
[15] MACDONALD S M, RAFNAR T, LANGDON J, et al. Molecular identification of an IgE-dependent histaminereleasing factor [J]. Science, 1995, 269(5224): 688-690.
[16] KIM M, JUNG J, LEE K. Roles of ERK, PI3 kinase, and PLC-gamma pathways induced by overexpression of translationally controlled tumor protein in HeLa cells [J]. Arch Biochem Biophys, 2009, 485(1): 82-87.
[17] BURGESS A, LABBE J C, VIGNERON S, et al. Chfr interacts and colocalizes with TCTP to the mitotic spindle [J]. Oncogene, 2008, 27(42): 5554-5566.
[18] BRIOUDES F, THIERRY A M, CHAMBRIER P, et al. Translationally controlled tumor protein is a conserved mitotic growth integrator in animals and plants [J]. Proc Natl Acad Sci U S A, 2010, 107(37): 16384-16389.
[19] GACHET Y, TOURNIER S, LEE M, et al. The growthrelated, translationally controlled protein P23 has properties of a tubulin binding protein and associates transiently with microtubules during the cell cycle [J]. J Cell Sci, 1999, 112 ( Pt 8): 1257-1271.
[20] ZHANG D, LI F, WEIDNER D, et al. Physical and functional interaction between myeloid cell leukemia 1 protein (MCL1) and Fortilin. The potential role of MCL1 as a fortilin chaperone[J]. J Biol Chem, 2002, 277(40): 37430-37438.
[21] AMSON R, PECE S, LESPAGNOL A, et al. Reciprocal repression between P53 and TCTP [J]. Nat Med, 2012, 18(1): 91-99.
[22] LEE J H, RHO S B, PARK S Y, et al. Interaction between fortilin and transforming growth factor-beta stimulated clone-22 (TSC-22) prevents apoptosis via the destabilization of TSC-22[J]. FEBS Lett, 2008, 582(8): 1210-1218.
[23] YANG Y, YANG F, XIONG Z, et al. An N-terminal region of translationally controlled tumor protein is required for its antiapoptotic activity [J]. Oncogene, 2005, 24(30): 4778-4788.
Aberrant expression of TCTP protein inhibits cell apoptosis by up-regulating Bcl-xL in human pancreatic cancer
ZHANG Fei1, WANG Zhen1, ZHANG Ping1, ZHANG Bo2, YANG Wen-tao3, LI Yingyi1(1.Cancer Research Institute; 2.Department of Pancreas and Hepatobiliary, Pancreatic Cancer Institute; 3.Department of Pathology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LI Ying-yi E-mail: liyingyi@fudan.edu.cn
Background and purpose: Translationally controlled tumor protein (TCTP) is a growth-related protein, and involves in promoting cell proliferation and inhibiting cell apoptosis. A lot of evidence shows there is an overexpression of TCTP in liver cancer, colon cancer and other gastrointestinal tumors. However there is no any evidence about TCTP in pancreatic cancer. The present study aimed to investigate the role and mechanism of TCTP in pancreatic carcinogenesis to find new molecular targets and to provide a basis for targeted therapy of pancreatic cancer. Methods: Immunohistochemistry, Western immunoblot analysis, RT-PCR, immunofluorescence analysis, siRNA transfection, cell counting kit 8 (CCK-8) assays, cell cycle and cell apoptosis analysis were used. Results: TCTP was overexpressed in pancreatic cancer tissues and cancer cells. Moreover, silencing TCTP expression by siRNA arrested cell cycle progression, promoted cell apoptosis and eventually inhibited cell proliferation. Furthermore, Bcl-xL protein expression was positively correlatived with TCTP expression in pancreatic cancer cells, and silencing TCTP downregulated Bcl-xL expression. Conclusion: TCTP is overexpressed in human pancreatic cancer, which upregulates Bcl-xL to inhibit cell apoptosis, and eventually promotes pancreatic carcinogenesis.
TCTP; Pancreatic cancer; Bcl-xL; siRNA
10.3969/j.issn.1007-3969.2013.05.001
R735.9
:A
:1007-3639(2013)05-0321-07
2013-03-13
2013-05-16)
国家自然科学基金面上项目(No:30973476,812727);上海市浦江人才计划(No:10PJ1402100);复旦大学“985工程”三期肿瘤研究项目Ⅱ(No:985Ⅲ-YFX0102)。
李影奕 E-mail:liyingyi@fudan.edu.cn

