MicroRNA-31在食管鳞状细胞癌中的表达及其与预后的关系
浙江省肿瘤医院,浙江省肿瘤研究所,
浙江省胸部肿瘤(肺、食管)诊治技术研究重点实验室,浙江 杭州310022
MicroRNA-31在食管鳞状细胞癌中的表达及其与预后的关系
罗君 凌志强 彭兵锋 袁嘉敏 郑智国 毛伟敏
浙江省肿瘤医院,浙江省肿瘤研究所,
浙江省胸部肿瘤(肺、食管)诊治技术研究重点实验室,浙江 杭州310022
背景与目的:研究发现,许多微小RNA(microRNAs,miRNAs)与恶性肿瘤密切相关,其中miR-31(microRNA-31)在许多肿瘤中呈异常改变。中国是食管鳞状上皮细胞癌(esophageal squamous cell carcinoma,ESCC)最高发的地区之一。本研究旨在调查miR-31在ESCC中的表达水平与临床病理学因素以及预后的关系。方法:采用实时反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RTPCR)技术检测食管癌细胞株KYSE410、EC1和EC9706,以及81例ESCC组织和癌旁正常组织中miR-31的表达水平。结果与临床资料和随访结果结合作统计分析。结果:在3株ESCC细胞株以及75.31%的ESCC组织中,miR-31表达上调。并且miR-31的高表达与更严重的淋巴结转移(P=0.043)、更深的浸润深度(P=0.002)以及更晚期的病理分期有关(P=0.027),而与其他临床病理学因素无关(P>0.05)。此外,miR-31的高表达与较差的无进展生存期(progression-free survival,PFS)有关(Kaplan-Meier分析P=0.014,多变量Cox分析P=0.021)。结论:miR-31可能是ESCC一项新的诊断和预后评价指标。
食管鳞状细胞癌;miR-31;临床病理学;生存期
食管癌是常见的消化道肿瘤,其发生率排在全世界恶性肿瘤的第七位,病死率居第六位[1]。中国是食管癌高发区,每年全球50%的食管癌发生在中国,而其中约90%是食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)。大部分ESCC直到疾病的晚期症状都不明显,因此此类患者往往诊断晚、预后差、死亡率高。人们亟需找到能够在病变早期被特异性识别的分子标志,以有效地帮助早期诊断和判断预后,但目前对这种“完美”的分子标志的探索尚未成功[2]。
微小RNA(micro-RNA,miRNA)是一类长约21~25个核苷酸的高度保守的非编码单链小分子RNA,由相应的基因编码,转录加工形成,通过调控靶基因的表达,产生转录后基因沉默(post-transcriptional gene silencing)。miRNA在细胞增殖、凋亡、发展和分化中起重要的调控作用,并与肿瘤的发病和进展关系密切。而在业已发现的众多miRNA中,miR-31被认为是调控肿瘤恶性生物学行为的重要基因之一[3]。本研究应用实时RT-PCR技术,分别检测ESCC细胞株及手术切除标本中miR-31的表达水平,并结合临床病理资料及生存分析,探讨miR-31在ESCC发生、发展及预后中的潜在作用。
1 材料和方法
1.1 材料
人食管癌细胞株KYSE410、EC1及EC9706为本所保存,正常食管上皮细胞采用癌旁正常组织中分离的细胞原代培养72 h获得。本实验采用81例ESCC组织及相应癌旁正常组织,均来自于2009年2月—2010年9月浙江省肿瘤医院食管癌手术后组织标本,均经病理诊断为鳞状细胞癌,标本的使用得到医院伦理委员会批准。其中51例标本手术切除后立即取材,癌组织取自手术切除标本中肉眼观察的肿瘤组织,癌旁正常组织标本取自距肿瘤边缘至少5 cm处的肉眼下无瘤组织。另30例标本于手术切除后快速液氮冷冻储存,后经显微病理切割手工分类。所有肿瘤及正常组织标本收集后储存于-80 ℃冰箱中以备RNA提取。肿瘤分级、TNM分期按照国际抗癌联盟(international union against cancer,UICC)2009年第七版食管癌分期标准:其中高、中分化65例,低分化16例;Ⅰ、Ⅱ期34例,Ⅲ、Ⅳ期47例;伴有淋巴结转移50例,无淋巴结转移31例。81例肿瘤患者中,男性70例,女性11例,年龄40~74岁,平均59.7岁,其中≥60岁41例,<60岁40例。术前均未接受化疗或放疗。电话随访截止2011年10月10日,其中失访5例(6.17%),失访者在生存分析中以最后有效随访日期作为截尾值处理。
细胞培养用RPMI-1640培养基、胎牛血清均购自Gibco公司。RNA提取试剂盒miRNeasy迷你试剂盒(编码:130171813)购于Qiagen公司,琼脂糖、0.5% TBE液、EB液、逆转录试剂盒PrimeScript®miRNA cDNA 合成试剂盒 (编码:D350A)和real time RT-PCR试剂盒SYBR®Premix Ex Taq™Ⅱ (编码:DRR081A)购于TaKaRa公司。引物由上海Invitrogen公司合成。实时RT-PCR上游引物序列:mir-31:5’-AGGCAAGATGCTGGCATAGCT-3’,内参基因RNU6B(U6 small nuclear RNA):5’-CGCTTCGGCAGCACATATAC-3’,下游通用引物由逆转录试剂盒PrimeScript®miRNA cDNA合成试剂盒提供。
1.2 细胞培养
3株食管癌细胞培养于含15%胎牛血清、青霉素100 mg/L、链霉素100 mg/L的RPMI-1640培养液中,细胞置于37 ℃、CO2体积分数为5%的培养箱中培养,每隔2~3 d传代1次,取指数生长期细胞用于试验。
1.3 总RNA提取
按照miRNeasy迷你试剂盒的说明书提取肿瘤细胞及组织中的总RNA,紫外分光光度计测量,判定所取总RNA的浓度和纯度,要求光密度值A260/A280>1.8。取1 µL RNA溶液与1.5%的变性琼脂糖凝胶中进行电泳,测定RNA的完整性。
1.4 逆转录
取1 µg总RNA使用PrimeScript®miRNA cDNA合成试剂盒进行cDNA的合成,具体操作参照使用说明。
1.5 PCR扩增
实时RT-PCR的PCR扩增及熔解曲线分析均使用ABI 7500PCR仪(Applied Biosystems),采用20 µL的反应体系,每个样本重复3次,求平均Ct值作为实验结果。具体操作参照SYBR®Premix Ex Taq™Ⅱ的使用说明。反应过程具体为:50 ℃激活聚合酶2 min,95 ℃预变性1 min;95 ℃变性5 s,60 ℃退火和延伸34 s,扩增40个循环。结束后通过95 ℃15 s,60 ℃ 1 min,85 ℃ 15 s,60 ℃ 15 s制作熔解曲线。RT-PCR结果按照2-ΔΔCT法[4]进行处理:首先获取每个样本中miR-31及内参基因RNU6B的Ct值,计算ΔCT=Ct(miR-31)-Ct(U6);再根据ΔΔCT=ΔCT(肿瘤组织/细胞)-ΔCT(癌旁正常组织/细胞),进一步计算mir-31在肿瘤组织与癌旁正常组织之间表达倍数的差异:若ΔΔCT<0,则表达升高2-ΔΔCT倍;若ΔΔCT≥0,则表达降低2ΔΔCT倍。
1.6 统计学处理
应用SPSS 17.0统计学软件,各组间miR-31表达倍数均值的差异采用独立样本t检验分析,生存曲线绘制用乘积极限法(Kaplan-Meier)进行单因素生存分析,对数秩检验(Log-Rank test)进行生存曲线比较,多因素分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-31在ESCC中的表达与临床病理学参数的关系
在81例ESCC标本中,61例(75.31%)出现了相对于癌旁正常食管组织的不同程度的miR-31表达上调,20例(24.69%)表现出miR-31的表达下调。其中最高的表达上调489.85倍,最低的表达下调28.70倍,平均表达上调29.58倍。57例(70.37%)癌组织中的miR-31表达高于癌旁正常组织2倍以上(图1)。3株食管癌细胞株与正常食管上皮细胞相比,miR-31均出现了明显上调,其中在KYSE410中高表达110.59倍、在EC1中高表达77.05倍,而在EC9706中高表达51.92倍(图2)。将miR-31在癌和(或)癌旁正常组织中的差异性表达倍数与临床病理参数比较。结果发现miR-31在肿瘤中的高表达与浸润深度、淋巴结转移及病理分期有关:浸润深度超过肌层的食管癌组织相比未超过肌层的食管癌组织,miR-31的表达提高约27倍(P=0.002);有淋巴结转移的癌组织相比无淋巴结转移的癌组织,miR-31的表达提高约4倍(P=0.043);而miR-31在Ⅲ、Ⅳ期食管癌组织中较Ⅰ、Ⅱ期表达提高约5倍(P=0.027)。另外,miR-31的表达水平与性别、年龄、肿瘤长径、是否存在神经浸润以及分化程度差异无统计学意义(P>0.05,表1)。结合流行病学资料分析,miR-31与吸烟、饮酒及肿瘤家族史亦无统计学意义(P>0.05)。
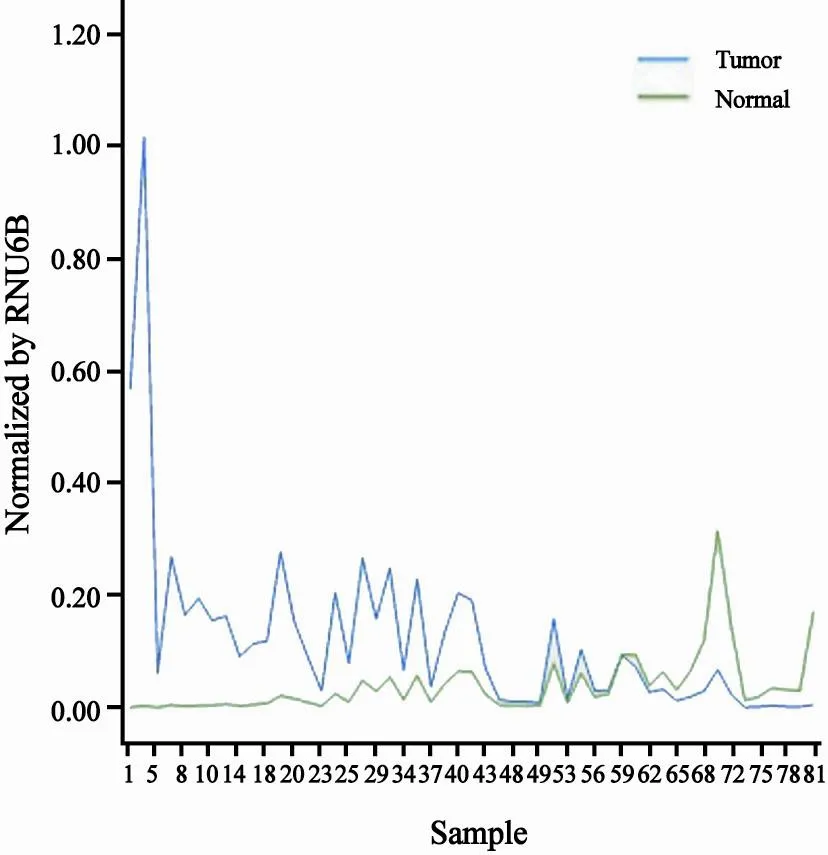
图 1 miR-31在ESCC组织/正常组织中的表达水平(n=81)Fig. 1 Level of miR-31 in ESCC tissue compared to normal tissue (n=81)
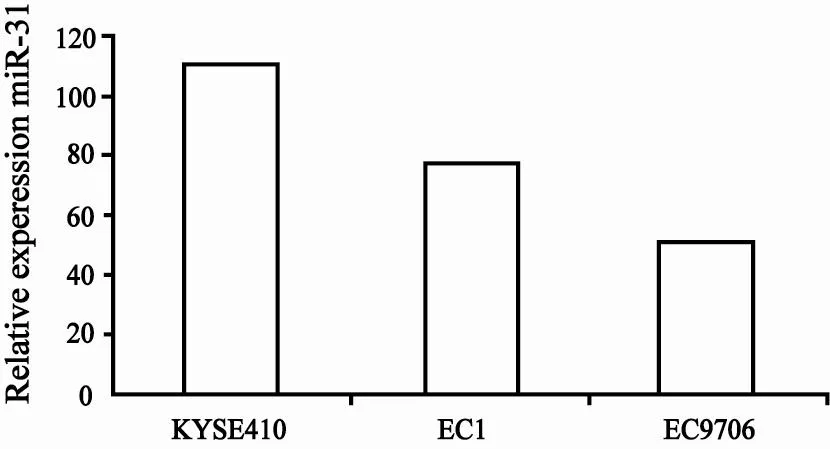
图 2 miR-31在ESCC细胞株KYSE410、EC1、EC9706中的表达水平Fig. 2 Relative expression level of miR-31 in ESCC cell lines (KYSE410, EC1 and EC9706) compared to normal esophageal epithelial cells
2.2 miR-31在ESCC中的表达与预后的关系
以miR-31在ESCC组织中表达提高是否超过2倍为标准,将所有患者分为miR-31高表达组及miR-31未高表达组。两组间在性别、年龄、吸烟史、饮酒史及家族史等因素方面差异无统计学意义(P>0.05)。根据电话随访结果,以复发、转移或死亡代表肿瘤进展事件,分别统计两组的无进展生存期(progression-free survival,PFS)。Kaplan-Meier分析提示,miR-31高表达组的平均PFS为(16.30±1.39)个月,而miR-31未高表达组为(20.30±1.27)个月,差异有统计学意义(χ2=6.031,P=0.014,图3),说明miR-31表达未超过2倍者有显著的无进展生存优势。进一步行Cox回归分析显示,miR-31表达未超过2倍者有独立的无进展生存优势(RR=2.546,95%CI:1.154~5.614,P=0.021),而年龄、性别、侵润深度、淋巴结是否转移、病理分期等却均与患者预期PFS无显著相关性(P>0.05)。
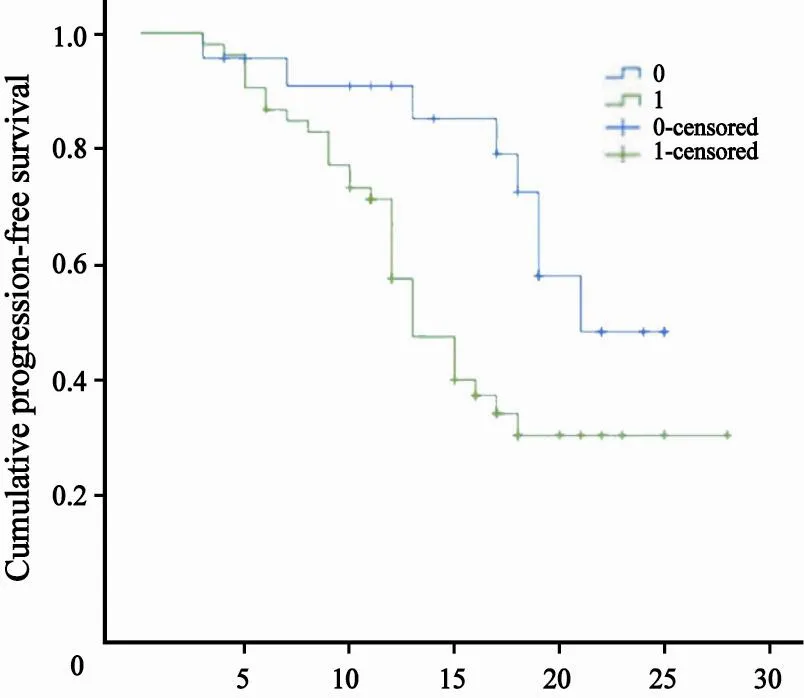
图 3 不同miR-31表达水平的ESCC患者的PFSFig. 3 The progression free survival (PFS) curves according to different miR-31 expression levels in ESCC
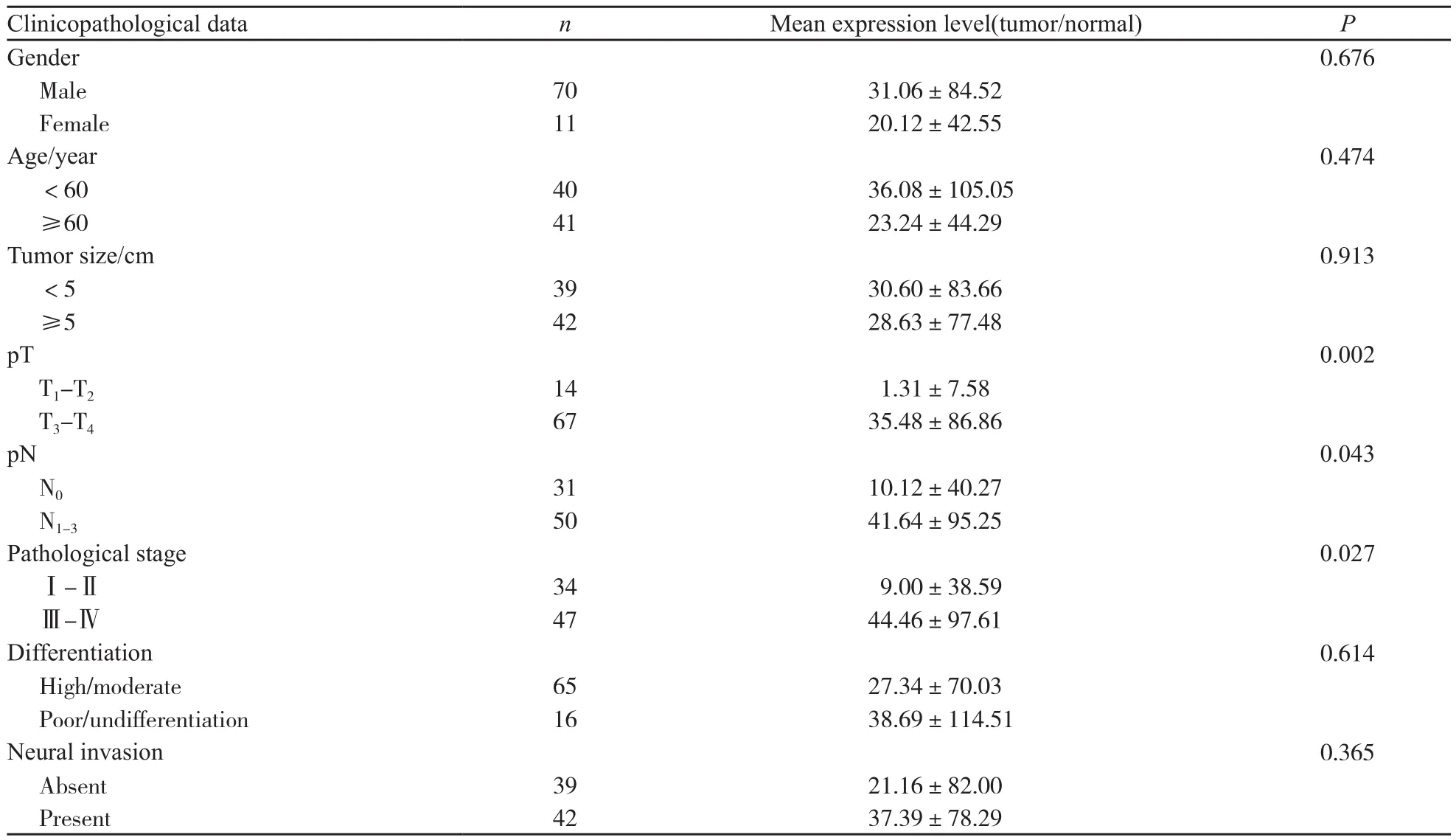
表 1 miR-31在食管鳞癌组织中的异常表达与临床病理参数的关系Tab. 1 Relationship of miR-31’s abnormal expression and clinicopathological factors in ESCC tissues
3 讨 论
许多研究表明,miRNA在调节肿瘤相关基因表达的同时,其本身也具有癌基因或抑癌基因的特点。其中某些miRNA,如miR-21在大多数肿瘤中呈现高水平表达,并充当癌基因的角色[5]。而miR-31却在不同的肿瘤中存在不同水平的表达。Valastyan等[6]发现miR-31能介导乳腺癌肺部转移灶荷瘤的减小,抑制其表达能提高乳腺癌细胞的活动性、侵袭性及抗凋亡能力。因此研究者认为miR-31在乳腺癌中是一种降低转移发生率的抑癌基因。而miR-31在结肠癌中表达的提高却促进了肿瘤侵袭性[7],因此又被认为具有癌基因特点。
miR-31在不同肿瘤中存在截然不同的表达,这一看似矛盾现象在许多相关实验中均有报道。例如miR-31在结直肠癌[8]、肺癌[9]及口腔癌[10]中一般处于高表达水平,而在胃癌[11]、乳腺癌[12]及卵巢癌[13]中则显著低表达。即便同是食管癌中,miR-31在腺癌和鳞癌的表达水平也不尽相同。Leidner等[14]研究Barrett化生与食管腺癌演进关系时发现,miR-31在腺癌和高级别异型增生组织中的表达较Barrett食管中明显下调,因此推断miR-31可能具有抑制食管腺癌发生的作用。而本研究却在食管鳞癌中发现miR-31较正常组织表达上调,因此推测其可能具有促进肿瘤发生的作用。可以看出,miR-31并非在所有肿瘤中都呈现高表达或低表达状态。在鳞状细胞癌中,miR-31大都为高表达,而在泌尿生殖系统肿瘤中往往呈低表达。上述现象提示人们不能排除该基因存在组织特异性的可能[15]。若此假想成立,其原因可能是因为所有类型的细胞都具有分泌和接受miRNA的能力,同一细胞可分泌多种miRNA,而一种miRNA则能调节多个基因的翻译。因此miR-31的信号传递方式可以是双向或多向的,这与传统的细胞间信号单向传递不同。在某特定肿瘤组织中,若miR-31调控的抑癌因素占主要地位,则miR-31展现出抑癌倾向;反之则展现出促癌倾向。对于本身不编码蛋白的miRNA来说,其靶基因的性质往往决定了其组织特异性。
本研究中的81例ESCC手术切除标本中,57例(70.37%)癌组织miR-31的表达高于正常组织2倍以上,在3株食管癌细胞中的表达更是上调超过50倍。这一数据与Zhang等[16]的报道较为符合(30/45,66.7%),进一步验证了miR-31在ESCC中特异性表达升高,有癌基因倾向。另外发现:肿瘤浸润越深,miR-31表达越高(P=0.002);病理分期越晚,miR-31表达越高(P=0.027);在有淋巴结转移的癌组织中,miR-21表达比无淋巴结转移的癌组织中更高(P=0.043)。TNM分期是公认的评估肿瘤进展、转移情况以及预测预后的指标,因此miR-31可能也具有一定的评估及预测作用。Zhang等[16]报道了miR-31与临床病理学因素的关系,揭示miR-31在晚期肿瘤患者中表达更高。相比而言,本研究除病理分期和淋巴结转移以外,还发现了miR-31与侵润深度的关系,进一步提示miR-31可能对ESCC的侵袭及转移具有促进作用。Wang等[17]报道在结直肠癌中也存在miR-31表达提高,并且其高表达与TNM分期及浸润深度呈正相关,这一现象与ESCC中相似。而另一些恶性肿瘤中则可见与本实验不同的结果,Zhang等[18]在胃癌中发现miR-31表达明显下调,虽差异无统计学意义(P>0.05),但仍可看出其下调与TNM因素呈一定的负相关。miRNA调控作为一种表观遗传学现象,是否受到环境因素的影响,导致其靶基因发生致瘤性的改变。Xi等[19]发现,香烟烟雾冷凝液可诱导正常呼吸道上皮及肺癌组织中的miR-31表达提高,增加肺癌细胞的增殖性和致瘤性,因此认为miR-31与吸烟史以及肺癌的发生相关。但在本研究中miR-31与吸烟、饮酒及肿瘤家族史并无明显相关性(P>0.05)。
有关miR-31的异常表达与肿瘤患者生存期的关系,不同的肿瘤研究结果不同。在乳腺癌中miR-31的高表达可提高患者生存时间[6];而本研究中,高表达的miR-31不但与较差的PFS显著相关,而且还超过了浸润深度、淋巴结转移及病理分期等因素对PFS的影响,成为ESCC独立的危险因素。相比其他研究中针对总生存期进行统计分析,本研究着眼于PFS,能更为客观地评判肿瘤相关生存水平。
综上所述,miR-31的表达上调在ESCC中是一高频分子事件,与患者的淋巴结转移、浸润深度、病理分期及不良预后显著相关,提示miR-31可作为ESCC早期诊断及评估预后的候选指标之一。相信随着表观遗传学研究的不断深入,有关miR-31以及更多肿瘤相关性miRNA的分子机制及临床价值会被人们进一步了解。
[1] PARKIN D M, BRAY F, FERLAY J, et al. Global cancer statistics, 2002 [J]. CA Cancer J Clin, 2005, 55(2): 74-108.
[2] FAREED K R, KAYE P, SOOMRO I N, et al. Biomarkers of response to therapy in oesophago-gastric cancer [J].Gut, 2009, 58(1): 127-143.
[3] VALASTYAN S, WEINBERG R A. miR-31: a crucial overseer of tumor metastasis and other emerging roles[J]. Cell Cycle, 2010, 9(11): 2124-2129.
[4] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J]. Methods, 2001, 25(4): 402-408.
[5] PAN X, WANG Z X, WANG R. MicroRNA-21: a novel therapeutic target in human cancer [J].Cancer Biol Ther, 2011, 10(12): 1224-1232.
[6] VALASTYAN S, CHANG A, BENAICH N, et al. Activation of miR-31 function in already-established metastases elicits metastatic regression [J]. Genes Dev, 2011, 25(6): 646-659.
[7] COTTONHAM C L, KANEKO S, XU L. miR-21 and miR-31 converge on TIAM1 to regulate migration and invasion of colon carcinoma cells [J]. J Biol Chem, 2010, 285(46): 35293-35302.
[8] SLABY O, SVOBODA M, FABIAN P, et al. Altered expression of miR-21, miR-31, miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer [J]. Oncology, 2007, 72(5-6): 397-402.
[9] LIU X, SEMPERE L F, OUYANG H, et al. MicroRNA-31 functions as an oncogenic microRNA in mouse and human lung cancer cells by repressing specific tumor suppressors[J]. J Clin Invest, 2010, 120(4): 1298-1309.
[10] LIU C J, KAO S Y, TU H F, et al. Increase of microRNA miR-31 level in plasma could be a potential marker of oral cancer[J]. Oral Dis, 2010, 16(4): 360-364.
[11] ZHANG Y, GUO J, LI D, et al. Down-regulation of miR-31 expression in gastric cancer tissues and its clinical significance [J]. Med Oncol, 2010, 27(3): 685-689.
[12] YAN L X, HUANG X F, SHAO Q, et al. MicroRNA miR-21 overexpression in human breast cancer is associated with advanced clinical stage, lymph node metastasis and patient poor prognosis [J]. RNA, 2008, 14(11): 2348-2360.
[13] CREIGHTON C J, FOUNTAIN M D, YU Z, et al. Molecular profiling uncovers a p53-associated role for microRNA-31 in inhibiting the proliferation of serous ovarian carcinomas and other cancers [J]. Cancer Res, 2010, 70(5): 1906-1915.
[14] LEIDNER R S, RAVI L, LEAHY P, et al. The microRNAs, MiR-31 and MiR-375, as candidate markers in Barrett's esophageal carcinogenesis [J]. Genes Chromosomes Cancer, 2012, 51(5): 473-479.
[15] VALASTYAN S, WEINBERG R A. miR-31: a crucial overseer of tumor metastasis and other emerging roles [J]. Cell Cycle, 2010, 9(11): 2124-2129.
[16] ZHANG T, WANG Q, ZHAO D, et al. The oncogenetic role of microRNA-31 as a potential biomarker in oesophageal squamous cell carcinoma [J]. Clin Sci (Lond), 2011, 121(10): 437-447.
[17] WANG C J, ZHOU Z G, WANG L, et al. Clinicopathological significance of microRNA-31, -143 and -145 expression in colorectal cancer [J]. Dis Markers, 2009, 26(1): 27-34.
[18] ZHANG Y, GUO J, LI D, et al. Down-regulation of miR-31 expression in gastric cancer tissues and its clinical significance [J]. Med Oncol, 2010, 27(3): 685-689.
[19] XI S, YANG M, TAO Y, et al. Cigarette smoke induces C/ EBP-β-mediated activation of miR-31 in normal human respiratory epithelia and lung cancer cells [J]. PLoS One, 2010, 5(10): e13764.
The expression of microRNA-31 in esophageal squamous cell carcinoma and its prognostic value
LUO Jun, LING Zhi-qiang, PENG Bing-feng, YUAN Jia-min, ZHENG Zhi-guo, MAO Wei-min (Zhejiang Province Cancer Hospital, Zhejiang Cancer Research Institure, Zhejiang Key Laboratory of the Diagnosis and Treatment Technology on Thoracic Oncology, Hangzhou Zhejiang 310022, China)
LING Zhi-qiang E-mail: lingzq@hotmail.com
Background and purpose: It was reported that many microRNAs (miRNAs) have close relation with carcinomas. miR-31 (microRNA-31) shows abnormal change in numerous cancers. China is one of the most high-risk areas of esophageal squamous cell carcinoma (ESCC). The aim of the present study was to investigate the expression of miR-31 in ESCC, and analyze the relationship of its expression with clinicopathological features and prognosis. Methods: The expression of miR-31 in KYSE410, EC1 and EC9706 cell lines, as well as 81 cases of ESCC tissues and adjacent normal esophageal tissues were detected by real-time reverse transcription-polymerase chain reaction (RT-PCR). The result was combined with clinical and follow-up data and statistical analysis was conducted. Results: MiR-31 was up-expression in 3 cell lines and 75.31% of the ESCC tissues. miR-31 up-expression was positively related to severer lymph node metastasis (P=0.043), deeper invasion of tumors (P=0.002) and advanced pathological stage (P=0.027). There was no relationship of miR-31 with other clinicopathological features (P>0.05). Furthermore, high expression of miR-31 was associated with poor progression-free survival (PFS) in 81 ESCC patients by Kaplan-Meier analysis (P=0.014) and by multivariate Cox analysis (P=0.021). Conclusion: Our results identified miR-31 may be a new diagnostic criteria and prognostic biomarker for ESCC.
Esophageal squamous cell carcinoma; miR-31; Clinicopathology; Survival
10.3969/j.issn.1007-3969.2013.07.002
R735.1
:A
:1007-3639(2013)07-0487-06
2013-02-25
2013-04-25)
卫生部科研基金(No:WKJ2010-2-004);浙江省自然基金项目(No:Y2091110)。
凌志强 E-mail:lingzq@hotmail.com

