+Gz暴露对大鼠胃黏膜损伤及胃液表皮生长因子含量的影响
范 勤,陈 英,杜 斌,韩全利,杨春敏
1.安徽医科大学中国人民解放军空军总医院临床学院,北京100142;2.中国人民解放军空军总医院东楼消化科
正加速度(+Gz)对飞行员的影响及防护是航空航天医学研究的重要课题。随着高性能战斗机装备部队,航天员的选拔,飞行中高+Gz值、高+Gz值增长率暴露以及离心机高+Gz值训练对飞行员的不良影响及其防护再次受到航空航天医学工作者的重视。目前已有许多研究资料显示,加速度+Gz对机体的神经、肌肉、心血管、免疫等[1-5]系统有着很大的影响。胃黏膜损伤是多种细胞和分子相互作用的复杂过程,EGF是胃、十二指肠黏膜损伤愈合过程中起着重要作用的一种保护性因子,有报道称+Gz值暴露对胃十二指肠黏膜造成损伤[6-7]。但针对加速度+Gz对急性胃黏膜病变影响机制的研究更是鲜见报道。因此,本实验通过建立不同的加速度值暴露模型,探讨+Gz暴露对大鼠胃液表皮生长因子(EGF)含量的影响;探讨模拟+Gz暴露对胃黏膜造成的影响及其可能机制,为飞行员胃肠疾病的防治提供更可靠的依据。
1 材料与方法
1.1 材料 健康Wistar大鼠40只,SPF级,体质量260~300 g,购买于北京斯贝福实验动物技术有限公司。大鼠由航天医学工程研究所动物房饲养,模拟加速度动物离心机(由航天医学工程研究所提供)动物手术器械,游标卡尺,EGF放射免疫分析盒购自南京建成生物工程研究所,仪器购自:日本日立7160全自动生化仪。9 g/L氯化钠注射液,购自湖南康元制药有限公司,生产批号10070902B 05;碘伏消毒液,购自北京四环卫生药械厂有限公司,生产批号20110605。戊巴比妥钠,购自sigma公司,生产批号P4281;庆大霉素,购自广州白云山天心。制药股份有限公司,批号110128;40%甲醛溶液,购自北京益利精细化学品有限公司,生产批号20110823。
1.2 方法
1.2.1 分组:Wistar大鼠40只,大鼠禁食24 h后随机分为4组:对照组 +1 Gz值(n=10)、+5 Gz值(n=10)、+10 Gz值组(n=10)、重复暴露组(n=10)。适应性饲养7 d后开始实验,每组大鼠均单笼饲养,自由饮食及水,动物室室温维持在(23±2)℃,12 h循环光照。
1.2.2 大鼠模拟加速度模型制备:Wistar大鼠40只,大鼠禁食24 h后随机分为4组。+Gz暴露方式采用动物离心机模拟+Gz暴露。利用特制的有固定盒承载大鼠,固定于动物离心机(航天医学工程研究所提供)上。离心机半径为1.9 m。大鼠上机前每只大鼠专用1个固定盒,保证加速度作用的方向。大鼠头朝向离心机轴心,仰面固定于离心机转臂远端,每组10只同时上机。采用梯形+Gz作用曲线,G值增长率1 G/s,由计算机进行加速度程序控制。对照组+1 Gz值暴露5 min,+5 Gz值组、+10 Gz值组持续时间暴露5 min。连续暴露组:暴露于+5 Gz 1.5 min,+10 Gz 2 min,+5 Gz 1.5 min。对照组(+1 Gz暴露)大鼠也在动物离心机上经历类似实验步骤[6]。
1.2.3 标本处理:每实验组大鼠下离心机后2%戊巴比妥钠2.3 ml/kg腹腔麻醉,解剖大鼠结扎贲门和幽门,取出胃。将全部胃液抽出,收集胃液。取出胃液后,沿胃大弯侧剪开,用生理盐水冲洗,滤纸吸干,平铺于载玻片上。黏膜损伤的程度以黏膜损伤指数表示,计分参考Guth等[8]的标准。正常胃黏膜为0分,点状损伤计1分,病损<1 mm计2分,1~2 mm计3分,2~3 mm计4分,依次类推,损伤宽度>2 mm,损伤指数计分加倍。即得到大鼠黏膜损伤指数。
1.2.4 胃液EGF含量的测定:将全部胃液抽出,收集胃液,低温离心机4℃ 12 000 r/min离心15 min,留取上清胃液,置EP管中,于-80℃冰箱内保存,采用放免法测定EGF含量,操作步骤严格按放免试剂盒说明书进行[9]。
1.3 统计学分析 应用SPSS 17.0统计软件处理,计量资料以均数±标准差(±s)表示。计量资料组间比较采用t检验,计数资料多组间比较采用One-Way ANOVA方法进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 胃黏膜大体观察 对照组、+5 Gz组胃底、胃窦、十二指肠黏膜光滑,完整:胃内存有少量食物残渣,胃黏膜光滑平整,呈均匀淡粉色,无出血、糜烂及溃疡。+10 Gz实验组,重复暴露实验组肉眼胃底、胃窦、十二指肠黏膜均可见散在小溃疡及出血斑,冲洗后可见胃黏膜表面呈弥漫性水肿,可见广泛分布的大小不等的糜烂、出血灶,以胃体部和胃底部黏膜明显,部分黏膜充血剥脱。
2.2 不同+Gz值暴露胃黏膜损伤指数的变化 胃黏膜表面损伤程度按照GUTH标准法在光镜下计算损伤指数并进行比较,表中对照组(+1 Gz暴露)大鼠在光镜下胃黏膜光滑完整无损。+5 Gz暴露组与对照组比较,+5 Gz暴露组中大鼠胃黏膜充血,红肿,有轻微点状损伤(0.35±0.21 vs 0.00±0.00,P=0.081);胃黏膜损伤指数变化不明显,差异无统计学意义(P>0.05)。+10 Gz暴露组(8.56±0.32 vs 0.00±0.00,P<0.01)、连续暴露实验组(10.33±0.41 vs 0.00±0.00,P<0.01)与对照组比较每只大鼠胃黏膜仅有不同程度灶状糜烂,胃黏膜损伤指数变化明显增大。+10 Gz暴露组与连续暴露组比较:大鼠间具有显著性差异(P<0.05)。+10 Gz暴露组与+5 Gz暴露组(8.56±0.32 vs 0.35±0.21,P=0.007);连续暴露组与+5 Gz暴露组比较(10.56±041 vs 0.35±0.21,P<0.001);连续暴露组与+10 Gz暴露组(10.56±041 vs 8.56 ±0.32,P=0.028)(见表1)。
2.3 不同+Gz值暴露对大鼠胃液EGF含量的影响 大鼠胃液EGF含量比较:各暴露组与对照组比较,胃液EGF含量明显降低:+5 Gz暴露组与对照组(1.054±0.308 vs 1.309 ±0.075,t=8.331,P <0.001);+10 Gz暴露组与对照组(0.793±0.047 vs 1.309±0.075,t=24.106,P <0.001);连续暴露组与对照组比较(0.730±0.103 vs 1.309±0.075,t=16.047,P<0.001),差异有统计学意义。除开+10 Gz实验组与连续暴露实验组组间比较胃液EGF含量明显降低,但P<0.05,其他各组间比较P<0.01,差异均有统计学意义。+10 Gz暴露组与+5 Gz暴露组(0.793 ±0.047 vs 1.054±0.308,t=7.478,P <0.001);连续暴露组与+5 Gz暴露组(0.730±0.103 vs 1.054±0.308,t=6.106,P <0.001);连续暴露组与+10 Gz暴露组(0.730±0.103 vs 0.793±0.047,t=1.302,P=0.0225)(见表1)。
表1 4组大鼠光镜下损伤指数和胃液EGF含量的比较(±s)Tab1 Comparison of the damage index and gastric juice EGF content in 4 groups of rats under light microscope(±s)
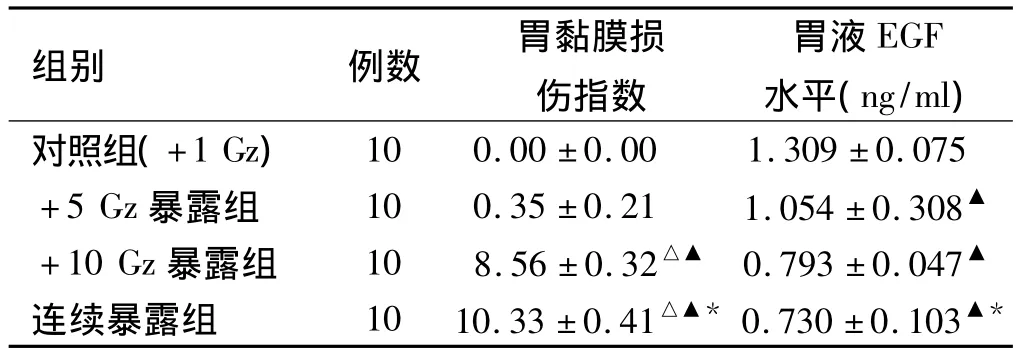
表1 4组大鼠光镜下损伤指数和胃液EGF含量的比较(±s)Tab1 Comparison of the damage index and gastric juice EGF content in 4 groups of rats under light microscope(±s)
与对照组比较,△P<0.05;与+5Gz暴露组比较,▲P<0.01;与+10Gz暴露组比较,*P<0.05。
组别 例数 胃黏膜损伤指数胃液EGF水平(ng/ml)10 0.00±0.00 1.309±0.075+5 Gz暴露组 10 0.35±0.21 1.054±0.308▲+10 Gz暴露组 10 8.56±0.32△▲ 0.793±0.047▲连续暴露组 10 10.33±0.41△▲* 0.730±0.103对照组(+1 Gz)▲*
3 讨论
高+Gz暴露对飞行员胃肠造成的损害程度一直是国内外学者关心的课题[6,10-12]。已有研究[13]表明,在飞行过程中会产生不同强度的加速度(+Gz),加速度是一种很强的应激因素,使胃肠黏膜侵袭作用和保护作用的平衡破坏,交感神经兴奋性增强,使胃黏膜下血管痉挛收缩,黏膜血供减少,局部组织缺血缺氧,抵抗力降低。有学者报道,缺氧抑制大鼠排空及胃酸分泌,反馈性刺激胃泌素分泌增加[10]。在不同的加速度刺激下(+Gz),飞行员有胃肠激素的升高[12-14]。多项动物实验结果也表明,在高+Gz值暴露下可发生急性胃黏膜损伤,并检测到血液中SS、GaS含量改变。以此提出+Gz暴露对脑肠肽和胃肠激素的影响可能是造成飞行过程中急性胃黏膜病变的重要因素[15]。而关于高+Gz暴露对胃黏膜损伤与胃液EGF含量的关系研究很少。高+Gz值暴露作为一种很强的应激因素,其产生的胃黏膜损伤程度可能与胃液EGF的分泌有关系,为进一步探究高+Gz值暴露后大鼠胃黏膜损伤的可能发生的机制,开展了本次实验。
EGF是一种营养多肽,其作用广泛,在降低胃黏膜损伤程度,在参与组织损伤修复过程中起着重要作用[16]。EGF与应激性胃黏膜损伤的发生、发展有着密切联系[17],EGF能促进细胞增殖、分化和迁移,参与溃疡再上皮化,填充黏膜缺损,在再生黏膜内建上皮结构,增加胃黏膜血流量,并且能够显著抑制胃酸分泌[17]。Hui等[18]报道外源性 EGF 可显著增加血流量并参于黏膜早期的修复。EGF对维持胃肠道正常的生理功能具有重要作用。当胃肠道出现强烈应激时,体液中 EGF的量往往下降[19-20],治疗后体液中 EGF含量又会明显增高[21]。
本实验研究显示,与对照组相比,+10 Gz暴露组和连续暴露实验组大鼠胃黏膜损伤指数明显大于相应对照组(P<0.05);胃黏膜大体观察损伤程度亦较对照组明显加重,在不同加速度的3个实验组中,以+10 Gz组和重复暴露组大鼠胃黏膜损伤较重,+5Gz组损伤较轻。相应的,与对照组相比,胃液EGF表达在+5 Gz组、+10 Gz组和重复暴露组均明显减少,+10 Gz组和重复暴露组胃液EGF表达减少的程度较+5 Gz组更为显著,3个实验组间比较,差异均具有统计学意义(P<0.01)。
本实验结果说明模拟高+Gz暴露作为一种强烈应激能够造成大鼠胃黏膜损伤,并且随着+Gz暴露值的增加,使胃黏膜溃损伤程度加重;同时,模拟高+Gz暴露能够使胃液EGF表达减少,随着+Gz暴露值的增加,胃液EGF表达逐渐下降。该结果使我们有理由认为+Gz暴露使胃液EGF表达减少可能是急性胃黏膜损伤的重要机制之一。分析其可能原因,模拟高+Gz值暴露应激状态下,交感、副交感神经强烈兴奋,体内释放大量儿茶酚胺、多巴胺、生长抑素等类物质,影响全身代谢和内分泌的变化,使全身血流重新分布,消化道黏膜供血减少,胃黏膜组织的血流量减少,降低氧和营养物质的供应,从而使胃黏膜分泌EGF减少,胃液EGF的减少通过削弱防御因子的作用,增加损害因子,参加了胃黏膜损伤的病理生理过程。国内外许多实验研究有着类似报道[22-25],应激性胃溃疡患者胃液EGF含量较正常明显降低,当溃疡愈合时,其胃液EGF含量亦明显增高,EGF与胃溃疡愈合、黏膜组织修复密切相关。
总之,本实验探讨了加速度+Gz或模拟加速度+Gz与大鼠胃黏膜损害程度的关系以及与胃液EGF之间的关系。结果表明,越高+Gz值暴露和重复暴露,大鼠胃黏膜损害程度越大,胃液EGF含量越低。该机制可能与+Gz值暴露降低了胃液中的表皮生长因子(EGF)表达有关。本实验为进一步研究在不同+Gz值下暴露对飞行员胃肠黏膜损伤机理,为探讨高+Gz暴露时飞行员胃肠损伤的深层次防护提供科学依据。
[1]Li P,Li WD,Zhao QP,et al.Effects of+Gz training on urine NAG,mALB and β2-MG in high-performance-fighter pilots[J].Space Medi-cine& Medical Engineering,2011,24(3):221-223.李鹏,李卫东,赵青平,等.+Gz训练对高性能战斗机飞行员尿NAG,mALB及β2-MG的影响[J].航天医学与医学工程,2011,24(3):221-223.
[2]Li JS,Sun XQ,Wu XY,et al.Influences of repeated lower+Gz exposures on high+Gz exposure induced brain injury in rats[J].Space Medicine& Medical Engineering,2002,15(5):339-342.李金声,孙喜庆,吴兴裕,等.低+Gz重复暴露后对高+Gz致大鼠脑损伤的影响[J].航天医学与医学工程,2002,15(5):339-342.
[3]Jin Z,Geng XC,Lu X,et al.Analysis of the relaxed+Gz tolerance records of 580 fighter pilots[J].Chin J Aerospace Med,2006,17(3):185-190.金朝,耿喜臣,陆霞,等.580例歼击机飞行员的基础+Gz耐力检查结果分析[J].中华航空航天医学杂志,2006,17(3):185-190.
[4]Zhan H,Zhang Z,Lu JY,et al.Myocardial free radical metabolic changes in rats after repeated high+Gz exposure and protective effects of low-G preconditioning and tea polyphenols[J].Chin J Appl Physiol,2004,20(3):249-252.詹皓,张政,陆江阳,等.重复+10Gz暴露对大鼠心肌自由基代谢的影响及低G预适应和茶多酚的保护作用[J].中国应用生理学杂志,2004,20(3):249-252.
[5]Li WD,Li P,Zhang SH,et al.Effect of high+Gz stress on urinary testosterone,cortisol and aldosterone contents of high performance fighter pilots[J].Chin J Aerospace Med,2009,20(3):203-205.李卫东,李鹏,张书海,等.高+Gz应激对高性能战斗机飞行员尿中睾酮、皮质醇和醛固酮含量的影响[J].中华航空航天医学杂志,2009,20(3):203-205.
[6]Wu ZJ,Zhong XJ,Sun YP.Changes of somatostatin(SS)in stomach and duodenum of rats after+Gz exposure[J].Space Medicine &Medical Engineering,2005,18(2):148-150吴战军,钟学军,孙延平.+Gz值暴露后大鼠胃十二指肠粘膜及生长抑素含量的变化[J].航天医学与医学工程,2005,18(2):148-150.
[7]WU ZA.Gastropic examination and clinical analysis of gastrointestinal ulcers in parachute troop[J].Chin J Aerospace Med,2005,16(1):58-59.伍早安.空降兵消化道溃疡胃镜检查与临床分析[J].中华航空航天医学杂志,2005,16(1):58-59.
[8]Guth PH,Aurse D,Paulsen G.Topical aspirin plus HCI gastric lesions in the rat.Cytoprtective effect of prostagiandin,cimetidine,and probanthine[J].Gastroenterology,1979,76(1):88-93.
[9]Zhang W,Li J,Han QL,et al.Effect of simulated weightlessness on the healing of experimental gastric ulcer in rats[J].World Chinese Journal of Digestology,2011,19(27):2863-2868.张雯,李静,韩全利,等.模拟失重对大鼠实验性胃溃疡愈合的影响[J].世界华人消化杂志,2011,19(27):2863-2868.
[10]Williams D,Kuipers A,Mukai C,et al.Acclimation during space flight:effects on human physiology[J].CMAJ,2009,180(13):1317-1323.
[11]Cohen S.Isolation of a mouse submaxillary gland protein accelerating incisor eruption and eyelid opening in the new-born animal[J].J Biol Chem,1962,237:1555-1562.
[12]Dai Y,Ji G,Huang Y,et al.Changes of plasma endocrine hormone in pilots under Coriolis acceleration[J].Space Med Med Eng(Beijing),1998,11(2):121-123.
[13]Sun XQ,Zhang LF,Wu XY,et al.Effects of repeated brain ischemia induced by rapid lower body negative pressure on brain water and Na+,K+-ATP ase activity in rats[J].Aviat Space Environ Med,2002,73(1):50-53.
[14]Olsen PS,Poulsen SS,Therkelsen K,et al.Effect of sialoadenectomy and synthetic human urogastrone on healing of chronic gastric ulcers in rats[J].Gut,1986,27(12):1443-1449.
[15]Sun XQ,Zhang LF,Wu XY,et al.Effects of repeated brain ischemia induced by rapid lower body negative pressure on brain water and Na+,K+-ATP ase activity in rats[J].Aviat Space Environ Med,2002,73(1):50-53.
[16]Brzozowski T,Konturek SJ,Majka J,et al.Epidermal growth factor,polyamines,and prostaglandins in healing of stress-induced gastric lesions in rats[J].Dig Dis Sci,1993,38(2):276-283.
[17]Konturek SJ.Role of growth factors in gastroduodenal protection and healing of peptic ulcers[J].Gastroenterol Clin North Am,1990,19(1),41-65.
[18]Hui WM,Chen BW,Kung AW,et al.Effects of epidermal growth factor on gastric blood flow in rats:possible role in mucosal protection[J].Gastroenterology,1993,104(6):1605-1610.
[19]Xu CD,Yuan YZ,Chen SN,et al.Relationship between content change of epidermal growth factor(EGF)in body juice and healing of peptic ulcer[J].Shanghai Med J,2000,23(5):296-298.许春娣,袁耀宗,陈舜年,等.体液中表皮生长因子水平变化与消化性溃疡愈合的关系[J].上海医学,2000,23(5):296-298.
[20]Chen SP,Lu GJ,Wen SH.Study on epidermal growth factor levels of saliva,gastric juice and sebum in patients with pepticulcer disease[J].Chin J Dig,1994,14(1):15-17.陈寿坡,陆国均,温淑豪.消化性溃疡患者唾液、胃液和血清中表皮生长因子含量的研究[J].中华消化杂志,1994,14(1):15-17.
[21]Akbulut KG,Gönül B,Türkyilmaz A,et al.The role of epidermal growth factor formulation on stress ulcer healing of the gastric mucosa[J].Surg Today,2002,32(10):880-883.
[22]Tan YG,Shu Q,Qiu MJ,et al.Epidermal growth factor and its receptor mRNA expression in gastric ulcer healing process[J].World Chinese Journal of Gastroenterology,2005,13(14):1768-1770.谭永港,舒晴,邱猛进,等.表皮生长因子及其受体mRNA在胃溃疡发生与愈合过程中的表达[J].世界华人消化杂志,2005,13(14):1768-1770.
[23]Okabe S,Amagase K.An overview of acetic acid ulcer models-the history and state of the art of peptic ulcer research [J].Biol Pharm Bull,2005,28(8):1321-1341.
[24]Zhang JZ,Liu GF.Research progress of gastric mucosal defense mechanism[J].Chin J Clinicians(Electronic Version),2007,1(5):441-443.张金卓,刘改芳.胃黏膜防御机制的研究现状与进展[J].中华临床医师杂志(电子版),2007,1(5):441-443.
[25]Qin YM,Zhou L.Advance in adaptive cytoprotection of gastric mucosal[J].Chin J Gastroenterol Hepatol,2006,15(1):88-91.秦咏梅,周力.胃黏膜适应性细胞保护研究进展[J].胃肠病学和肝病学杂志,2006,15(1):88-91.

