衣霉素诱导胃癌细胞内质网应激介导上皮间质转化的发生
甘惠中,史冠男,戴 夫,彭 琼
安徽医科大学第三附属医院消化内科,安徽合肥230061
上皮间质转化(epithelial-mesenchymal transtions,EMT)是上皮细胞来源肿瘤发生局部浸润和远处转移的一个重要途径[1]。细胞遗传学及临床研究发现胃癌中EMT相关基因存在高表达,提示EMT参与胃癌的侵袭与转移[2-3]。已有大量研究显示,内质网应激(endoplasmic reticulum stress,ERS)可诱导包括肝癌细胞、乳腺癌细胞等多种肿瘤细胞发生EMT[4];但胃癌细胞中未见研究报道。本研究旨在观察TM诱导的ERS能否介导胃癌SGC-7901细胞发生EMT,以期为寻找抑制胃癌侵袭、转移新靶点提供依据。
1 材料与方法
1.1 细胞系 胃癌细胞SGC-7901由安徽医科大学第三附属医院消化内科保存。
1.2 主要仪器和试剂 本研究采用美国Bio-Rad公司电泳仪、电泳槽和转移电泳槽;美国Thermo公司酶标仪;日本三洋公司二氧化碳孵箱;北京半导体设备厂JTT-7A超净工作台;Eppendorf公司台式高速冷冻离心机;RPMI 1640培养基购自美国Hyclone公司;胎牛血清购自浙江天杭生物科技有限公司;葡萄糖调节蛋白 78(glucose-regulated protein78,GRP78)、E-钙黏蛋白(E-cadherin,E-cad)、N-钙黏蛋白(N-cadherin,N-cad)一抗购自 Bioworld公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗及二抗购自北京中杉金桥生物技术公司。TM购自美国Sigma公司,使用时用二甲基亚砜(dimethyl sulfoxide,DMSO)配制,再用培养液配成10 μg/ml浓度备用。0.25%胰酶、PBS由本实验室自行配置。
1.3 方法
1.3.1 细胞培养及分组:复苏SGC-7901细胞,按1×105个/孔的密度接种于6孔板中,每孔2 ml。使用含10%胎牛血清的RPMI 1640培养液,置37℃、5%CO2培养箱内培养。待细胞进入指数生长期后,将其分为TM组、阴性对照组与DMSO组,每组2个复孔。TM组加入10 μg/ml的TM;阴性对照组仅加含10%胎牛血清的RPMI 1640培养液;DMSO组加入与TM组相同体积的DMSO,置37℃、5%CO2培养箱内培养规定时间后收取细胞用于检测。
1.3.2 RT-PCR 检测 GRP78、E-cadherin、N-cadherind mRNA表达:10 μg/ml TM处理胃癌SGC-7901细胞0、6、12、24 h,RT-PCR 法检测 GRP78 mRNA 的表达,取GRP78高表达时间点作为本研究诱导时间,提取总RNA,同时检测 E-cadherin、N-cadherin表达。参照GenBank 中 GRP78、E-cadherin、N-cadherin、GAPDH 序列引物设计(见表1)。PCR扩增反应条件为:95℃预变性5 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃ 延伸60 s,最后72℃总延伸10 min,1%琼脂糖凝胶电泳鉴定。

表1 PCR引物序列Tab1 PCR primer sequences
1.3.3 Western blotting 检测 GRP78、E-cadherin、N-cadherin的蛋白表达:10 μg/ml TM 处理胃癌 SGC-7901 细胞 0 、6、12、24 h,Western blotting 检测 G RP78蛋白表达,取GRP78高表达时间点作为本研究诱导时间,提取总蛋白,制备蛋白样品后,同时灌胶、上样、跑SDS-PAGE电泳,检测E-cadherin及N-cadherin蛋白表达;转膜后将膜泡在10%的牛奶里室温封闭1 h。孵育一抗,杂交袋封闭,4℃过夜。用TBST在室温下脱色摇床上洗3次,每次10 min。同上方法准备二抗稀释液,室温下孵育1 h后,用TBST在室温下脱色摇床上洗5次,每次10 min,化学发光、显影、定影。
1.3.4 细胞形态学观察:10 μg/ml TM处理12 h后,冰浴PBS洗涤细胞,用光学显微镜观察细胞的形态变化情况并拍照。
1.3.5 细胞划痕试验检测SGC-7901细胞TM诱导前后侵袭转移能力:在6孔板每孔加入约5×105个细胞,过夜。阴性对照组、TM组、DMSO组分别处理12 h后,用10 μl枪头垂直划痕,PBS洗细胞3次,去除划下的细胞,加入含10%胎牛血清的RPMI 1640培养液,置37℃的5%CO2培养箱内继续培养。按0、12、24 h取样、拍照。
1.4 统计学处理 采 用SPSS 13.0软件进行分析,计量资料结果采用±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 RT-PCR法检测结果
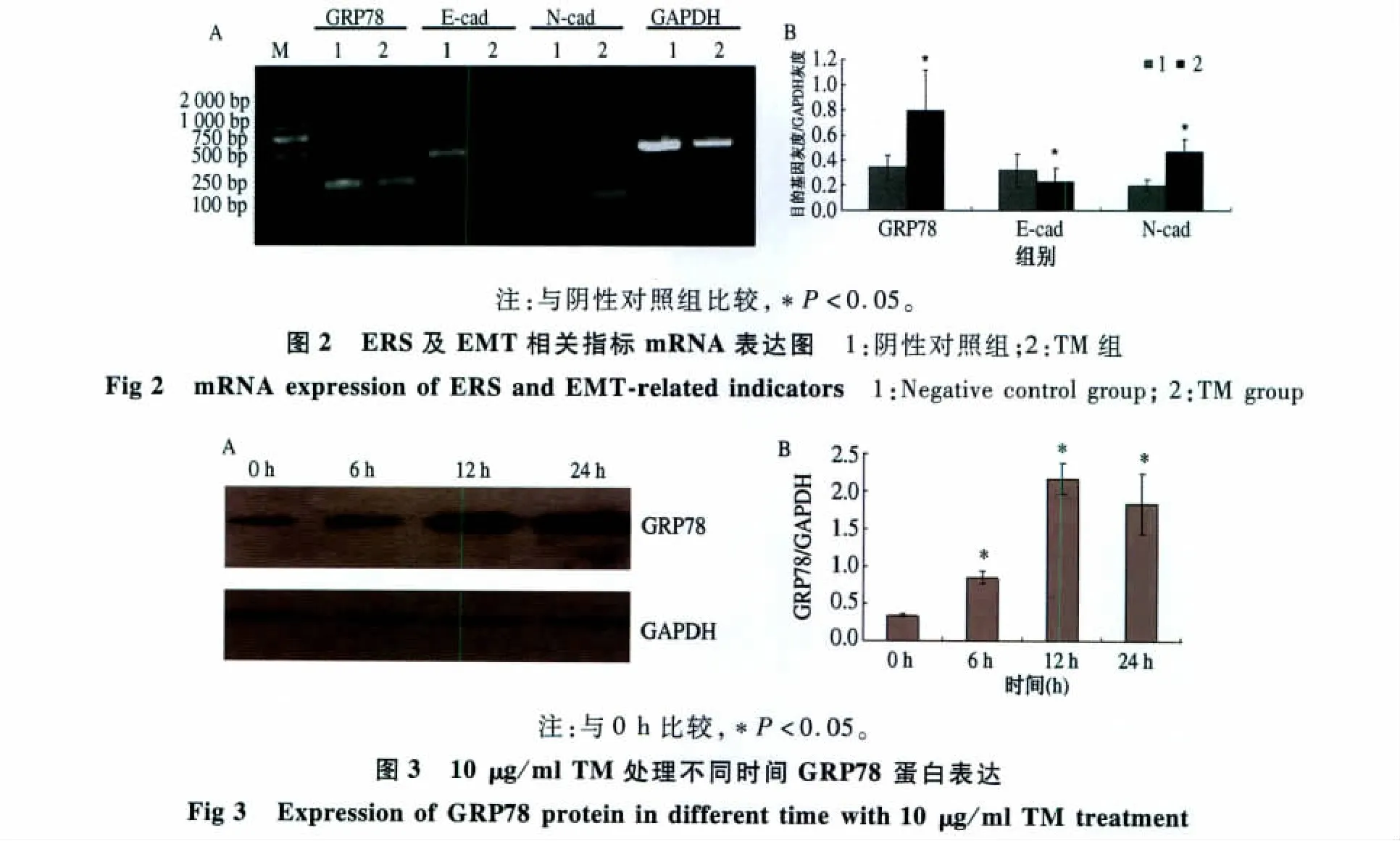
2.1.1 RT-PCR检测SGC-7901细胞经10 μg/ml TM处理 0、6、12、24 h GRP78 mRNA 表达:GRP78 mRNA于10 μg/ml TM处理6 h后开始上升,12 h达到顶峰,24 h内维持在一定高水平,与0 h比较差异有统计学意义(P<0.05,见图1)。因此,本研究采用10 μg/ml TM处理SGC-7901细胞12 h为诱导方法。

图1 10 μg/ml TM处理不同时间GRP78 mRNA表达Fig 1 Expression of GRP78 mRNA in different time with 10 μg/ml TM treatment
2.1.2 10 μg/ml TM 处理12 h前后 SGC-7901细胞ERS及EMT相关指标mRNA水平变化:10 μg/ml TM处理12 h后,可见胃癌细胞中GRP78 mRNA明显高表达,差异有统计学意义(P<0.05),与此同时,TM组E-cad mRNA的表达较阴性对照组下降;TM组N-cad mRNA的表达较阴性对照组明显升高,差异有统计学意义(P<0.05,见图2)。
2.2 Western blotting法检测结果
2.2.1 检测SGC-7901细胞经10 μg/ml TM处理0、6、12、24 h GRP78 蛋白表达:GRP78 蛋白于 10 μg/ml TM处理6 h后开始上升,12 h达到顶峰,24 h内维持在一定高水平,与0 h比较差异有统计学意义(P<0.05,见图3)。因此,本研究采用10 μg/ml TM 处理SGC-7901细胞12 h为诱导方法。
2.2.2 TM处理前后ERS及EMT相关指标蛋白水平变化:予以 10 μg/ml TM 处理 12 h后,胃癌细胞GRP78蛋白表达明显升高,差异有统计学意义(P<0.05),与此同时,TM组E-cad蛋白表达较阴性对照组下降;TM组N-cad蛋白表达较阴性对照组明显升高,差异有统计学意义(P<0.05,见图4)。
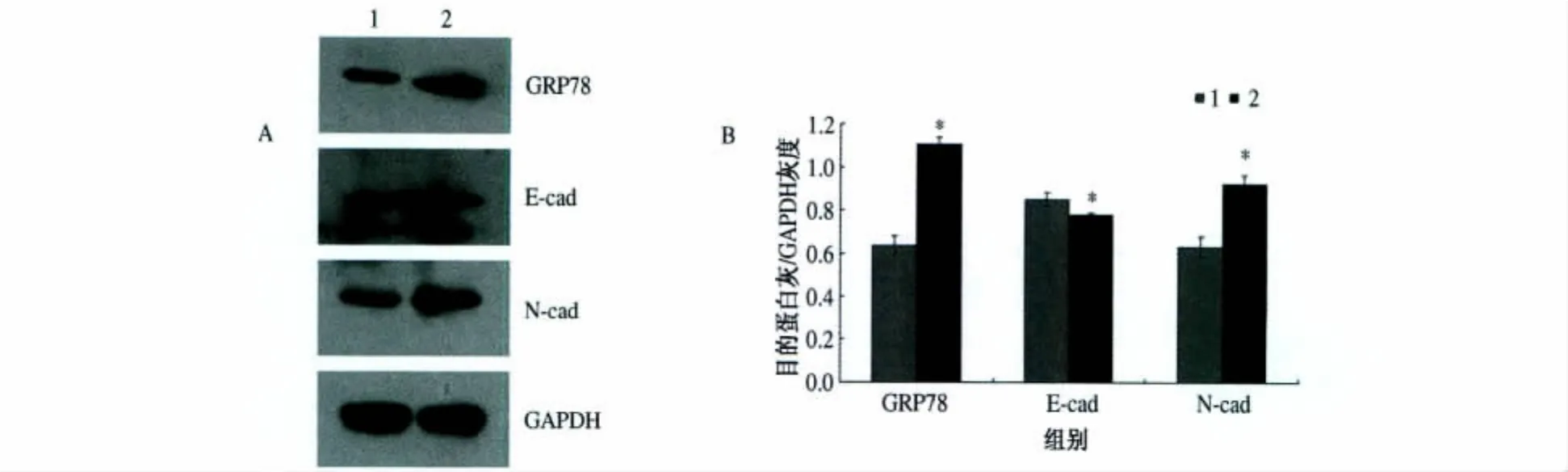
图4 ERS及EMT相关指标蛋白表达图 1:阴性对照组;2:TM组Fig 4 Protein expression of ERS and EMT-related indicators 1:Negative control group;2:TM group
2.3 10 μg/ml TM处理的ERS对SGC-7901细胞形态学变化的影响 光镜下观察细胞形态,阴性对照组SGC-7901细胞贴壁后胞体呈圆形或椭圆形;10 μg/ml TM处理12 h的SGC-7901细胞,可见胞体呈梭状并有伪足生成(见图5)。

图5 10 μg/ml TM处理12 h前后SGC-7901细胞形态学变化 (200×)A:阴性对照组的正常SGC-7901;B:10 μg/ml TM处理12 h后的SGC-7901,箭头所指方向为伪足形成Fig 5 Morphological changes of SGC-7901 cells before and after treatment with 10 μg/ml TM for 12 h(200 × )
2.4 TM诱导ERS前后侵袭转移能力比较 TM诱导ERS后,阴性对照组12 h细胞划痕愈合率为(39.867±3.528)%,24 h细胞划痕愈合率为(80.200±2.300)%;TM组12 h细胞划痕愈合率为(56.333±4.430)%,24 h细胞划痕愈合率为(96.800±0.954)%;DMSO组12 h细胞划痕愈合率为(41.633±1.069)%,24 h细胞划痕愈合率为(79.333±3.044)%。TM组比阴性对照组细胞划痕愈合速度快,划痕缩窄明显,差异有统计学意义(P<0.05);DMSO组与阴性对照组相比差异无统计学意义(P>0.05,见图 6)。

图6 细胞划痕图(200×)A:阴性对照组;B:TM组;C:DMSO组Fig 6 Cell scratch map(200×) A:Negative control group;B:TM group;C:DMSO group
3 讨论
研究表明,由于低糖、低氧、低钙等慢性应激反应的刺激,大多数肿瘤细胞中普遍存在ERS激活现象,表现为GRP78蛋白与未折叠蛋白反应(unfold protein response,UPR)3条通路相关的PERK、IRE-1及 ATF6等跨膜蛋白结合的分离,从而激活UPR,可见GRP78蛋白在内质网应激反应中发挥重要作用[5]。本研究以浓度为10 μg/ml的TM处理胃癌SGC-7901细胞12 h,GRP78表达达高峰,24 h维持较高水平,说明成功诱导胃癌SGC-7901细胞发生了ERS。
EMT的发生是一个多基因、多步骤、多阶段的复杂过程,发生EMT后,上皮细胞失去了细胞极性,细胞间黏附力下降,并逐渐生成伪足,获得了较高的迁移、侵袭、抗凋亡和降解细胞外基质等间质细胞表型的能力。目前研究表明,EMT在多种恶性肿瘤的原发性浸润和远处转移中发挥重要作用,如胰腺癌[6]、肝癌[7]、胃癌[8]等。肿瘤细胞中存在的ERS激活及UPR已被证实与肿瘤细胞的生存、演进、耐药性甚至转移有关,但其确切机制尚未明确。近年来越来越多的证据证实,肿瘤微环境触发肿瘤细胞发生ERS可介导其发生EMT。Bambang等[9]证实乳腺癌 MDA-MB-231 细胞中,ERP29的过表达使细胞表型发生EMT,使肿瘤细胞失去侵袭和转移性质。Tai等[7]发现敲除存活素基因的Hep3B肝癌细胞中GRP78的表达下调而EMT标志的波形蛋白的表达上调,进而介导其发生EMT。Ulianich等[10]报道称在甲状腺PC Cl3细胞中ERS可介导其发生EMT现象。因此,肿瘤细胞内普遍存在的ERS可诱导其发生 EMT。本研究发现,在10 μg/ml TM作用于胃癌SGC-7901细胞12 h GRP78高表达时,TM组E-cad较阴性对照组表达下调,N-cad较阴性对照组表达上调;光镜下观察细胞形态,发现TMSGC-7901组细胞胞体呈梭状并有伪足生成;划痕试验结果示,TM组比阴性对照组细胞生长速度快,愈合早,说明胃癌细胞发生了EMT,同时其侵袭、转移能力增强。因此本研究认为TM诱导的ERS可介导胃癌SGC-7901细胞发生 EMT,进而促进该肿瘤细胞的侵袭、转移。
本研究只是对胃癌SGC-7901细胞中ERS与EMT的关系初步探讨,由于实体肿瘤微环境复杂,ERS诱发因素及下游信号通路较多,ERS与肿瘤细胞生存、肿瘤血管生成及肿瘤细胞凋亡等均有关,因此,胃癌中ERS与EMT确切关系有待进一步更深入研究。
[1]Cannito S,Novo E,di Bonzo LV,et al.Epithelial-mesenchymal transition:from molecular mechanisms,redox regulation to implications in human health and disease [J].Antioxid Redox Signal,2010,12(12):1383-430.
[2]Zhong XY,Zhang LH,Jia SQ,et al.Positive association of up-regulated Cripto-1 and down-regulated E-cadherin with tumour progression and poor prognosis in gastric cancer[J].Histopathology,2008,52(5):560-568.
[3]Liu YC,Shen CY,Wu HS,et al.Mechanisms inactivating the gene for E-cadherin in sporadic gastric carcinomas[J].World J Gastroenterol,2006,12(14):2168-2173.
[4]Rouschop KM,van den Beucken T,Dubois L,et al.The unfolded protein response protects human tumor cells during hypoxia through regulation of the autophagy genes MAP1LC3B and ATG5 [J].J Clin Invest,2010,120(1):127-141.
[5]Lee HK,Xiang C,Cazacu S,et al.GRP78 is overexpressed in glioblastomas and regulates glioma cell growth and apoptosis[J].Neuro Oncol,2008,10(3):236-243.
[6]Krantz SB,Shields MA,Dangi-Garimella S,et al.Contribution of epithelial-to-mesenchymal transition and cancer stem cells to pancreatic cancer progression [J].J Surg Res,2012,173(1):105-112.
[7]Tai CJ,Chin-Sheng H,Kuo LJ,et al.Survivin-mediated cancer cell migration through GRP78 and epithelial-mesenchymaltransition(EMT)marker expression in mahlavu cells [J].Ann Surg Oncol,2012,19(1):336-343.
[8]Joo YE,Park CS,Kim HS,et al.Prognostic significance of E-Cadherin/catenin complex expression in gastric cancer[J].J Korean Med Sci,2000,15(6):655-666.
[9]Bambang IF,Xu S,Zhou J,et al.Overexpression of endoplasmic reticulum protein 29 regulates mesenchymal-epithelial transition and suppresses xenograft tumor growth of invasive breast cancer cells[J].Lab Invest,2009,89(11):1229-1242.
[10]Ulianich L,Garbi C,Treglia AS,et al.ER stress is associated with dedifferentiation and an epithelial-to-mesenchymal transition-like phenotype in PC Cl3 thyroid cells[J].J Cell Sci,2008,121(Pt 4):477-486.

