松木层孔菌多糖的微波提取和体外活性研究*
杨 开 薛介丰 金月忠 张安强 孙培龙
(浙江工业大学生物与环境工程学院,杭州 310032)
松木层孔菌(Phellinus pini)又名松针层孔菌、松白腐菌,隶属于担子菌门、伞菌纲,锈革孔菌目(Hymenochaetales),锈革孔菌科(Hymenochaetaceae),木层孔菌属(Phellinus)。松木层孔菌子实体多糖具有较显著的抗病毒活性[1],其菌丝体多糖对小鼠离体淋巴细胞也有较显著的促增殖作用[2]。在松木层孔菌多糖抗氧化方面,王稳航等人对三种子实体多糖进行了清除超氧阴离子、羟基自由基和丙二醛抑制的体外实验[6]及小鼠体内抗氧化研究[7]。另外还有少数的酚类[8]和萜类[9]等成分的报道。
但与同属的桑黄(Phellinus linteus)相比,目前有关松木层孔菌的研究还很少,也未见对其子实体多糖的提取工艺研究报道。本文以松木层孔菌子实体为原料优化多糖微波辅助提取工艺,并研究体外抗氧化和α-葡萄糖苷酶抑制活性。这不仅为松木层孔菌多糖的提取生产提供工艺条件,而且也为该珍稀药用菌的医药保健品研发提供参考依据。
1 材料和方法
1.1 仪器与材料
仪器及生产厂家:MAS-Ⅱ微波萃取仪,上海新仪微波化学科技有限公司;SHB-Ⅱ循环水式多用真空泵,郑州长城科工贸有限公司;RE-2000A旋转蒸发器,上海亚荣生化仪器厂;UV-2550紫外可见分光光度计,日本岛津公司;DHG-9070A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;FW135中草药粉碎机,上海将来实验设备有限公司;Alpha 2-4 LD Plus真空冷冻干燥机,德国Christ公司;Spectra max M2多功能酶标仪,美国Molecular Devices公司。
松木层孔菌子实体:采自黑龙江,浙江益圣菌物发展有限公司提供,由浙江省医学科学院保健食品研究所吴学谦研究员鉴定。
2,2-Diphenyl-picrylhydrazyl (DPPH),2,2-Azin-obis(3-ethylbenzothiazoline-6-sulfonic acid)diam-monium salt (ABTS),2,4,6-Tris (2-pyridyl)-striazi-ne (TPTZ),α-葡萄糖苷酶(Saccharomyces cerevisi-ae),4-nitrophenyl-alpha-D-glucopyranosidide (PNP-G)购自Sigma公司;其余试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 实验方法
松木层孔菌子实体切成小块后粉碎机粉碎,过60目筛,洁净PE袋双层密封后室温干燥贮藏备用。
1.2.1 粗多糖提取流程。松木层孔菌子实体粉末60 ℃烘干至恒重,称取10 g左右倒入1 L的玻璃烧瓶中,按比例加入水,设置相应温度后微波搅拌提取一定时间,5 000 r/min离心后取上清液,真空浓缩至原有体积的1/5左右后加入4倍体积95%食用级乙醇轻微搅拌后沉淀,静置8 h以上,得醇沉物。醇沉物再经无水乙醇、丙酮洗涤,72 h冷冻干燥后得松木层孔菌粗多糖。
1.2.2 响应面实验设计。 综合相关文献报道以及前期预试结果,本论文固定微波提取功率为600 W,设定料液比(A)、提取时间(B)和提取温度(C)为 3个主要影响因素,以总多糖提取率(Y)为评价指标进行响应面 Box-Behnken实验设计,因素水平见表1。
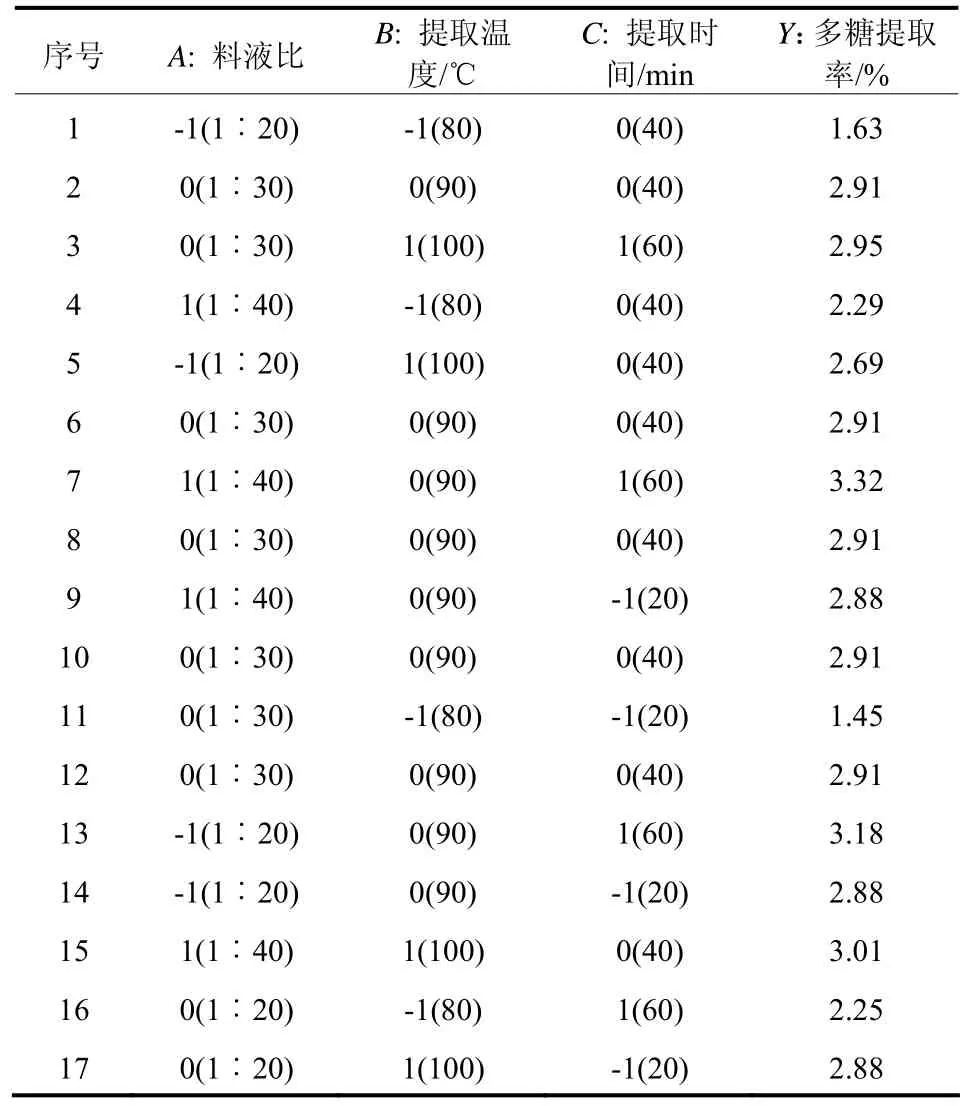
表1 响应面设计及实验结果
1.2.3 多糖提取率测定。多糖含量采用苯酚-硫酸法[10]测定,平行3次测定,再按以下公式计算提取率。

1.2.4 抗氧化活性测定。基于不同的抗氧化原理,各种体外抗氧化活性检测方法很多,目前常用的抗氧化活性检测方法主要是基于自由基清除能力、抑制脂类氧化能力和样品还原能力三种机理[11]。由于样品体系的多样性和复杂性,目前还尚未有统一的方法,而且每种方法存在一定的优缺点和局限性,所以一般要通过两种以上的抗氧化方法来评价样品的抗氧化性能[12]。本文采用了文献[6]以外的DPPH、ABTS和FRAP三种常用方法来评价松木层孔菌粗多糖的抗氧化活性。
(1)清除 DPPH自由基活性测定。测定方法参考Milardovic[13]的报道并略有改动。用80%甲醇溶液配制成0.2 mmol/L的DPPH试剂,取1 mL稀释的提取液与3 mL DPPH试剂混合,暗处反应1 h,然后在515 nm下测定吸光值。以80%甲醇溶液作为空白对照。其结果表达为清除率达到50%时所对应的多糖浓度(即EC50)。
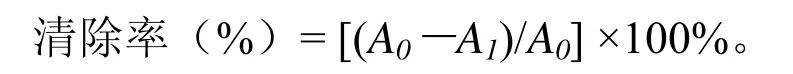
其中,A0为空白对照的吸光值;A1为样品的吸光值。下同。
(2)清除 ABTS自由基活性测定。测定方法参考 Miller[14]的报道并略作修改。取 140 mmol/L的过硫酸钾溶液加入到 7 mmol/L的ABTS溶液中混合,暗处反应12~16 h。测定前用无水乙醇将ABTS·+溶液稀释至吸光值为0.70 ±0.02(734 nm下)。取0.2 mL稀释过的提取液与3.8 mL的 ABTS·+溶液混合摇匀,在室温下反应10 min后,在734 nm下测定吸光值。以80%甲醇溶液作为空白对照。其结果表达为清除率达到50%时所对应的多糖浓度(即EC50)。
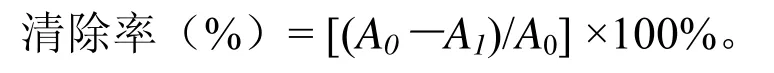
(3)FRAP总抗氧化活性测定。测定方法参考Benzie[15]的报道并略有修改。FRAP试剂的准备:将 0.1 mol/L的醋酸缓冲试剂(pH3.6)、19 mmol/L 的TPTZ、20 mmol/L氯化铁,按体积比10︰1︰1混合。3.9 mL FRAP试剂工作液加入0.1 mL稀释过的提取液,混合均匀,置于37 ℃恒温水浴中10 min,然后在593 nm下测其吸光值。以 FeSO4为标准溶液,根据反应后的吸光值,在标准曲线上求得相应的FeSO4浓度,定义为FRAP值,结果以每毫克多糖相当FeSO4还原力的相当量表示(mmol FeSO4/mg多糖),FRAP值愈大,抗氧化活性愈强。
1.2.5 α-葡萄糖苷酶抑制活性的测定。测定方法参考 Dong[16]的报道并略作修改。将 α-葡萄糖苷酶溶于pH 6.8、0.1 mol/L磷酸缓冲液配成1 U/mL酶液,PNPG溶于相同缓冲液配成5 mmol/L底物液,整个检测在96微孔板上进行。取60 μL样品、50 μL酶液在37 ℃下保温10 min,再加入5 mmol/L PNPG 反应 20 min,用 160 μL 0.2 M Na2CO3终止酶反应。最后在酶标仪上405 nm处测定吸光值,以磷酸缓冲液作为空白对照。其结果表达为抑制率达到 50%时所对应的多糖浓度(即IC50)。
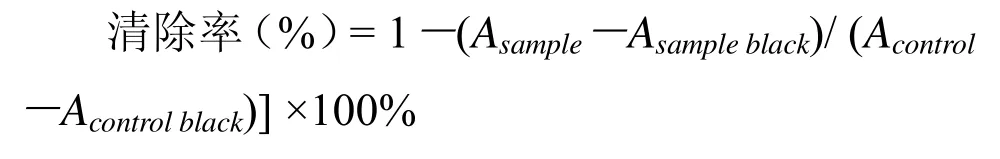
其中,Asample为样品的吸光值;Asampleblack为无底物时样品的吸光值;Acontrol为空白的吸光值;Acontrolblack为无底物时空白的吸光值。
1.3 数据处理
实验时平行3次测定,测定结果以均值±标准差(Means±SD)表示。实验数据采用SPSS16.0的ANOVA进行邓肯氏(Duncan’s)差异分析,以P<0.05为显著。
2 结果与分析
2.1 响应面优化多糖提取工艺
根据Box-Behnken的中心组合设计原理,以松木层孔菌的多糖提取率为响应值,通过响应面分析对提取条件进行优化,实验结果见表1。
利用Design-Expert 8软件对表1中的实验数据进行回归拟合,其分析结果见表2、表3。回归方差分析表明,该模型极显著(P<0.0001),模型的R2=0.9749,AdjR2=0.9427,说明模型的拟合程度较好,可用于松木层孔菌多糖提取工艺实验的预测。
利用软件对实验数据进行拟合,得到多糖提取率 Y(%)对 A:料液比(液体量)、B:提取温度(℃)、C:提取时间(min)的回归方程如下:
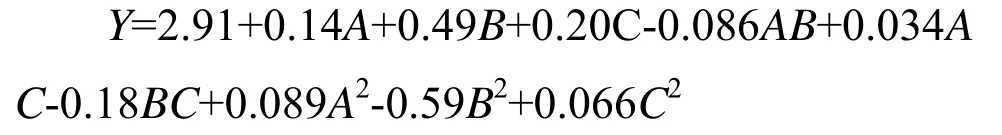

表2 方差分析
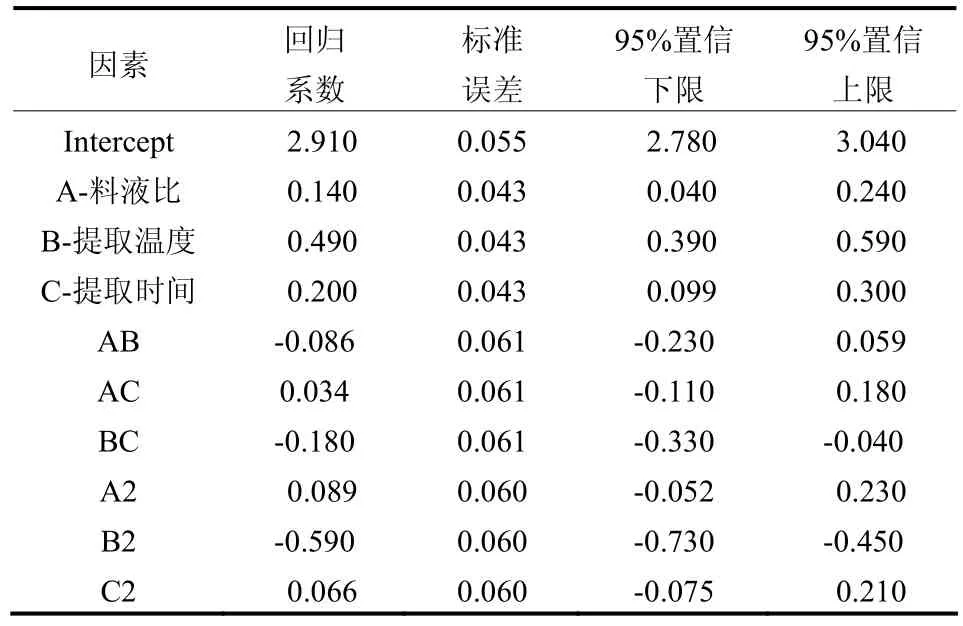
表3 回归方程系数显著性检验
2.2 各因素间的交互作用
根据上述的回归分析结果,采用软件Design-Expert 8对回归方程分析作响应面,生成相应的响应曲面图及其等高线图,以确定料液比、提取时间、提取温度3个因素对多糖提取率的影响,结果如图 1~3所示,结合方差分析结果表明:FA=10.79,FB=128.06,FC=21.65,各因素的F值越大,则说明该因素对实验指标的影响愈大,即重要性愈大。由此可见,各因素对松木层孔菌多糖提取率的影响程度大小为:B(提取温度)>C(提取时间)>A(料液比)。
2.3 最佳工艺条件的确定及验证实验
为进一步确定最佳点,通过Design-Expert 8软件求解多糖提取率的最大值,得到松木层孔菌多糖提取的最佳条件为:料液比1︰39.92,提取温度91.85 ℃,提取时间59.88 min,预测多糖的提取率达到 3.46 %。为检验响应面模型的可靠性,同时考虑到实际操作的便利,综合确定最佳条件为:料液比为1︰40,提取温度为92 ℃,提取时间为60 min。在此条件下3次平均的多糖提取率为 3.33%,与理论值的误差为 3.76%,理论值与实际值基本相符。因此,响应面法所得的优化提取工艺参数较准确,具有较好的参考价值。

图1 料液比与提取温度对多糖提取率影响的等高线图和响应面图
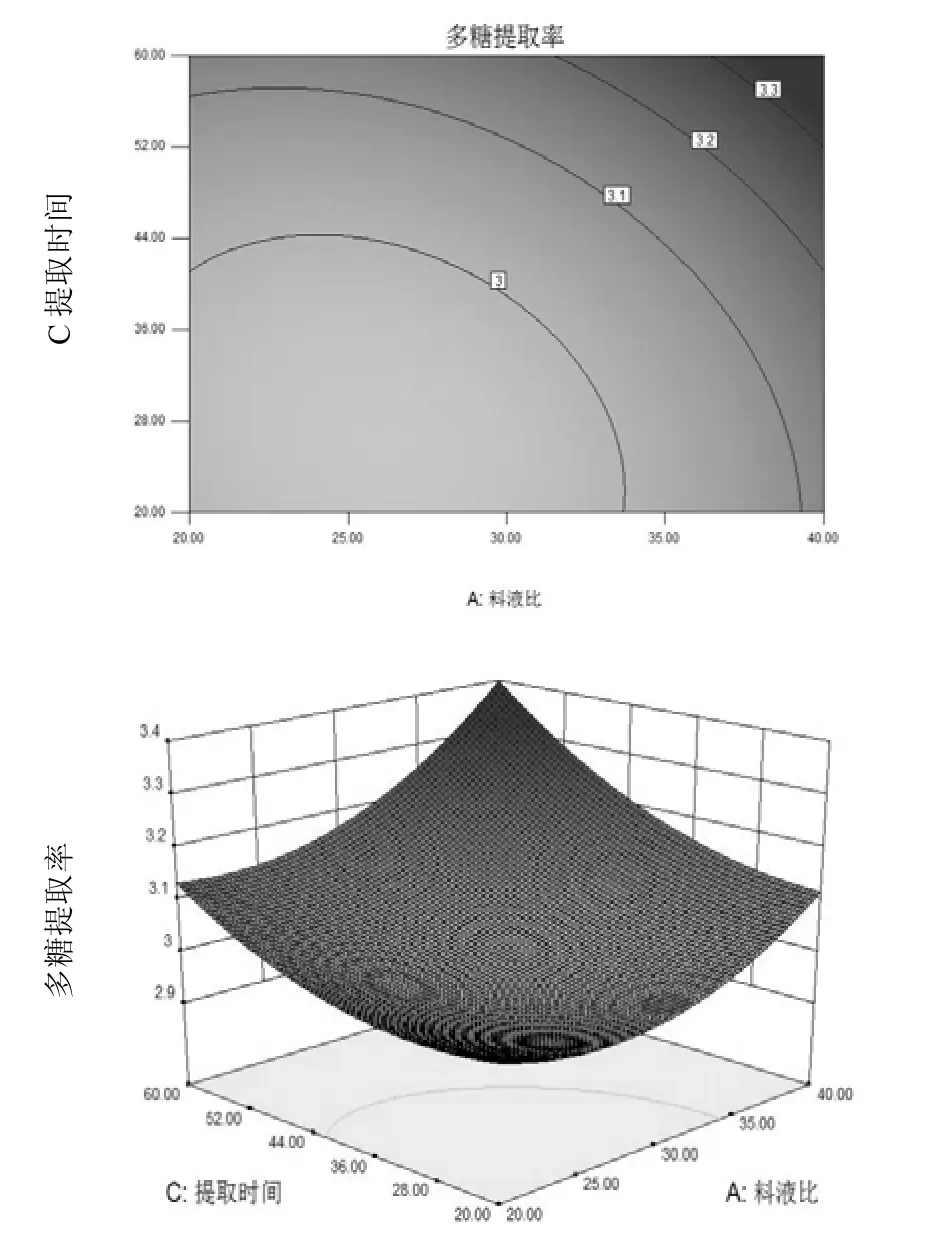
图2 料液比与提取时间对多糖提取率影响的等高线图和响应面图

图3 提取温度与提取时间对多糖提取率影响的等高线图和响应面图
2.4 提取次数实验
根据以上最佳提取条件,进行了提取次数对多糖得率的影响实验,前次提取所得滤渣进行下一次提取,共进行了3次提取(重复3次),单次提取率分别是 3.33±0.16%、0.55±0.17%、0.21±0.01%。其中,第1次提取时多糖平均提取率可达3.33%,第2次降为0.55%,第3次仅为0.21%,按3次总和计算,有94.8%的多糖在前2次就可提取完全,为减少后期蒸发浓缩和超滤等操作,提取次数以2次为宜。
2.5 体外活性测定结果
松木层孔菌多糖体外抗氧化和 α-葡萄糖苷酶抑制活性测定结果见表4。
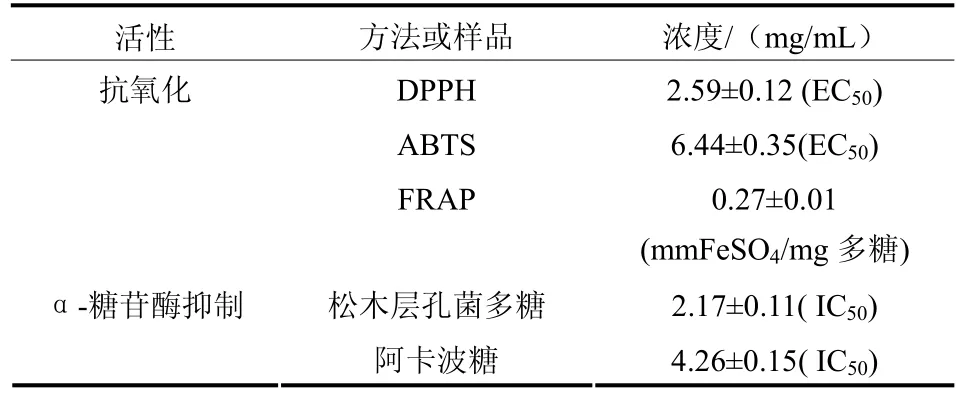
表4 松木层孔菌多糖抗氧化活性和α-葡萄糖苷酶抑制活性结果
发现在实验的浓度范围内,松木层孔菌多糖对 DPPH・和 ABTS·+自由基的清除率均随浓度增加而增加,呈量效关系,对DPPH・自由基的半清除浓度(EC50)为 2.59 mg/mL,高于鸡油菌[17]粗多糖清除DPPH・的EC50值(0.92 mg/mL);对ABTS·+自由基的半清除浓度(EC50)为 6.44 mg/mL,高于DPPH的EC50值,也高于尖顶羊肚菌[18]胞外多糖提取物的清除 ABTS·+值;反映总抗氧化能力的FRAP值为0.27 mmol FeSO4/mg多糖。对α-葡萄糖苷酶活性的抑制实验结果表明,在一定的多糖浓度范围内,该多糖对α-葡萄糖苷酶的抑制作用也呈量效应关系,半抑制浓度(IC50)为2.17 mg/mL,其效果要低于同属的桦褐孔菌多糖[19],而优于阳性对照阿卡波糖(IC50=4.26 mg/mL)。
3 讨 论
本文采用微波辅助提取松木层孔菌子实体多糖,Box-Behnken响应面实验优化多糖提取工艺,影响松木层孔菌多糖提取率的因素依次为:提取温度>提取时间>料液比,综合确定的优化提取工艺条件为:微波功率600 W,料液比1︰40,提取温度92 ℃,提取时间60 min。经80%乙醇沉淀,二次提取,在此条件下松木层孔菌的多糖累计提取率为3.88%。
采用DPPH、ABTS、FRAP三种方法测定松木层孔菌多糖的体外抗氧化活性,结果表明,松木层孔菌粗多糖具有一定的抗氧化活性,有待对其中具抗氧化活性的多糖结构进行更深入的纯化及鉴定等研究。该多糖还显示了一定的α-葡萄糖苷酶抑制活性,可能具有潜在降血糖功能,需作构效关系研究予以证实。
[1]裴丽娟, 袁 雷, 马姣妮, 等. 松木层孔菌多糖 PEP的结构及活性研究[J]. 分子科学学报, 2010, 26(2): 103-107.
[2]Lee M S, Kim S M, Lee Y H, et al. Macromolecules isolated from Phellinus pini fruiting body: chemical characterization and antiviral activity[J]. Macromolecular Research, 2010, 18(6): 602-609.
[3]李 乐, 宋 敏, 袁 芳, 等. 食用菇类中抗氧化活性物质的研究[J]. 南开大学学报(自然科学版), 2007, 40(6):62-66.
[4]Kozarski M, Klaus A, Niksic M, et al. Antioxidative and immunomodulating activities of polysaccharide extracts of the medicinal mushrooms Agaricus bisporus,Agaricus brasiliensis,Ganoderma lucidum and Phellinus linteus[J].Food Chemistry, 2011, 129(4): 1667-1675.
[5]Huang S Q, Ding S, Fan L. Antioxidant activities of five polysaccharides from Inonotus obliquus[J]. Internation Journal of Biological Macromolecules, 2012, 50(5):1183-1187.
[6]王稳航, 李 玉, 刘安军. 松木层孔菌多糖的提取及抗氧化性研究[J]. 食品研究与开发, 2006, 27(11): 53-56.
[7]王稳航, 李 玉, 刘安军. 松木层孔菌多糖对正常小鼠体内抗氧化功能的影响[J]. 现代生物医学进展, 2008,8(8): 1439-1464.
[8]Ayer W A, Muir D J, Chakravarty P. Phenolic and other metabolites of Phellinus pini, a fungus pathogenic to pine[J]. Phytochemistry, 1996, 42(5): 1321-1324.
[9]Park P H, Hur J, Lee D S. Inhibition of nitric oxide production in RAW 264.7 macrophages by diterpenoids from Phellinus pini [J]. Archives of Pharmacal Research,2011, 34(6): 913-917.
[10]张惟杰. 糖复合物生化研究技术 [M]. 杭州:浙江大学出版社, 1999.
[11]Lee I K, Kim Y S, Jang Y W, et al. New antioxidant polyphenols from the medicinal mushroom Inonotus obliquus[J]. Bioorganic﹠Medicinal Chemistry Letters,2007, 17(24): 6678-6681.
[12]Santas J, Carbo R, Gordon M H, et al. Comparison of the antioxidant activity of two Spanish onion varieties [J].Food Chemistry, 2008, 107(3): 1210-1216.
[13]Milardovic S, Ivekovic D, Grabaric B S. A novel amperometric method for antioxidant activity determination using DPPH free radical[J].Bioelectrochemistry, 2006, 68(2): 175-180.
[14]Miller N J, Rice Evans C,Davies M J, et al. A novel method for measuring antioxidant capacity and its application to monitoring antioxidant status in premature neonates[J]. Clinical Science, 1993, 84(4): 407-412.
[15]Benzie I F F, Strain J J. The ferric reducing ability of plasma (FRAP)as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1):70-76.
[16]Dong H Q, Mei L, Feng Z, et al. Inhibitory potential of trilobatin from Lithocarpus polystachyus Rehd against α-amylase linked to type 2 diabetes [J]. Food Chemistry,2012, 130(2): 261-266.
[17]靳文娟, 鲁晓翔. 超声波法提取鸡油菌多糖及其抗氧化性研究[J]. 安徽农业学, 2011, 39(27): 16545-16547.
[18]潘志福, 兰 瑛, 张 松. 尖顶羊肚菌胞外多糖提取物抗氧化作用的研究[J]. 华南师范大学学报(自然科学版),2011, (2): 124-128.
[19]Chen H X, Lu X M, Qu Z S, et al. Glycosidase inhibitory activity and antioxidant properties of a polysaccharide from the mushroom Inonotus Obliquus[J]. Journal of Food Biochemistry, 2010, 34(SUPPL. 1): 178-191.

