小麦麸皮水浸提液对铜绿微囊藻(Microcystis aeruginosa)光合色素含量和叶绿素荧光诱导动力学的影响*
李 藩,李仁辉,于晓章,邵继海**
(1:湖南农业大学资源环境学院,长沙 410128)
(2:中国科学院水生生物研究所,武汉 430072)
1990s 以来,我国淡水水体富营养化日趋严重.2009年中国环境状况公报显示,26 个国控重点湖泊(水库)中,Ⅳ、Ⅴ和劣Ⅴ类水质湖泊(水库)所占比例分别为23.1%、19.2%和34.6%,而Ⅱ、Ⅲ类水质湖泊(水库)分别只占3.9%和19.2%.一些大型湖泊先后暴发了严重的蓝藻水华,如滇池、巢湖、太湖等.因此蓝藻水华的削减与消除对于保证水体水质安全非常重要.
目前化学除藻是水体,特别是小型水体,蓝藻水华去除的主要方法,该方法除藻效果好、见效快.然而,绝大部分化学除藻剂(如CuSO4)、除草剂等会给环境带来二次污染[1],即使有些化学除藻剂(如H2O2)不会对环境造成二次污染,但是这些化学除藻剂对水生生物毒性作用没有选择性,使用这类除藻剂后往往会造成该水体生态系统的崩溃.生物源物质是一类来自生物体的物质,绝大部分生物源物质安全性好,易于降解,对环境的影响小,而且有些生物源物质对蓝藻具有选择性抑制作用[2].以对蓝藻有选择性抑制作用的生物源物质除藻兼具化学除藻方法的除藻效果好、见效快等优点及生物材料生态安全性好的优点.这些优点决定了生物源抑藻物质在快速、安全去除蓝藻水华方面具有巨大的应用潜力.
铜绿微囊藻是我国最常见的水华蓝藻种类,也是产微囊藻毒素的主要种类之一.我们的前期研究结果表明小麦麸皮水浸提液(Wheat Bran Leachate,WBL)对铜绿微囊藻具有较强的抑制作用[3],而且在对铜绿微囊藻有效抑藻浓度内对蛋白核小球藻、斜生栅藻及水体一些常见的浮游细菌均无明显抑制作用.从抑藻效应来看,WBL 的抑藻效应要比大麦秸秆的抑藻效应强[3],而欧洲的一些水库已经开始应用大麦秸秆来控制水体蓝藻水华,并取得良好的效果[4].我国小麦年产量为一亿吨左右,小麦麸皮是小麦加工的副产品,来源广泛.由此可见利用WBL 削减水体蓝藻水华具有较大的应用潜力.
光合放氧生物的叶绿素光诱导荧光与PSⅡ反应中心及反应中心电子供体侧和受体侧氧化还原状态密切相关[5-6].Strasser 等[7]在生物膜能量流动理论基础上建立了叶绿素光诱导荧光动力学曲线分析方法——JIP-test.JIP-test 能较好地反映PSⅡ反应中心及电子供体侧和受体侧的生理状态,现已广泛应用于环境胁迫对蓝藻PSⅡ结构与功能的影响等方面的研究[8-10].为了研究WBL 胁迫对铜绿微囊藻光合系统的影响,本文探讨了WBL 胁迫下铜绿微囊藻光合色素含量及叶绿素光诱导荧光动力学特征的变化,并在此基础上分析了WBL 对铜绿微囊藻光合系统Ⅱ作用的靶位点.
1 材料与方法
1.1 实验材料
实验选用的铜绿微囊藻(Microcystis aeruginosa CHAB-109)由中国科学院水生生物研究所有害藻类生物学学科组提供,藻株用CT 完全培养基培养[11],培养条件为光强30 μmol potons/(m2·s),温度25 ±1℃,光暗比12 h∶12 h(L∶D).供试藻株在实验前进行了纯化除菌处理,具体方法为:将培养好的M.aeruginosa CHAB-109 培养液先用0.8 μm 无菌滤膜过滤除去小的浮游细菌,再用新配置的无菌CT 培养基重悬、重复上述过滤操作;然后将藻细胞重悬在新配置的无菌CT 培养液中,将其置于超声波清洗仪中低频处理5 min,使微囊藻附着细菌游离,再重复上述过滤除菌和藻细胞重悬操作,最后用CT 固体培养基对重悬藻细胞进行划线纯化处理,挑取单藻细胞菌落作为出发藻株进行实验.小麦麸皮来自河南省安阳县种植的小麦,品种为众麦1 号.
1.2 小麦麸皮水浸提液制备
称取8 g 小麦麸皮,加入到1 L ddH2O 中,然后置于湿热蒸汽灭菌锅于115℃灭菌15 min,灭菌后的水浸提液于12000 g 离心10 min,上清液即为小麦麸皮水浸提液(WBL).
1.3 铜绿微囊藻细胞色素含量及叶绿素光诱导荧光动力学的测定
实验在250 ml 的三角瓶中进行,将WBL 与等体积的2×CT 培养基混合,然后加入20 ml 用CT 培养基培养的处于对数生长期的M.aeruginosa CHAB-109,再加入CT 培养基使终体积为100 ml.WBL 终浓度设置为0、0.8、1.6、3.2 g/L(相当于制备WBL 时的小麦麸皮干重(W/V)).所有处理均置于上述培养条件下于80转/min 震荡培养.藻细胞叶绿素和类胡萝卜素含量按Richards 等[12]所述方法用80%丙酮提取测定.藻细胞浓度用血球计数板在显微镜下计数.M.aeruginosa CHAB-109 叶绿素光诱导荧光多相瞬态上升动力学用Handy-PEA(Handy-Plant Efficiency Analyser,Hansatech Instruments,UK)测定,光化光强度为3000 μmol potons/(m2·s),荧光瞬时上升曲线的记录时间为50 μs ~1 s,采样速率在前2 ms 之内是105次/s,2 ms 之后为103次/s.荧光测定前所有样品暗适应15 min.
1.4 叶绿素荧光多相瞬态上升动力学参数分析
根据Strasser 等的能量流动模型图(图1)[7],分析PSⅡ单位反应中心能量流动比活性能参数(ABS/RC、TR0/RC、ET0/RC)和 PSⅡ能量分配比率参数(ψ0、φP0、φE0).各参数具体含义如表 1 所示[13].

表1 叶绿素荧光多相瞬态上升动力学参数Tab.1 Parameters derived from polyphasic rise in chlorophyll fluorescence transients
1.5 数据统计分析
实验数据用SPSS 13.1 进行单因素方差分析(One-Way ANOVA,LSD),P <0.05 被认为具有显著差异.

图1 Strasser 和Strasser 简化的能量在光合器官中的流动模型Fig.1 Strasser and Strasser proposed simplified scheme for the energy cascade from light absorption to electron transport
2 结果与分析
2.1 WBL对M.aeruginosa CHAB-109细胞色素含量的影响
当 WBL 浓度为 0.8 g/L 时,M.aeruginosa CHAB-109 单位细胞内Chl.a 与类胡萝卜素含量在第1 d 与对照(CK)相比无显著差异,尽管从平均值来看,在第3 d 和第5 d 其Chl.a 与类胡萝卜素含量均比对照低,但是统计分析结果显示,其差异均没有达到显著水平.当 WBL 浓度为 1.6 g/L 时,M.aeruginosa CHAB-109 单位细胞内Chl.a 与类胡萝卜素含量在第1 d 与对照相比无显著差异,但是在第3 d 和第5 d 均显著低于对照.当WBL 浓度为3.2 g/L 时,M.aeruginosa CHAB-109 单位细胞内Chl.a 与类胡萝卜素含量在第1 d 即显著低于对照(图2).
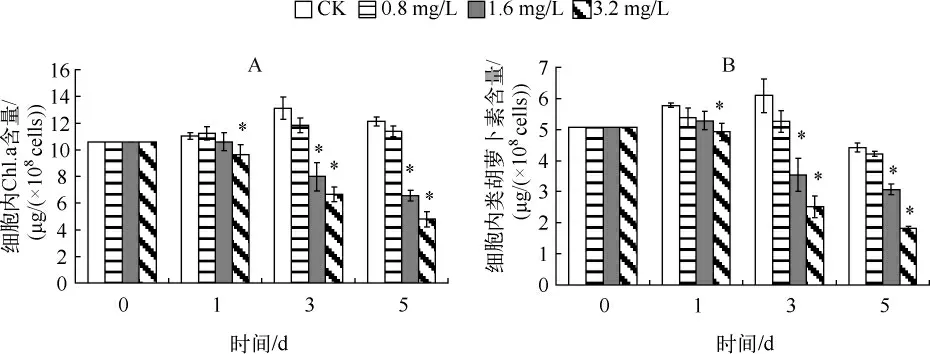
图2 WBL 胁迫对M.aeruginosa CHAB-109 单位细胞内Chl.a 含量(A)和类胡萝卜素含量(B)的影响(* 代表差异显著,下同)Fig.2 Effect of WBL stress on the cellular Chl.a contents(A)and cellular carotenoids contents(B)of M.aeruginosa CHAB-109
2.2 WBL 对M.aeruginosa CHAB-109PSⅡ单位反应中心能量流动比活性能的影响
在 WBL 胁迫后的第 1 d,当 WBL 浓度为 1.6 和 3.2 g/L 时,M.aeruginosa CHAB-109 PSⅡ的 ABS/RC 值显著低于对照;对于TR0/RC、ET0/RC 而言,只有当WBL 浓度达到3.2 g/L 时才显著低于对照.到了第3 d,当WBL 浓度为0.8 g/L 时,ABS/RC、TR0/RC、ET0/RC 3 个比活性能参数与对照相比均无显著差异;当WBL浓度为1.6 和3.2 g/L 时,这3 个比活性能参数均显著低于对照(图3).
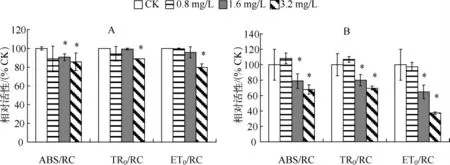
图3 WBL 胁迫对M.aeruginosa CHAB-109 PSⅡ单位反应中心能量流动比活性能参数的影响(A:1 d;B:3 d)Fig.3 Effect of WBL stress on the parameters of energy fluxes per reaction centre of M.aeruginosa CHAB-109 PSⅡ(A:1 d;B:3 d)
2.3 WBL对M.aeruginosa CHAB-109 PSⅡ能量流动分配比率的影响
在 WBL 胁迫后的第 1 d,当 WBL 浓度为 0.8 g/L 时,3 个 PSⅡ能量分配比率参数(ψ0、φP0、φE0)与对照相比均无显著差异;当WBL 浓度达到1.6 g/L 时,ψ0与对照相比无显著差异,而 φP0和 φE0却显著高于对照;当WBL 浓度达到3.2 g/L 时,φP0与对照相比均无显著差异,而 ψ0和 φE0却显著低于对照(图4A).在WBL 胁迫后的第3 d,当 WBL 浓度为1.6 和3.2 g/L 时,ψ0和 φE0均显著低于对照;在各 WBL 浓度胁迫下,φP0与对照相比均无显著差异(图4B).
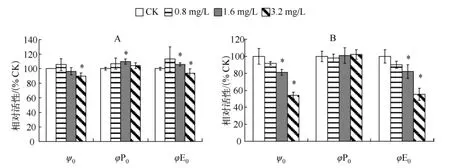
图4 WBL 胁迫对M.aeruginosa CHAB-109 PSⅡ能量分配比率参数的影响(A:1 d;B:3 d)Fig.4 Effect of WBL stress on the parameters of flux ratios of M.aeruginosa CHAB-109 PSⅡ(A:1 d;B:3 d)
3 讨论
藻类和植物均为光合放氧生物,它们具有相似的光合系统结构.叶绿素光诱导荧光动力学可以反映光合放氧生物PSⅡ的结构与功能[14].由于叶绿素光诱导荧光对环境胁迫响应非常灵敏,所以叶绿素光诱导荧光动力学现在已被广泛应用于植物[14-16]和蓝藻对环境胁迫的响应[8-10].
ABS/RC 表示单位反应中心吸收的光能.当WBL 浓度为1.6 和3.2 g/L 时,M.aeruginosa CHAB-109 PSⅡ的ABS/RC 显著低于对照,这也就意味着在这2 个浓度下,WBL 胁迫降低了其反应中心吸收的光能.WBL 胁迫可以显著降低单位细胞内的Chl.a 含量(图2),这可能是因为WBL 胁迫导致该藻反应中心吸收的光能降低.
根据Strasser 等的能量流动模型图[7],φP0可以反映PSⅡ反应中心电子供体侧的电子传递性能.实验结果显示,当 WBL 浓度为1.6 g/L 时,在 WBL 胁迫的第1 d 该藻的 φP0值略高于对照,但是到了第3 d,φP0值与对照相比没有显著差异.这可能与M.aeruginosa CHAB-109 受到WBL 胁迫的应激反应有关.在WBL 胁迫的第3 d,3 个浓度的WBL 胁迫对该藻的φP0值均没有显著影响,这表明M.aeruginosa CHAB-109 的PSⅡ反应中心电子供体侧不是WBL 的抑制作用位点.
ψ0可以反映PSⅡ反应中心电子受体侧的性能[8].本文的结果显示ψ0对WBL 胁迫表现敏感,当WBL 浓度为3.2 g/L 时,ψ0值在第1 d 就显著低于对照,而在 WBL 胁迫的第3 d,1.6 g/L 的WBL 就能抑制该藻的ψ0.由此可见,M.aeruginosa CHAB-109 的PSⅡ反应中心电子受体侧是WBL 的抑制作用位点之一.WBL 胁迫下TR0/RC、ET0/RC 均受到显著抑制.由此可推测在反应中心电子受体侧电子由反应中心传递到QA及QA后面的部位均为WBL 的抑制作用位点.
[1]Xing W,Huang W,Liu G.Effect of excess iron and copper on physiology of aquatic plant Spirodela polyrrhiza(L.)Schleid.Environ Toxicol,2010,25(2):103-112.
[2]Li FM,Hu HY.Isolation and characterization of a novel antialgal allelochemical from phragmites communis.Appl Environ Microbiol,2005,71:6545-6553.
[3]Shao J,Yu G,Wang Z et al.Towards clarification of the inhibitory mechanism of wheat bran leachate on Microcystis aeruginosa NIES-843(cyanobacteria):physiological responses.Ecotoxicology,2010,19(8):1634-1641.
[4]Barrett PRF,Littlejohn JW,Curnow J.Long-term algal control in a reservoir using barley straw.Hydrobiologia,1999,415:309-313.
[5]Krause GH,Weis E.Chlorophyll fluorescence and photosynthesis:the basics.Annu Rev Plant Physiol Plant Mol Biol,1991,42:319-349.
[6]Maxwell K,Johnson GN.Chlorophyll fluorescence-a practical guide.J Exp Bot,2000,51:659-668.
[7]Strasser BJ,Strasser RJ.Measuring fast fluorescence transients to address environmental questions:The JIP test.In:Mathis P ed.Photosynthesis:from light to biosphere.Dordrecht:KAP Press,1995:977-980.
[8]Lu CM,Vonshak A.Characterization of PSⅡ photochemistry in salt-adapted cells of cyanobacterium Spirulina platensis.New Phytol,1999,141:231-239.
[9]Bueno M,Fillat MF,Strasser RJ et al.Effects of lindane on the photosynthetic apparatus of the Cyanobacterium Anabaena:fluorescence induction studies and immunolocalization of ferredoxin-NADP+reductase.Environ Sci Pollut Res,2004,11:98-106.
[10]Zhao B,Wang J,Gong H et al.Effects of heat stress on PSⅡ photochemistry in a cyanobacterium Spirulina platensis.Plant Sci,2008,175:556-564.
[11]Ichimura T.Media for freshwater cyanobacteria.In:Nishizawa K,Chihara M eds.Methods in phycology.Tokyo:Kyouritsu Shuppan,1979:295-296.
[12]Richards FA,Thompson TG.The estimation and characterization of plankton populations by pigment analyses.II.A spectrophotometric method for the estimation of plankton pigments.J Marine Res,1952,11:156-172.
[13]李鹏民,高 辉,Strasser RJ.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用.植物生理与分子生物学学报,2005,31(6):559-566.
[14]Christen D,Schönmann S,Jermini M et al.Characterization and early detection of grapevine(Vitis vinifera)stress responses to esca disease by in situ chlorophyll fluorescence and comparison with drought stress.Environ Exp Bot,2007,60:504-514.
[15]Pinior A,Grunewaldt-Stöcker G,Alten H et al.Mycorrhizal impact on drought stress tolerance of rose plants probed by chlorophyll a fluorescence,proline content and visual scoring.Mycorrhiza,2005,15:596-605.
[16]Strauss AJ,Krüger GHJ,Strasser RJ et al.Ranking of dark chilling tolerance in soybean genotypes probed by the chlorophyll a fluorescence transient O-J-I-P.Environ Exp Bot,2006,56:147-157.

