陈化烟叶中纤维素降解菌群的分离及其特性研究
关 亮,李天丽,陈竹亭,周亚维,汤朝起,瞿永生,李朋富*
(1.南京大学生命科学院,南京 210093;2.上海烟草集团有限责任公司,上海 200082)
陈化烟叶表面被发现有很多种微生物,其中细菌占绝对优势,放线菌和霉菌尤其是放线菌数量较少,细菌中优势种类有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)和噬菌弧菌属(Bacteriovorax)等[1-2]。赵铭钦等[3]研究发现,在烟草陈化过程中烟叶表面的微生物种类和数量随着发酵时间的延伸而呈递减趋势,陈化过程中烤烟烟叶中的多酚氧化酶、蛋白酶和α-淀粉酶活性在前期不断增加,中后期逐渐下降;过氧化物酶活性在陈化期间则一直下降。在烟叶陈化过程中微生物对提高烟叶香气发挥了重要作用[4-6]。在烤烟人工发酵过程中,应用微生物酶或者接种烤烟表面优势微生物,可加快发酵进程,明显提高烟草品质[7-9]。
纤维素是烟叶的主要结构成分,决定着烟叶完整性,可使烟叶持火力增加。但是,烟叶中纤维素含量过高时烟叶组织容易破碎,烟草配方中纤维素含量高对燃吸品质具有副作用,赋予烟气一种尖刺的刺激性和一种“烧纸”的气味[10]。为了研究微生物在烟叶陈化过程中的作用,以及利用微生物发酵降低烟叶或烟梗中过高的纤维素含量,以提高烟叶品质,本文从陈化烟叶中分离纤维素降解菌群,并分析其特性。
1 材料与方法
1.1 纤维素降解菌群的分离
2009年河南产B2F等级烟叶(陈化6个月)由上海烟草集团有限责任公司提供。培养基为蛋白胨纤维素培养液(PCS)[11]:蛋白胨 0.5%,滤纸1%,NaCl 0.5%,酵母粉0.1%,CaCO30.5%,pH为8。取60 g烟叶加入500 mL 磷酸缓冲液(PBS)中,摇床200 n/min摇动3 h,然后在超净台中用灭菌过的250尼龙筛过滤,滤液在5000 g转速下离心15 min,将离心所得细菌加入PCS中,30 ℃摇床(160 n/min)培养,待滤纸崩解后,按3∶100的比例转接到新的PCS培养基中,如此不断转接,待滤纸崩解所需时间稳定后即获得纤维素降解菌群。
1.2 变性梯度凝胶电泳(DGGE)分析菌群组成
PCS培养基中接入菌群后,0~9 d连续取样1 mL,离心后采用XS方法[12]提取细菌DNA,DNA纯化采用EZ-10 Spin Column(上海生物工程有限公司)进行。16S rDNA片段的PCR扩增采用一对通用引物 341F(5′-CCTACGGGAGGCAGCAG-3′)和518R(5′-ATTACCGCGGCTGCTGG-3′)[13],其中引物 341F的5′端连接着GC发夹结构(5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGG GGCACGGGGG G-3′)。
PCR反应条件为:95 ℃预变性5 min,以下为94 ℃ 1 min,65~56 ℃ 30 s(每个循环降 1 ℃,共10个循环),72 ℃ 1 min,后20个循环用55 ℃退火,最后72 ℃延伸10 min。PCR产物用1.2%琼脂糖电泳检验。
DGGE采用CBS电泳装置(CBS,美国),浓度为 8%的聚丙烯酰胺凝胶,0.5×TAE电泳缓冲液(20 mmol/L Tris-HCl,pH 8.3,10 mmol/L醋酸,0.5 mmol/L EDTA),40%~60%的变性胶梯度(100%变性剂为7 mol/L尿素和40%去离子甲酰胺的混合物),60 ℃和75V电泳16 h。电泳结束后用Gelred染色,再用凝胶成像仪(720BR-01503,BIO-RAD,美国)拍照。
选择亮度较高的条带,用手术刀片切下,放置在1.5 mL聚丙烯离心管中,捣碎,加入30 μL去离子水,4 ℃过夜。取2 μL溶解液作为模板,在相同条件下重复上述PCR过程(341F不加GC夹),将用EZ-10 Spin Column(上海生物工程有限公司)纯化后的PCR产物连接到pGEM-T载体中(Promega,美国)并导入感受态细胞进行克隆,再以阳性克隆子为模板,利用引物为T7(5'-GGC CGC GGG AAT TCG ATT-3')和 SP6(5'-GCG AAT TCA CTA GTG ATT-3')进行克隆PCR,PCR产物由ABI 3730XL DNA测序仪(上海生工有限公司)测序,测序结果提交到EMBL,所得序列号为HE793381- HE793384和HE793387。
1.3 温度和pH对菌群纤维素酶活性的影响
酶活性的测定参考孙宝魁的方法[14]。取 1 mL细菌培养液,10000 n/min离心2 min后,取上清液作为酶液。1 mL 0.625%的羧甲基纤维素钠溶液(pH 5的柠檬酸-磷酸氢二钠缓冲液配制)中加酶液 0.5 mL,于50 ℃水浴反应 30 min后,先加入10%的NaOH溶液0.5 mL,再加入1 mL的DNS(3,5-二硝基水杨酸),沸水浴5 min,冷却后定容至10 mL,在 530 nm下测定其 OD值。空白对照是将酶液100 ℃水浴15 min后,按同样方法进行分析。采用上述方法制作葡萄糖标准曲线,根据标准曲线上算出酶反应液中的葡萄糖浓度,再根据以下公式计算酶活性。酶活力单位的定义为:1 mL酶液作用于底物每分钟生成 1 μg葡萄糖所需的酶量为一个酶活(U)。酶活性的计算公式是:
U=CV1/(tV2)
其中:C—酶反应液中葡萄糖浓度(μg/mL),V1—酶反应液体积(mL),V2—所取酶液体积(mL),t—水浴时间(min)。
在分析温度对纤维素酶活性的影响时,纤维素酶活性测定过程中加入酶液后的水浴温度为 20、25、30、45、50、55、60和65 ℃。分析pH对混合菌群纤维素酶活性的影响时,纤维素酶活性测定过程中用pH为3.0、4.0、5.0、6.0、7.0、8.0和9.0的磷酸氢二钠-柠檬酸缓冲液配制羧甲基纤维素钠溶液。
1.4 菌群降解滤纸、烟叶和烟梗过程中纤维素酶活性的变化
以 PCS为基础培养基,纤维素碳源分别是滤纸、烟叶和烟梗(均为 1%的含量),30 ℃条件下160 n/min摇床培养,定时取样测定纤维素酶活性。
2 结 果
2.1 纤维素降解菌群的分离

图1 菌群接入PCS培养基6 d后情况Fig.1 Photograph of bacterial community culture grown in PCS medium for 6 d
经过 12代以上的传代培养,得到了具有稳定降解纤维素能力的菌群(图1),该菌群在PCS(加滤纸)培养基中培养6 d左右时,培养基颜色变深,滤纸大部分被降解,培养液颜色变成深黄色,继续培养4 d后滤纸几乎全部分解。试图采用曾涛等[15]的培养基分离能够降解纤维素的单个细菌,但没有成功。
2.2 纤维素降解菌群的组成
从DGGE图谱来看(图2),在连续9 d的培养过程中纤维素降解菌群组成较为稳定,图中A-E条带序列的BLAST结果见表1。
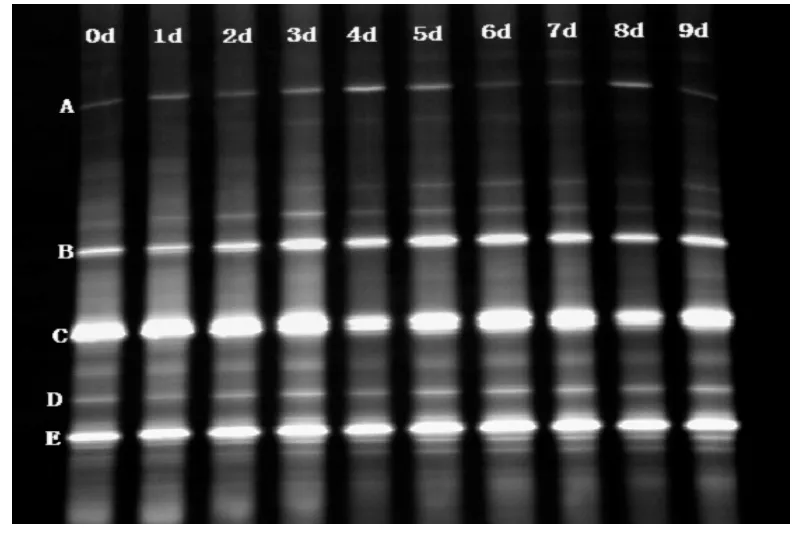
图2 PCS培养基培养9 d过程中纤维素降解菌群组成的DGGE分析Fig.2 DGGE profile of cellulose-decomposition bacterial community grown in PCS medium for 9 d

表1 DGGE图中各条带序列的EMBL序列号及BLAST结果Table1 The EMBL and BLAST result of the bands in DGGE picture
2.3 温度和pH对菌群纤维素酶活性的影响
从图3结果来看,20 ℃时酶活性很低,随着温度升高酶活性升高,在 60 ℃时纤维素酶活性达到最高值,继续升高温度则酶活性下降。从图4可看出,pH从3升高到8时,纤维素酶活性不断增大,pH 8的时候酶活性达到最大,但当pH继续升高到9时则酶活性下降。
2.4 菌群降解滤纸、烟叶和烟梗过程中纤维素酶活性的变化
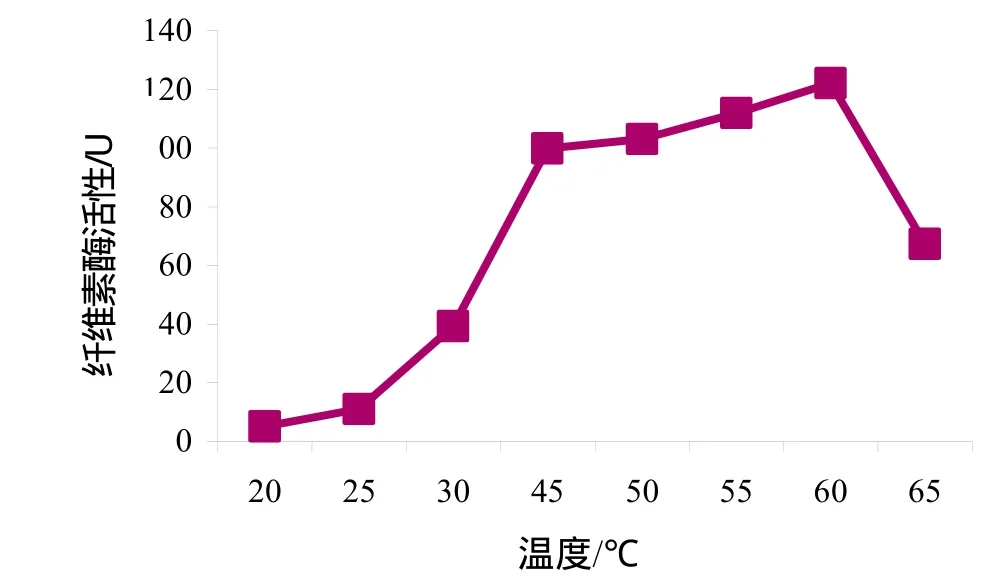
图3 温度对纤维素酶活性的影响Fig.3 Effect of temperature on the cellulase activity
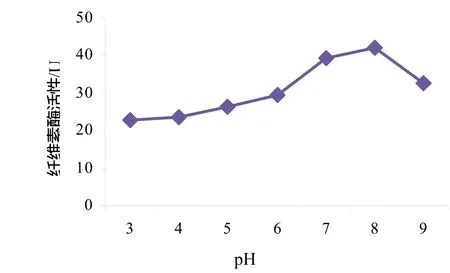
图4 pH对纤维素酶活性的影响Fig.4 Effect of pH on the cellulase activity
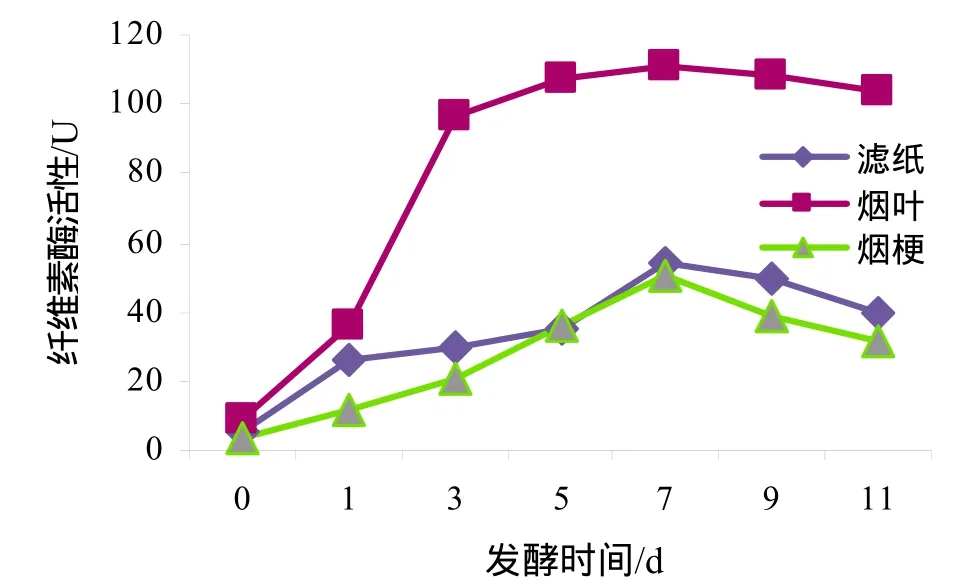
图5 不同纤维素材料对菌群纤维素酶活性的影响Fig.5 Effect of different cellulose source on the cellulase activity
从图5结果看出,所得纤维素降解菌群在加入3种纤维素类材料培养过程中均表现出较高的纤维素酶活性,第7天纤维素酶活性达到最大,在加入烟叶、滤纸和烟梗培养时纤维素酶活性分别为最高达111.07、53.88和50.87 U,加入烟叶培养菌群时纤维素酶活性最高。
3 讨 论
本实验中分离纤维素降解菌群时,除了采用PCS培养基外,还采用了羧甲基纤维素钠培养基[15],两种培养基分离菌群时各进行了3次重复,都成功地获得了降解纤维素的菌群,但只对其中一个在PCS培养基中获得的菌群进行了继续分析。具有纤维素降解活性菌群的成功分离显示,在陈化过程中微生物可能参与了烟叶纤维素的降解。
从DGGE分析的菌群组成看,条带A为节杆菌属的一种细菌,在接种纤维素降解菌的堆肥发酵中,也检测到了节杆菌[16]。条带B为放线菌属的未培养菌,放线菌可以降解利用含有木质素、纤维素、半纤维素的木屑[17]。条带 E为克雷伯氏菌属的一种,Golias和Dumsday发现产酸克雷伯氏菌P2能够将纤维素转变为乙醇[18]。以上这3种细菌可能具有降解纤维素的能力,但是,因为没有能够分离出降解纤维素的单个细菌,不能确定菌群中每个细菌的作用,我们推测菌群中各个细菌协同参与了纤维素的降解作用。
菌群在烟叶为碳源的培养基中纤维素酶活性最高可达111.07 U,孙宝魁等[14]分离得到的菌群在以秸秆为碳源的情况下,纤维素酶活性最高可达73.3 U,说明本实验所得菌群活性较高。
对于酶活性而言,本实验中所得菌群的最适pH为8,最适温度为60 ℃。孙宝魁等[14]所得纤维素降解菌群在pH为6时酶活性最高,酶活性最适温度为45 ℃。Haruta等[11]所得纤维素降解菌群在50 ℃时纤维素降解能力最强。因此,本实验中所得菌群的最适温度和最适pH都偏高一些。
本试验结果显示,温度和pH影响菌群的纤维素酶活性,因此,陈化过程中温度和pH都可能影响菌群对纤维素的降解,从而影响烟叶品质。菌群在进行烟叶和烟梗发酵试验时都显示了纤维素酶活性,这说明继续筛选更高活性的纤维素降解菌群,是在烟叶和烟梗发酵过程中降解纤维素的一个有效途径。
采用电热式温湿自控密集烤烟箱对烤烟上部烟叶进行烘烤过程中发现,由于烟叶纤维素酶的作用导致了烟叶中纤维素含量下降,并且烘烤的温度会影响纤维素酶的活性[19]。本研究结果显示,陈化过程中烟叶表面存在纤维素降解菌群,因此,烘烤和陈化过程都可能影响烟叶中的纤维素含量,从而影响烟叶的品质。从土壤和不同材料的堆肥中分离的纤维素分解菌能降解卷烟过滤嘴纤维[20],对于烟叶工业生产过程以及烟草产品使用过程产生的含纤维素废弃物的处理,也将是本文分离到的纤维素降解菌群的有效应用途径之一。
4 结 论
首次从陈化烟叶中分离出纤维素降解菌群,说明陈化过程中微生物可能对烟叶纤维素有降解作用,从而影响烟叶的陈化效果。本研究结果也显示,可以利用这个菌群在烟叶发酵或者烟梗发酵中降解纤维素,改善烟叶或者烟梗的品质。为了在烟草工业中应用纤维素降解菌群,有必要继续筛选更高活性的纤维素降解菌群,以及对菌群降解纤维素的生化和分子机制进行深入研究。
[1]Zhao M Q, Wang B X,Li F X, et al.Analysis of bacterial communities on aging flue-cured tobacco leaves by 16S rDNA PCR–DGGE technology[J]. Applied Microbiology and Biotechnology, 2007, 73∶ 1435-1440.
[2]Huang J W, Yang J K, Duan Y Q, et al.Bacterial diversities on unaged and aging flue-cured tobacco leaves estimated by 16S rRNA sequence analysis[J].Applied Microbiology and Biotechnology, 2010, 88∶553-562.
[3]赵铭钦,邱立友,张维群,等.陈化期间烤烟叶片中生物活性变化的研究[J].华中农业大学学报,2000,19(6):537-542.
[4]赵铭钦,刘云,李芳芳,等.陈化烤烟叶面优势菌的筛选鉴定与其增香效应[J].微生物学报,2009,49(5):624-630.
[5]罗家基,朱子高,罗毅,等.微生物在烟叶发酵过程中的作用[J].烟草科技,1998(1):6.
[6]徐洁,张修国,张天宇,等.微生物真菌菌剂对烟叶品质的影响[J].西南农业大学学报,2005,27(2):163-168.
[7]余永茂,高芳馨,张敷华,等.微生物酶发酵低次烟叶初试报告[J].烟草科技,1988(5):16-18.
[8]陈襦星,王磊,奠湘涛,等.烟叶微生物发酵的探讨[J].微生物学通讯,1990(2):37-39.
[9]谢和,秦京,王亮,等.优势微生物在烤烟人工发酵过程中所起的作用[J].贵州农学院丛刊,1990(1):95-107 .
[10]李国栋,马海燕,于建军,等.纤维素酶降解烟叶中纤维素的作用效果[J].中国农学通报,2008,24(12):256-259.
[11]Haruta S, Cui Z, Huang Z, et al.Construction of a stable microbial community with high cellulose degradation ability[J].Applied Microbiology and Biotechnology,2002, 59∶ 529-534.
[12]Amann R, Ludwig W.Ribosomal RNA-targeted nucleic acid probes for studies in microbial ecology[J].FEMS Microbiological Reviews,2000, 24∶ 555-565.
[13]Muyzer G, Waal E C D, Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993, 59∶695-700.
[14]孙宝魁,王东伟.高效稳定纤维素分解混合菌群的筛选及分解特性研究[J].环境科学与管理,2008,33(9):116-119.
[15]曾涛,陈汉清,曾会才.一株从金钱树上分离的产纤维素降解酶的菌株的分离及特性鉴定[J].基因组学与应用生物学,2009,28(4):715-719.
[16]刘佳,李婉,许修宏,等.接种纤维素降解菌对牛粪堆肥微生物群落的影响[J].环境科学,2011,32(10):3073-3081.
[17]Ali N, Eliyas M.Hydrocarbon-utilizing microorganisms naturally associated with sawdust[J].Chemosphere,2011,83:1268-1272.
[18]Golias H, Dumsday G J.Characteristics of cellulase preparations affecting the simultaneous sacchari fi cation and fermentation of cellulose to ethanol[J].Biotechnology Letters, 2000, 22∶ 617-621.
[19]武圣江,宋朝鹏,许自成,等.烘烤过程中烤烟细胞壁生理变化研究[J].中国烟草科学,2010,31(3):73-77.
[20]孙毓临,谭英,刘明洋,等.卷烟过滤嘴降解菌的筛选及其降解效果的电镜观察[J].中国烟草科学,2010,31(3):59-62.

