烟草抗PVYN突变株SN01的SRAP-PCR反应体系的建立与优化
李 杰,朱 丹,李 颖,安梦楠,赵秀香,吴元华*
(1.沈阳农业大学植物保护学院,沈阳 110866;2.辽宁省抚顺市农业技术推广中心,辽宁 抚顺 113006)
Sequence-related amplified polymorphism (SRAP)标记技术是一种新型的基于 PCR的显性标记系统[1],该技术利用独特的双引物对基因的open reading frames(ORFs)特定区域进行扩增,与RAPD、SSR、AFLP等技术相比,SRAP技术具有操作简便、重复性好、信息丰富等优点,特别是对序列信息未知的物种研究提供了快捷简便的途径。该技术已成功用于一些重要性状的标记、基因定位、遗传图谱的构建和抗病基因相关方面研究[2-8]。
本研究室通过人工接种的方法从烟草品种NC89中筛选获得了高抗马铃薯Y病毒脉坏死株系(Potato virus Y-vein necrosis strain,PVYN)的植株(暂定名为SN01),并对该突变株的抗病生理生化机制进行了报道[9]。采用正交试验建立优化的SRAP-PCR反应体系,为进一步研究其抗病基因奠定基础。
1 材料与方法
1.1 材料
抗PVYN烟草突变株SN01的嫩叶于2012年7—9月采自沈阳农业大学植物病毒研究室。用于SRAP-PCR反应的dNTPs、Taq DNA聚合酶、标准分子量(Maker)DL2000及新型植物DNA提取试剂盒均购自北京天根生化科技有限公司,Mg2+溶液和10×PCR buffer(Mg2+free)均购于大连宝生物工程有限公司。SRAP引物由上海生工生物工程公司合成,引物序列见表1。
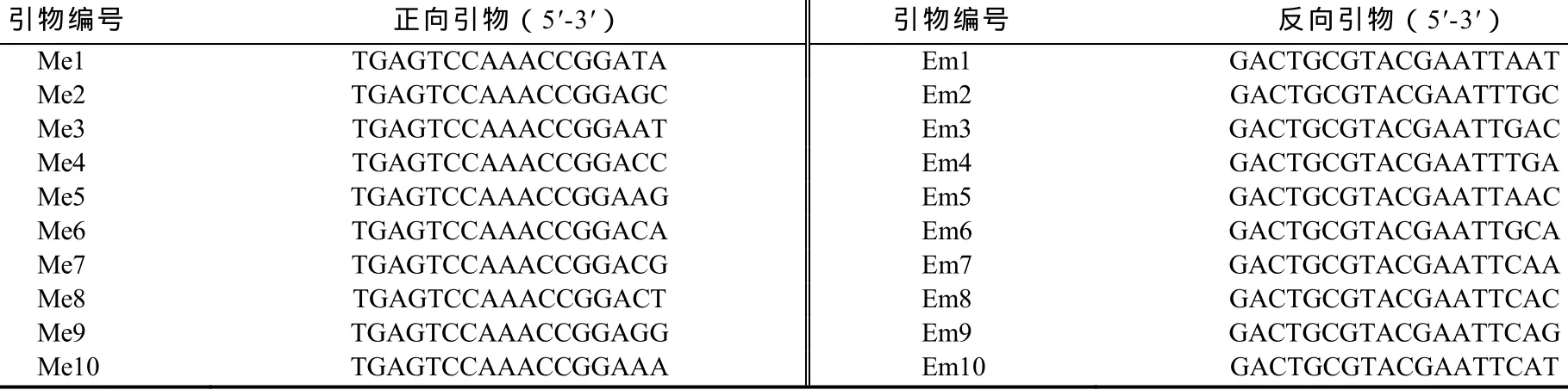
表1 引物序列Table1 Sequence of primers
1.2 方法
1.2.1 烟草总 DNA的提取和浓度测定 烟草总DNA的提取使用北京天根生化科技有限公司的新型植物DNA提取试剂盒,用美国热电集团生产的NANODROP 1000核酸检测仪检测所提取烟草DNA的浓度与纯度,并通过琼脂糖电泳检测总DNA纯度。将提取到的DNA稀释至30 ng/μL,置于-20 ℃冰箱保存以备使用。
1.2.2 SRAP-PCR反应体系的正交设计 采用L16(45)正交试验设计,对SRAP-PCR反应体系里主要的5个影响因素(dNTPs、Mg2+、Taq DNA聚合酶、引物、DNA模板)设计正交优化试验,所用引物为Me8和Em8(表1)。SRAP-PCR各因素的水平见表2,L16(45)正交试验设计方案见表3。反应总体系为 20 μL,每管加入 2 μL 的 10×PCR buffer(Mg2+free),其他组分加入量见表3,最后用ddH2O补充至 20 μL。
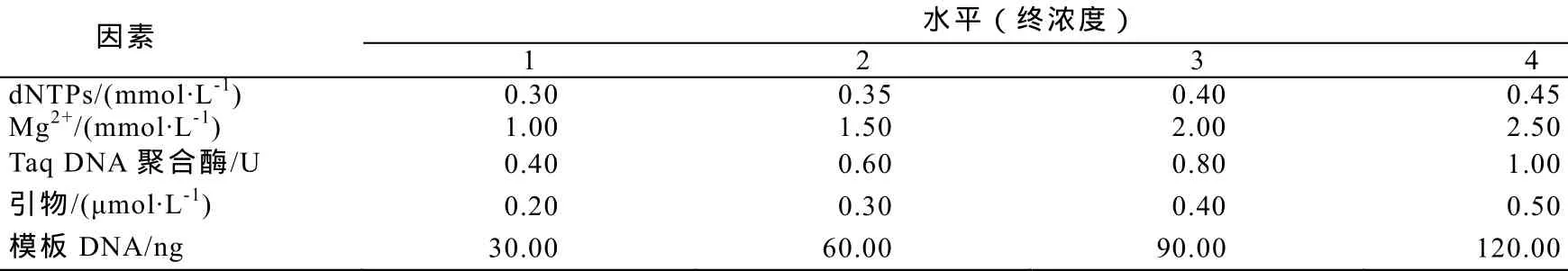
表2 SRAP-PCR反应因素和水平Table2 Factors and levels of SRAP-PCR reaction
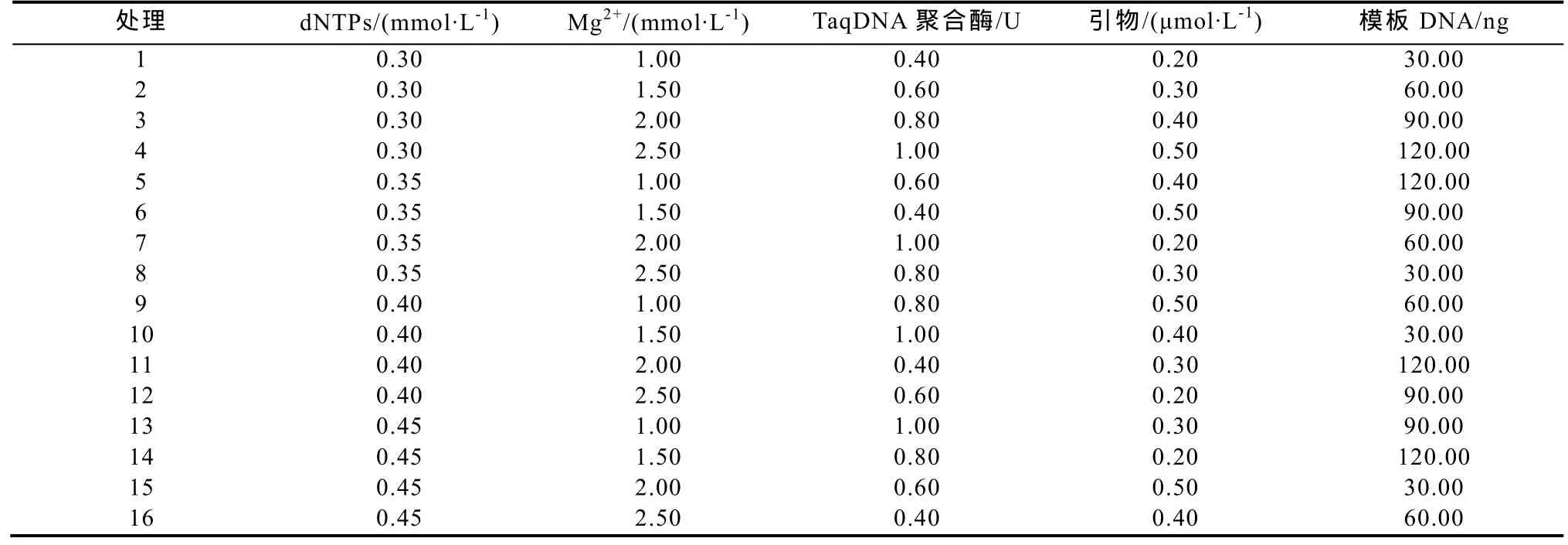
表3 SRAP-PCR反应中各因素水平L16(45)正交试验设计Table3 L16(45) orthogonal design of factors and levels for the SRAP-PCR
1.2.3 SRAP-PCR扩增 按照L16(45)正交试验设计16个处理,重复2次。根据表3制备总体积为20 μL的PCR反应体系。反应程序为:94 ℃预变性5 min;前 5 个循环为 94 ℃变性 45 s,34 ℃退火 45 s,72 ℃延伸1 min;后35个循环仅将退火温度变为57 ℃;循环结束后,72 ℃延伸10 min,4 ℃保存。扩增产物用6%聚丙烯酰胺凝胶电泳观测。
1.2.4 退火温度及循环次数的筛选 在正交试验的基础上,对SRAP反应的退火温度和循环次数进行优化筛选试验。退火温度梯度试验设计 11个梯度处理,即48、49、50、51、52、53、54、55、56、57、58 ℃。在退火温度梯度试验的基础上,进行了循环次数的筛选,设置了9个处理,每个处理重复2次:(1)52 ℃,30循环;(2)55 ℃,30循环;(3)57 ℃,30 循环;(4)52 ℃,35 循环;(5)55 ℃,35 循环;(6)57 ℃,35 循环;(7)52 ℃,40循环;(8)55 ℃,40循环;(9)57 ℃,40循环。
2 结 果
2.1 基因组DNA的提取
基因组提取使用北京天根生化科技有限公司的新型植物DNA提取试剂盒,经核酸检测仪检验结果表明,所提取基因组的OD值为1.8~2.0,并且浓度较高。通过琼脂糖电泳进一步检测(图1),点样孔附近有明显的亮带聚集产生,并且没有拖尾现象,表明所提取的基因组纯度较好,质量较高。
2.2 SRAP-PCR反应体系正交设计的优化
正交试验设计按照表3的16个处理进行SRAP-PCR扩增试验,将得到的扩增产物进行电泳分析(图2),可以看出处理1、2没有条带;处理3、4、5、12、13、14、15、16条带较少,清晰度较差;处理 8、9、10、11的条带较多,且亮度和清晰度较好,其中以处理11效果最好。
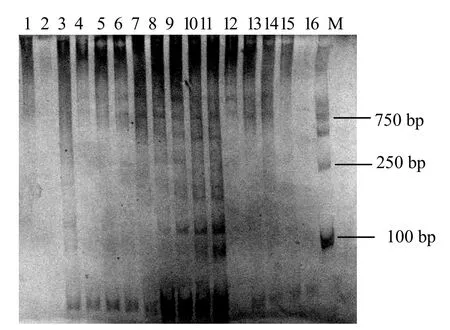
图2 正交试验SRAP-PCR产物电泳结果Fig.2 Electrophoresis results of SRAP - PCR product by orthogonal experiment
参照张丽等[10]的统计方法,对 16个组合正交试验结果进行分析(表4),从k值结果可以看出,dNTPs以k3最佳,Mg2+以k3最佳,Taq DNA聚合酶也以k3最佳,引物以k2最佳,模板DNA以k4最佳,即dNTPs 0.4 mmol/L,Mg2+2.0 mmol/L,Taq DNA聚合酶0.8 U,引物0.3 mmol/L,模板DNA 120 ng。该结果与处理11相近,仅在Taq DNA聚合酶水平略有差异,从而认为处理11为最佳组合,即20 μL体系中,最佳加入量分别为:dNTPs(2.5 mmol/L)3.2 μL、Mg2+(25 mmol/L)1.6 μL、Taq DNA聚合酶(2.5 U/μL)0.16 μL、引物(10 μmol/L)0.6 μL、DNA模板120 ng。从R值的结果来看,dNTPs对扩增结果影响最大,Taq DNA聚合酶和引物影响次之,模板DNA和Mg2+影响相比较弱。从扩增结果较好的处理8、9、11看,模板DNA的量分别是30、60、120 ng,表明模板DNA的试用范围较广。
2.3 退火温度及循环次数
退火温度梯度试验设计11个处理即48~58 ℃。从图3中可以看出,退火温度的不同对SRAP扩增条带有较大影响,以处理5(52 ℃)、处理8(55 ℃)和处理10(57 ℃)条带较亮,其中以处理10扩增条带丰富,亮度最佳。
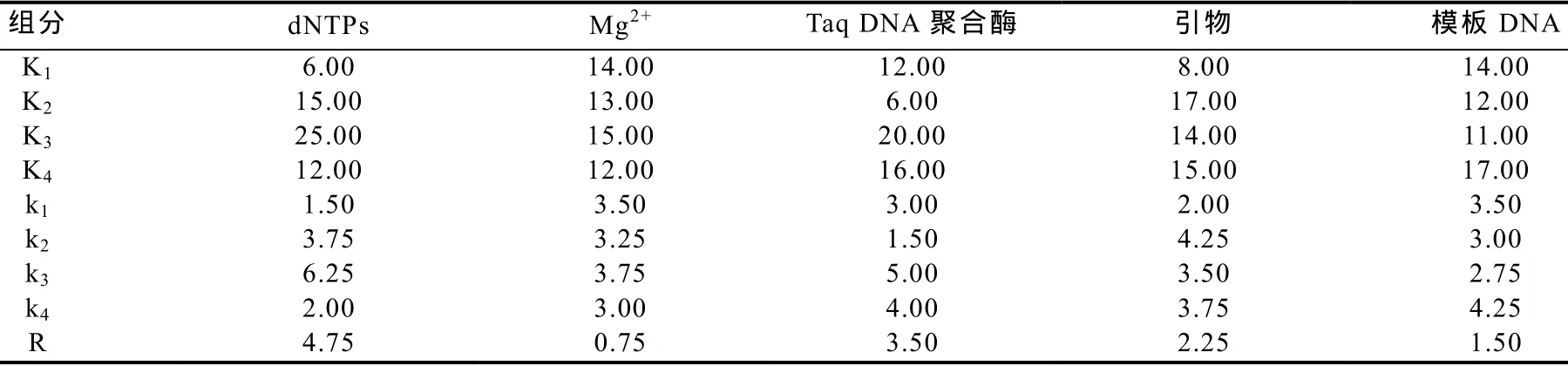
表4 SRAP正交试验结果统计分析Table4 Statistic result of orthogonal experiment
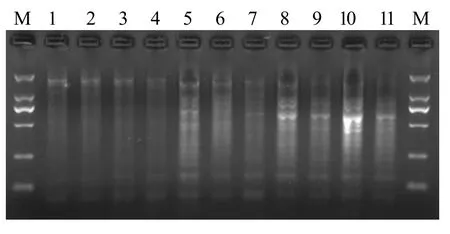
图3 不同退火温度对SRAP-PCR产物电泳结果的影响Fig.3 The electrophoresis results of SRAP - PCR product in different annealing temperatures affect
在对退火温度筛选研究的基础上,对循环次数进行了优化筛选,循环次数由30次增加到40次,设置9个处理,重复2次。从图4中可以看出,循环次数30次条带几乎没有或者不亮,而在35次和40次时条带较好。在不同温度、循环次数相同时比较,温度越高条带越清晰,且扩增条带增多。但在相同温度、不同循环次数比较时,30次和40次时条带较弱或者模糊,35次时条带较亮且多态性较好。从整个电泳结果来看,以处理3结果最好,即退火温度57 ℃,循环次数35次。
3 讨 论

图4 同退火温度和循环次数的SRAP-PCR产物电泳结果Fig.4 Electrophoresis results of SRAP-PCR products with different annealing temperatures and cycles
SRAP-PCR的反应体系不仅受到材料差异的影响,而且引物的不同、试验仪器的不同也会对反应体系造成一定的影响。本试验中试验材料为突变株SN01,为研究突变株SN01的抗病基因,通过引物筛选选用条带清晰且数量较多的引物组合,并在使用此引物的基础上,对SRAP-PCR体系进行优化。PCR反应体系的合适与否直接影响其扩增的结果,目前对 PCR体系优化的方法以正交试验和单因素设计试验较多,正交试验方法可以减少试验次数,缩短试验周期,降低研究成本,可迅速快捷的找到优化的方案。单因素试验可直观快速地明确各因素对PCR的影响,但忽略了各因素间的相互作用[11]。对于PCR产物电泳结果的分析,主要是直观法和统计分析法两种方法评价分析,这两种方法都有一定的主观性,在扩增条带结果统计过程中难免会有人为因素的影响。
在PCR反应中,不同的引物在反应中要求退火温度也有所不同,退火温度过高或者过低都会影响到产物的产量或质量,因此本试验在初步筛选引物后进行了梯度退火实验,并对循环次数进行了筛选,得到了最佳的PCR反应体系。
4 结 论
本研究以烟草抗PVYN突变株SN01为材料,通过正交试验设计对其SRAP的反应体系进行了优化,并且对退火温度和循环次数进行了筛选,得出烟草突变株SN01的SRAP最佳反应体系dNTPs(2.5 mmol/L)3.2 μL、Mg2+(25 mmol/L)1.6 μL、Taq DNA聚合酶(2.5 U/μL)0.16 μL、引物(10 μmol/L)0.6 μL、DNA模板120 ng。SRAP-PCR的最佳反应程序为:94 ℃预变性5 min;前5个循环为94 ℃变性45 s,34 ℃退火45 s,72 ℃延伸1 min;后35个循环将退火温度变为57 ℃;循环结束后,72 ℃延伸10 min,4 ℃保存。该优化体系的建立,为进一步对烟草PVYN突变株SN01的抗病基因研究提供了可靠的基础。
[1]Li G, Quiros C F.Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction∶ Its application to mapping and gene tagging in Brassica [J].Theoretical and Applied Genetics,2001, 103∶ 455-461.
[2]张慧,张淑江,李菲,等.大白菜隐性细胞核雄性不育恢复基因BrMsf3的标记[J].中国蔬菜,2011,17(4):13-16.
[3]李清峰,马守才,王志军,等.基于SRAP的小麦籽粒性状QTL定位[J].华北农学报,2012,27(5):72-79.
[4]程志学,陈清华,彭庆务,等.节瓜分子遗传图谱的构建与始雌花节位性状定位[J].中国农业科学,2010,43(7):1508-1515.
[5]王强,张新友,汤丰收,等.基于SRAP分子标记的栽培种花生遗传连锁图谱构建[J].中国油料作物学报,2010,32(3):374-378.
[6]陈晖,陈美霞,陶爱芬,等.长果种黄麻SRAP标记遗传连锁图谱的构建及3个质量性状基因定位[J].中国农业科学,2011,44(12):2422-2430.
[7]哈矿武,张慧玲,柳剑丽,等.甜瓜高代自交系 4G21抗蔓枯病基因的分子定位[J].园艺学报,2010,37(7):1079-1084.
[8]邸青,张淑江,章时蕃,等.大白菜缘枯病抗性基因的SRAP标记筛选[J].中国蔬菜,2010,17(4):13-16.
[9]由书妍,吴元华,赵秀香,等.抗 PVYN烟草突变株SN01的筛选及其生理生化特性[J].烟草科技,2009(8):61-64.
[10]张丽,周兰英,肖千文,等.正交试验设计在建立杜鹃花RAPD-PCR反应体系中的应用[J].北方园艺,2007(5):124-126.
[11]王方,袁庆华.冰草ISSR-PCR反应体系的建立与优化[J].草地学报,2009,17(3):254-357.

