HHEX基因rs1111875G/A多态性与妊娠糖尿病的关系
何明明,班 博,张 梅,李 萍,孙海玲,潘耀平,王艳萍
(1天津医科大学研究生院,天津300070;2济宁医学院附属医院)
妊娠糖尿病 是指妊娠过程中发生或首次发现的任何程度的糖耐量异常,其发病机制涉及胰岛素分泌缺陷及胰岛素抵抗。目前认为其与2型糖尿病(T2DM)相似,亦是遗传基因和环境因素共同作用的结果。T2DM家族史增加了妊娠妇女发生GDM的风险[1],GDM妇女产后发生T2DM的风险亦显著升高(RR=7.43)[2],此均提示 GDM 和T2DM有相同的遗传发病基础。已有研究证实2007年GWAS发现的部分T2DM易感基因与GDM的发病风险增加相关[3,4],但造血干细胞表达同源盒(HHEX)基因rs1111875与中国人群GDM发病的相关性尚不明确。2010年10月~2012年3月,我们采用聚合酶链反应—限制性片段长度多态性(PCRRFLP)方法对451例妊娠妇女HHEX基因rs1111875的单核苷酸多态性(SNP)进行了检测,旨在探讨其与GDM的相关性及可能的作用机制。(GDM)
1 资料与方法
1.1 临床资料 24~28周妊娠期妇女451例,年龄22~43岁。行75 g口服葡萄糖耐量试验(OGTT)并留取空腹、糖负荷后1 h及2 h血糖,同时采集身高、孕前体质量、血压[收缩压(SBP)、舒张压(DBP)],并计算孕前 BMI=体质量/身高2(kg/m2)。采用胰岛β细胞分泌功能指数(HOMA-B)和稳态模型胰岛素抵抗指数(HOMA-IR)评估胰岛β细胞功能及胰岛素抵抗,计算方法:HOMA-B=20×空腹胰岛素(FINS)/(FPG-3.5),HOMA-IR=FPG×FNS/22.5。采用葡萄糖氧化酶法测定血糖,化学发光法测定血清FINS,在全自动生化分析仪上测定血脂。采用2011年美国糖尿病学会(ADA)诊断标准[空腹血糖(FPG)≥5.1 mmol/L,糖负荷后1 h PG≥10.0 mmol/L,糖负荷后2 h≥8.5 mmol/L,其中1项符合者将被诊断为GDM][5]。符合诊断标准者(203例)纳入GDM组,不符合者(248例)纳入糖耐量正常(NGT)组,个体间均无血缘关系。排除标准:其他类型糖尿病及其合并妊娠者;肝肾功能不全(丙氨酸转氨酶>正常上限的2倍,血肌酐>正常上限的1.2倍)及合并慢性炎性疾病者。所有研究对象均签署知情同意书,研究方案经医院伦理委员会批准。
1.2 HHEX基因rs1111875G/A多态性检测方法受试者禁食8~10 h以上,抽取肘静脉血1 mL抗凝,存放于-20℃冰箱用于提取全血基因组。采用血液基因组提取试剂盒(0.1~1.0 mL)提取DNA(北京天根生化科技有限公司)。引物应用Primer Premer5.0设计,由上海生工生物工程有限公司合成,DL1000 DNA Marker由大连宝生物工程有限公司提供。上游引物序列为5'-AAC ATC TAA ACA AGG GGC AG-3',下游引物序列为5'-TTT TCC CTT TCA GAC TTG GC-3'。PCR 反应体系为50 μL:PCR Master Mix(2×)25 μL;上游及下游引物(浓度100 μmol/L)各 0.2 μL;模板 DNA 3 μL;ddH2O(nuclease-free)21.8 μL。PCR反应条件:95℃预变性5min,95 ℃变性 30 s,57 ℃退火 30 s,72 ℃延伸1min,35个循环,最后72℃延伸7min。用2%的琼脂糖凝胶进行电泳,Tanon-3500凝胶成像系统观察结果。PCR产物酶切反应体系20 μL:10×NEB-uffer4缓冲液2 μL;PCR 产物 10 μL;100×BSA 为0.2 μL;XbaI 0.5 μL;灭菌双蒸水 7.5 μL。内切酶(XbaI)由北京NEB公司提供。条件:恒温水浴锅37℃水浴5 h。用3%的琼脂糖凝胶进行电泳,Tanon-3500凝胶成像系统观测结果。选取部分PCR产物至生工生物工程(上海)有限公司进行基因测序。
1.3 统计学方法 采用SPSS13.0统计软件。以Hardy-Weinberg平衡法检验各组基因的平衡代表性。正态分布的计量资料采用±s表示,非正态分布资料经对数转换为正态分布资料后进行分析。组间比较采用方差分析,多重比较采用LSD法。各组间基因型分布及等位基因频率比较采用χ2检验,Logistic回归分析基因与疾病的相关性,并以优势比(OR)表示。P≤0.05为差异有统计学意义。
2 结果
2.1 目的基因扩增、酶切及测序结果 HHEX基因rs1111875位点PCR扩增产物为长583 bp的片段(见图1)。应用XbaI进行酶切,因携带G等位基因的目的片段不含XbaI的酶切位点,所以GG基因型酶切后显示一条片段:583 bp,GA基因型显示三条片段:583 bp、400 bp、183 bp,AA 基因型显示两条片段:400 bp和 183 bp(见图2)。测序结果证实HHEXrs1111875位点有GG、GA、AA三种基因型,且酶切结果符合率为100%。
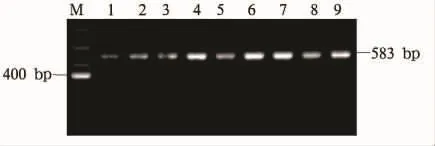
图1 rs1111875 PCR产物
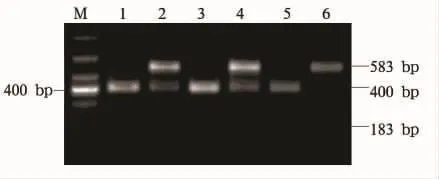
图2 rs13266634多态性酶切结果
2.2 HHEX基因rs1111875单核苷酸多态性分析rs1111875基因型频率在GDM组和NGT组均符Hardy-Weinberg平衡(P均>0.05),提示本研究人群能代表群体分布情况。GDM组GG、GA、AA基因型频率分别为9.9%、42.4%、47.8%,NGT组分别为4.0%、40.7%、55.2%,两组比较,P均 <0.05。GDM组G、A等位基因频率分别为31.0%、69.0%,NGT组分别为24.4%、75.6%,两组比较,P<0.05。G等位基因携带者患GDM的风险是A等位基因的1.40倍(OR=1.395,95%CI为1.040~1.871,P=0.026)。
2.3 HHEX基因rs1111875三种基因型间临床资料及生化指标比较 GG、GA和AA基因型之间,年龄、孕前 BMI、DBP、FPG、2 h PG、TG、TCH 、HDL-C、LDL-C、VLDL-C、HOMA-IR的差异均无统计学意义(P均>0.05),其余生化指标比较见表1。
表1 各基因型间生化指标比较(±s)

表1 各基因型间生化指标比较(±s)
注:与GG基因型比较,*P<0.01;与GA基因型比较,△P<0.05;FINS、HOMA-B均经对数转换
基因型 n 1 h PG(mmol/L)FINS(mU/L) HOMA-B SBP(mmHg)GG 30 9.7±2.7 2.37±0.30 5.02±0.64 123±13 GA 187 8.9±2.7 2.52±0.27 5.33±0.62 119±11 AA 234 8.3±2.7* 2.52±0.26* 5.37±0.55* 122±12△
2.4 Logistic回归分析GDM发生的危险因素 以是否发生GDM为因变量,以年龄、孕前BMI、舒张压、rs1111875基因型为自变量进行二元Logistic回归分析,结果显示GA基因型患GDM的危险度增加,为AA基因型的1.32倍,但差异无统计学意义(OR=1.320,95%CI为0.838~2.077,P=0.231),GG基因型者患GDM的风险是AA基因型的4.1倍(OR=4.129,95%CI为 1.589~ 10.731,P=0.004),且独立于年龄、孕前 BMI、舒张压;年龄增大、孕前BMI升高和DBP升高均为GDM发生的危险因素(OR=1.062~1.387,P 均 <0.01),见表2。

表2 Logistic回归分析GDM的独立危险因素
3 讨论
HHEX基因位于人类10号染色体q23.33长270kb的连锁不平衡区,该区域包括三个基因:胰岛素降解酶(insulin-degrading enzyme,IDE)基因,驱动蛋白家族成员 11(kinesin family member 11,KIF11)基因和 HHEX基因。2007年Slake等[6]发现HHEX-KIF11-IDE区与T2DM有关的基因变异位于HHEX基因的3'端,其中包括rs1111875位点G/A单核苷酸多态性。随后,多项研究证实了HHEX基因rs1111875G/A多态性与T2DM的相关性[7~9],Cho等[3]和 Lauenborg 等[4]还报道了 HHEX 基因rs1111875单核苷酸多态性与GDM的发病风险升高有关。
本研究显示HHEX基因rs1111875基因型频率分布在GDM组和NGT组明显不同,这提示HHEX基因rs1111875的三种基因型(GG、GA、AA)与山东济宁地区GDM的发生有关。GDM组中G等位基因、GG基因型频率均显著高于NGT组,G等位基因携带者发生GDM的风险是非携带者的1.40倍(OR=1.395,95%CI为1.040~1.871,P=0.026),提示G等位基因可能是GDM的风险等位基因,HHEX基因rs1111875G/A多态性可能与山东济宁地区GDM有关,此与韩国[3]和丹麦[4]报道的结果相一致。本研究GDM组中GG基因型频率与韩国人群相似[3](9.9% vs 11.8%),但 明 显 低 于 丹 麦 人 群[4](37.6%),推测基因型频率的不同可能与种族差异及样本量大小有关。Logistic回归分析显示GG基因型为GDM的危险因素,GG基因型携带者患GDM的风险是 AA型的 4.1倍(OR=4.129,95%CI为1.589~10.731,P=0.004),且独立于年龄、孕前BMI和DBP,这提示携带GG基因型者患GDM的风险将大大增加。
GG基因型与AA基因型相比,1 h PG显著升高(P<0.01),而FINS和HOMA-B显著降低(P均<0.01),这提示HHEX基因rs1111875的G等位基因使山东济宁地区GDM发病风险升高可能是通过减少胰岛素分泌实现的。HHEX基因编码的转录因子高表达于胚胎和成熟的胰腺中,并参与Wnt信号转导通路,调节胰腺β细胞的生长和功能[10,11]。研究表明敲除该基因后,内胚层上皮细胞增殖受损,最终影响胰腺胚芽的发生与形态[10]。因该部分胰腺是胰多肽产生的部位,因此HHEX单核苷酸多态性可能影响胚胎期或成年期激素的产生,并影响胰岛素的释放。据此推测携带GG基因型可能使胰岛β细胞功能受损,胰岛素分泌减低,进而引起血糖升高。此外,本研究未发现HHEX基因rs1111875G/A多态性与GDM患者胰岛素抵抗存在相关性。
综上所述,HHEX基因rs1111875G/A多态性与山东济宁地区GDM的发生有关,G等位基因可能是其风险等位基因,GG基因型可能与GDM患者胰岛素分泌量减低有关,但其具体机制尚不明确。因此,仍需进一步深入研究HHEX基因rs1111875G/A多态性与GDM发病相关的作用机制。
[1]Retnakaran R,Connelly PW,Sermer M,et al.The impact of family history of diabetes on risk factors for gestational diabetes[J].Clinical Endocrinol(Oxf),2007,67(5):754-760.
[2]Bellamy L,Casas JP,Hingorani AD,et al.Type 2 diabetes mellitus after gestational diabetes:a systematic review and meta-analysis[J].Lancet,2009,373(9677):1773-1779.
[3]Cho YM,Kim TH,Lim S,et al.Type 2 diabetes-associated genetic variants discoveredin the recent genome-wide association studies are related to gestational diabetes mellitus in the Korean population[J].Diabetologia,2009,52(2):253-261.
[4]Lauenborg J,Grarup N,Damm P,et al.Common type 2 diabetes risk gene variants associate with gestational diabetes[J].Clin Endocrinol Metab,2009,94(1):145-150.
[5]American Diabetes Association.Standards of Medical Care in Diabetes-2011[J].Diabetes Care,2011,34(suppl 1):S11-S61.
[6]Sladek R,Rocheleau G,Rung J,et al.A genome-wide association study identifies novel risk loci for type 2 diabetes[J].Nature,2007,445(7130):881-885.
[7]Wu Y,Li H,Loos RJ,et al.Common variants in CDKAL1,CDKN2A/B,IGF2BP2,SLC30A8,and HHEX/IDE genes are associated with type 2 diabetes and impaired fasting glucose in a Chinese Han population[J].Diabetes,2008,57(10):2834-2842.
[8]Ng MC,Park KS,Oh B,et al.Implication of genetic variants near TCF7L2,SLC30A8,HHEX,CDKAL,CDKN2A/B,IGF2BP2,and FTO in type 2 diabetes and obesity in 6719 Asians[J].Diabetes,2008,57(8):2226-2233.
[9]Tan JT,Ng DP,Nurbaya S,et al.Polymorphisms identified through genome-wide association studies and their associations with type 2 diabetes in Chinese,Malays,and Asian-Indians in Singapore[J].J Clin Endocrinol Metab,2010,95(1):390-397.
[10]Bort R,Martinez-Barbera JP,Beddington RS,et al.Hex homeobox gene-dependent tissue positioning is required for organogenesis of the ventral pancreas[J].Development,2004,131(4):797-806.
[11]Foley AC,Mercola M.Heart induction by Wnt antagonists depends on the homeodo-main transcription factor Hex[J].Genes Dev,2005,19(3):387-396.

