1H-1,2,3-三唑类化合物的合成研究进展
陈 颖 崔冬梅
(浙江工业大学药学院,浙江 杭州 310014)
1H-1,2,3-三唑类化合物是一类重要的氮杂环化合物,易形成氢键和配位键,能形成多种分子间的相互作用。由于其特殊的结构,因而具有广泛的生物活性,包括抗癌活性[1],抗菌活性[2],抗病毒活性[3],抗HIV活性,选择性β3-肾上腺素受体的抑制作用,以及有效的抗组织胺活性等。同时,三唑类化合物在农药[4]和工业方面都有广泛的应用。随着click(点击)化学的提出与发展,制备1H-1,2,3-三唑类化合物变得极为简便。而寻求更加绿色有效的Cu(I)催化下Huisgen反应条件的摸索成为现代科学工作者探究的重点。本文对1,4-取代的1H-1,2,3-三唑类化合物的合成方法的相关文献进行综述。
1 合成方法
合成1,4-取代的1H-1,2,3-三唑类化合物的方法主要有以下几类:
1.1 以有机叠氮化物为原料进行制备

2004 年,Timothy R.Chan 等人[6]报道了 Cu(Ⅰ)-TBTA稳定配体催化1,2,3-三唑化合物的合成。该反应采用了水作为溶剂,体现了绿色化学的精神。
2005 年,Zhang Li等人[7]报道了钌催化炔/叠氮化合物的环加成反应。该反应不仅使用了末端炔,还实现了内部炔的反应,得到了1,4,5-取代的三唑化合物。
2008年Silvia Diez-Gonzlez等人[8]报道了[(NHC)2Cu]X(NHC=N-杂环卡宾;X=PF6,BF4)作为催化剂的反应。该反应条件温和,使用水相或无溶剂反应,催化剂量少,仅为0.5~2mol%,且能循环利用。
该类反应还用到别的很多催化剂,如[CuBr(PPh3)3][9],CuSO4·H2O/抗坏血酸钠[10],Zn/C 催化[11],纳米铜[12]等。此类反应的缺点是叠氮化合物化学性质活泼,大多数叠氮化合物为易爆物质。芳基叠氮化合物撞击时易爆,熔化时可分解,释出HN3。叠氮化物为神经毒物,对人体有一定的影响。而且催化剂一般为一次性催化,有些还难于制备。
1.2 以卤代物为原料进行制备

该反应是Click化学中的一个经典反应,即CuAAC反应,一锅法两步制备,经1,3-偶极环加成反应得到产物。该方法减少了叠氮化物分离的一步,相对增加了反应的安全性。
2004 年,Prasad Appukkuttan 等人[13]报道了微波法经Cu(Ⅰ)催化三组分制备三唑化合物的方法。该反应使用了Cu(0)和CuSO4的反歧化作用来得到Cu(Ⅰ),反应溶剂使用叔丁醇和水,反应时间仅为几十分钟,125℃的高温下得到了>90%的收率和100%的区域选择性的1,4-取代的1,2,3-三唑化合物。
在这个经典反应的基础上,前人又对其进行了一些完善。Valérie Bénéteau 等人[14]报道了沸石-Cu催化该反应,即将Cu(Ⅰ)固定在沸石上,这就有利于催化剂的循环利用,一般来说反应循环四次基本不会影响催化效果。该反应的原子利用率较高,并且在水相中反应,真正实现了绿色化的过程。Dilip Raut等人[15]则报道了采用纳米铜作为催化剂的CuAAC反应。该反应是在离子液中进行,并且采用了室温搅拌的温和条件。缺点是纳米铜制作过程比较复杂,而且不易分离,重复利用比较困难。Sreedhar B等人[16]改进了实验方法,采用超声来进行反应。在CuI的催化下,在水相中仅需几十分钟就能完成反应,并且收率较好。
1.3 以苯胺为原料进行制备

2007 年,Henning S G Beckmann 等人[17]报道了以苯胺为原料,通过重氮基转移一锅法制备1H-1,2,3-三唑类化合物。该反应通过Cu(Ⅱ)催化重氮基的转移,然后在抗坏血酸钠的还原作用下,得到的Cu(Ⅰ)催化炔/叠氮的1,3-偶极环加成。该反应通过一锅两步进行制备,不需要分离出叠氮化物而直接进行下一步的环加成,收率高,适用范围广。
2008 年,Adam D.Moorhouse 等人[18]在上述反应的基础上,使用了亚硝酸叔丁酯(t-BuONO)来作为重氮化试剂,TMSN3来进行叠氮化,并且使用80℃的微波来进行反应,该反应条件比较温和,反应时间也较短,收率也较高。
1.4 以金属乙炔化合物为原料进行制备
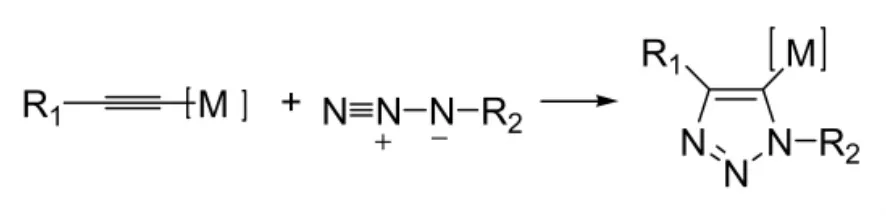
2010年,Zhou Yuhan等人[19]报道了通过有机叠氮化合物和金属乙炔化合物经过[2+3]环加成反应,得到1,4-二取代的1,2,3-三唑化合物。该反应也需要CuI的催化作用,同时也需要一定的配体,如PMDTA(N,N,N',N',N''-五甲基二乙烯三胺),以甲苯或四氢呋喃为溶剂,在室温下反应48 h,收率一般在90%左右。
1.5 以苯磺酰肼为原料进行制备

2004年,Makam S等人[20]以苯磺酰肼为原料,首先与1,1-二氯丙酮反应,得到α-二氯羰基磺酰腙,再与胺反应,得到1,4-取代的三唑类化合物。这个反应通过两步进行反应,收率一般在10%~60%左右,而且反应时间较长。
1.6 以醇为原料进行制备
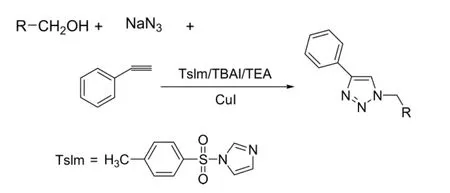
2011年,Zhang Jian等人[21]以醇为原料,在Tslm(N-对甲苯磺酰基咪唑),TBAI(N,N,N-三丁基-1-丁胺碘化物),TEA(三乙胺)存在下,在 CuI的催化下,经环合得到1,4-取代的三唑类化合物。该反应在100℃反应10 h,收率一般能达到70%~90%。
1.7 以三甲基硅烷乙炔为原料进行制备
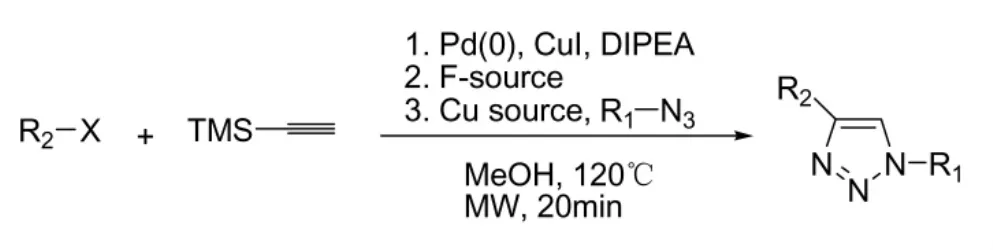
2010 年,Frederic Friscourt等人[22]等人以三甲基硅烷乙炔为原料,在微波的辅助下,一锅三步经Sonogashira交叉偶联——脱三甲基硅基——环加成合成1,4-取代的1,2,3-三唑化合物。该反应时间较短,收率一般在90%以上。
2 小结
综上所述,有关1,4-取代的1H-1,2,3-三唑类化合物的合成方法有一些报道,但仍存在一定的局限性,如催化剂难以回收及循环利用,反应条件比较苛刻,反应溶剂不够绿色化,反应时间较长,原料难以制备,危险性较高等。这些均限制了该类化合物的应用,所以有关1,4-取代的1H-1,2,3-三唑类化合物的高效、绿色合成方法还有待进一步的研究和开发。
[1]Kristin Odlo,Jérémie Fournier-Dit-Chabert,Sylvie Ducki,et al.1,2,3-Triazole analogs of combretastatin A-4 as potential microtubule-binding agents[J].Bioorganic&Medicinal Chemistry,2010,18:6874–6885.
[2]Takashi Saito,Tatsuo Ichinohe,Junya Kanda,et al.Historical cohort study of the efficacy and safety of piperacillin/tazobactam versus fourth -generation cephalosporins for empirical treatment of febrile neutropenia in patients with hematological malignancies[J].International Journal of Clinical Medicine,2011,2:18-22.
[3]Abdalla E A Hassan,Wang Peiyuan,Tamara McBrayer,et al.Synthesis and anti-HCV activity of N9,5'-cyclo-3-(β-D-ribofuranosyl)-8-azapurin-2-one derivatives[J].Nucleosides,Nucleotides,and Nucleic Acids,2005,24:1531–1542.
[4]Messori,Vittorio;Baldi,et al.1,2,3-Triazole derivatives with herbicidal activity[J].Chimica e I'Industria(Milan,Italy)1977,59(6):438-40.
[5]Christian W Tornoe,Caspar Christensen,Morten Melda.Peptidotriazolesonsolidphase:[1,2,3]-triazolesbyregiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides[J].J Org Chem,2002,67:3057-3064.
[6]Timothy R Chan,Robert Hilgraf,K Barry Sharpless,et al.Polytriazoles as copper(I)-stabilizing ligands in catalysis[J].Org Lett,2004,6(17):2853-2855.
[7]Zhang Li,Chen Xinguo,Peng Xue,et al.Rutheniumcatalyzed cycloaddition of alkynes and organic azides[J].J.Am Chem Soc,2005,127:15998-15999.
[8]Silvia Diez-Gonzlez,Steven P Nolan.[(NHC)2Cu]X Complexes as efficient catalysts for azide-alkyne click chemistry at low catalyst loadings[J].Angew Chem Int Ed,2008,47:8881–8884.
[9]Steven Lal,Silvia Díez-Gonzalez.[CuBr(PPh3)3]for azidealkyne cycloaddition reactions under strict click conditions[J].J.Org.Chem.2011,76:2367–2373.
[10]Benjamin R Buckley,Sandra E Dann,Harry Heaney.Heterogeneous catalytic reactions"on water"by using stable polymeric alkynylcopper(I)pre-catalysts:alkyne/azide cycloaddition reactions[J].Eur J Org Chem,2011,4:770–776.
[11]Meng Xu,Xu Xiaoyun,Gao Tingting.Zn/C-catalyzed cycloaddition of azides and aryl alkynes[J].Eur J Org Chem,2010,28:5409–5414.
[12]Francisco Alonso,Yanina Moglie,Gabriel Radivoy,et al.Unsupported coppernanoparticlesin the1,3-dipolar cycloaddition of terminal alkynes and azides[J].Eur J Org Chem,2010,10:1875–1884.
[13]Prasad Appukkuttan,Wim Dehaen,Valery V Fokin,et al.A microwave-assisted click chemistry synthesis of 1,4-disubstituted 1,2,3-triazoles via a copper(I)-catalyzed three-component reaction[J].Org Lett,2004,6(23):4223-4225.
[14]Valérie Bénéteau,Andrea Olmos,Thirupathi Boningari,et al.Zeo-click synthesis:CuI-zeolite-catalyzed one-pot twostep synthesisoftriazolesfrom halidesand related compounds[J].Tetrahedron Letters,2010,51:3673–3677.
[15]Dilip Raut,Karuna Wankhede,Vipraja Vaidya,et al.Copper nanoparticles in ionic liquids:Recyclable and efficient catalytic system for 1,3-dipolar cycloaddition reaction [J].Catalysis Communications,2009,10:1240–1243.
[16]Sreedhar B,Reddy P Surendra.Sonochemical synthesis of 1,4-disubstituted 1,2,3-triazoles in aqueous medium[J].Synthetic Communications,2007,37:805–812.
[17]Henning S G Beckmann,Valentin Wittmann.One-pot procedure for diazo transfer and azide-alkyne cycloaddition:triazole linkages from amines[J].Org Lett,2007,9(1):1-4.
[18]Adam D Moorhouse,John.E Moses.Microwave enhancement of a"one-pot"tandem azidation-"click"cycloaddition of anilines[J].Synlett,2008,14:2089–209222.
[19]Zhou Yuhan,Thomas Lecourt,Laurent Micouin.Direct synthesis of 1,4-disubstituted-5-alumino-1,2,3-triazoles:copper-catalyzed cycloaddition of organic azides and mixed aluminum acetylides[J].Angew Chem Int Ed,2010,49:2607–2610.
[20]Makam S Raghavendra,Yulin Lam.Regiospecific solidphase synthesis of substituted 1,2,3 -triazoles [J].Tetrahedron Letters, 2004,45:6129–6132.
[21]Zhang Jian,Wu Jingjing,Shen Li,et al.Novel synthesis of difluoromethyl-containing 1,4-disubstituted 1,2,3-triazoles via a click–multicomponent reaction and desulfanylation strategy[J].Adv Synth Catal,2011,353:580 – 584.
[22]Frederic Friscourt,Geert-Jan Boons.One-pot three-step synthesis of 1,2,3 -triazoles by copper-catalyzed cycloaddition of azides with alkynes formed by a sonogashira cross-coupling and desilylation[J].Org Lett,12(21):4936-4939.

