脂质沉积性肌病1例
刘爱东, 王 彪, 张黎黎, 武胜昔
(1成都医学院第一附属医院神经内科, 成都 610500; 2第四军医大学基础部人体解剖与组织胚胎学教研室, 西安 710032)
1 临床资料
患者,女,53岁,农民,小学文化,以间断性肢体乏力15个月入院。入院前15个月患者无明显诱因出现双下肢乏力,行走500m左右即需休息3~5min方能继续行走,同时伴颈部酸困不适。乏力进行性加重,13个月前行走10m左右即需要休息,蹲下需扶膝方可站起。当地医院诊断为“多发性神经病?”,给予地塞米松治疗1周,颈部酸困消失,肢体乏力明显好转。6个月前再次出现肢体乏力、颈部酸困不适,行走200~300m即需要休息,同时抬头费力。2个月前蹲下起立、梳头、穿衣困难,行走10余米即需要休息。入院前10余天,起床需帮助,行走需搀扶,抬头不能。无肌肉疼痛、肉跳、皮疹,无发热、心悸、气短、腹痛、恶心及呕吐,无吞咽困难、饮水呛咳,无抽搐、大小便障碍,无家族史。体格检查:内科系统无明显异常。神经系统:胸锁乳突肌、斜方肌肌力Ⅱ级,其他颅神经无异常。全身肌容积正常。颈肌肌力Ⅱ级,双侧三角肌肌力Ⅴ级,肱二头肌Ⅳ级,对掌肌Ⅳ级,分指肌Ⅳ级,髂腰肌Ⅲ级,股四头肌Ⅳ级,四肢肌张力减低,Gowers征阳性,鸭步,无不自主运动,指鼻试验稳准,跟膝胫试验无力,不能完成,感觉无异常,腹壁反射正常。双侧肱二、三头肌腱反射、桡骨膜反射(+),双侧膝腱反射、跟腱反射(-)。Hoffmann征、Babinski征阴性。脑膜刺激征阴性。辅助检查:肾功能、电解质、空腹血糖正常。肝功能:总胆红素11.80(5.10~28.00)µmol/L,直接胆红素2.50(0.00~10.00)µmol/L,谷丙转氨酶77.0(0~40)U/L,谷草转氨酶110.0(0~40)U/L,余正常。红细胞沉降率16mm/h,C反应蛋白正常。肌酶谱:乳酸脱氢酶1533.0(71.0~195.0)U/L,α-羟丁酸脱氢酶1065(0~182)U/L,肌酸激酶225(0~190)U/L,心肌型肌酸激酶同功酶14(0~24)U/L;晨起空腹活动前血乳酸3.79(0.50~1.80)mmol/L;血清叶酸2.10(7.20~15.40)µg/L,维生素B12含量正常;甲状腺功能、肿瘤系列、脑脊液正常;新斯的明试验(-)。神经电生理:股四头肌、胫前肌、肱二头肌针极肌电图未见异常;运动神经传导速度:腓总神经远端潜伏期延长(右5.1ms,左5.2ms),传导速度正常低限(40.8m/s),左腓总神经动作电位波幅降低(3.1mV);双侧正中神经、尺神经、胫神经运动传导速度正常,无传导阻滞;双侧正中神经、尺神经、腓肠神经感觉神经传导速度正常;双侧胫神经、正中神经及尺神经F波潜伏期及出现率均在正常范围;重复神经电刺激、低频刺激未见波幅递减,高频刺激未见波幅递增。视、听、体感诱发电位正常。四肢血管B超显示:双侧腋、桡、肘、股总、股深、股浅、腘、胫前及胫后动脉管腔内径正常,内膜光滑,血液回流畅通,未见明显异常血流信号,双侧股总、股浅、腘、胫前及胫后静脉管腔内未见明显异常回声。
肌肉活检:取材,左侧三角肌。观察方法:肌肉组织化学检查、光学显微镜检查、电子显微镜检查。切片染色方法:苏木精-伊红(HE)、改良Gomori三色(MGT)、高碘酸Schiff反应(PAS)、油红“O”染色(ORO)、肌纤维ATPase染色和还原型辅酶I四氮唑还原酶染色(NADH-TR)。HE和改良Gomori染色结果观察到在肌质内和肌膜下有大量散在的大小不等的圆形空泡或缺损(图1A,1B);NADH-TR染色结果观察到含有大量脂肪滴的肌纤维氧化酶呈现颗粒状或虫蚀样(图1C),细小空泡,呈筛孔状,内含脂肪滴;PAS染色证实糖原含量未见增多(图1D)。ORO染色观察到异常的脂滴颗粒(图2A),油红染色时深染,空泡纤维在Ⅰ型纤维中更为显著;ATPase染色观察到Ⅰ型、Ⅱ型肌纤维呈镶嵌式分布(图2B);电子显微镜下观察到大小不一的脂滴在肌原纤维间或在肌膜下堆积(图2C,2D),空泡成串纵行排列或扎堆成团分布,周围肌丝结构受挤压变细,未见明显肌细胞萎缩、坏死、再生现象,以及明显炎症细胞浸润,符合脂质沉积性肌病(lipid storage myopathy,LSM)改变。给予地塞米松5mg静滴1次/d,12d后症状明显好转,改为晨起空腹口服强的松30mg/d,口服13d后生活可以自理,嘱每20d减量5mg,2个月后随诊,患者基本恢复正常。
2 讨 论
LSM主要是由于肉毒碱棕榈酰基转移酶的缺陷和转运障碍,或肉毒碱缺乏使长链脂肪或脂酰辅酶A无法进入线粒体内膜,导致能量代谢障碍使脂质积累在肌细胞所致的一组肌病[1]。

图1 肌纤维细胞膜完整,线粒体染色未见异常,未见糖原累积Figure 1 Muscle fiberoblast membrane is complete, and mitochondrial staining is normal with no visible deposit of glycogen
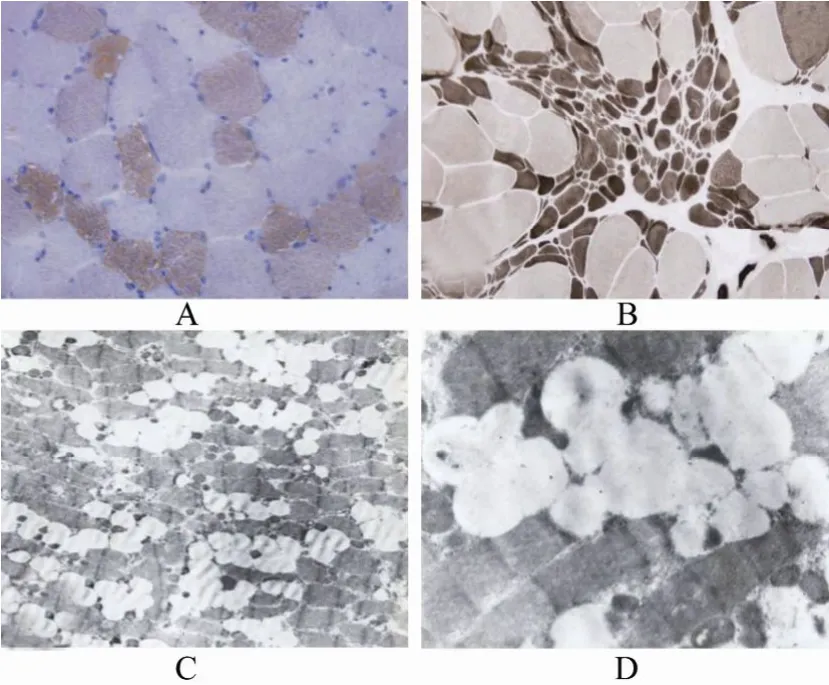
图2 Ⅰ型和Ⅱ型肌纤维的脂肪沉积Figure 2 Deposit of fat granules in type Ⅰ and Ⅱ muscle fiber
2.1 LSM诊断要点
2.1.1 临床特点 肌无力呈进行性加重,近端重于远端;活动后加重,发作性或LSM波动性,可自发缓解;可有肌肉萎缩。激素治疗可使部分患者的症状和肌酶谱在短期内恢复[1]。
2.1.2 实验室检查 血清肌酶升高。肌电图示肌源性损害,可合并神经源性损害,本例患者股四头肌、胫前肌、肱二头肌针极肌电图未见异常,不符合肌病的电生理特点;腓总神经远端潜伏期延长,传导速度为正常低限,动作电位波幅降低,显示周围神经受损,原因是周围神经受累可使肌电图失去特征性肌源性损害的特点,甚至出现神经源性损害的征象,这也是本病易误诊的主要原因之一。周围神经受累的机制可能与脂质累及雪旺细胞有关,导致髓鞘损害使神经传导速度减慢,动作电位波幅降低[2],针极肌电图也可表现正常[3]。肌肉活检显示病理特征性改变为肌纤维内出现较多细小筛孔状、裂隙状空泡,有些融合成较大空泡,部分肌纤维可完全被空泡代替,泡内含脂滴,油红染色时深染,脂滴平行或成簇状排列,病变主要在I型纤维中,病情严重时肌纤维变性、再生、坏死。脂滴增多可同时伴有线粒体增多,存在破碎红纤维(ragged red fibers,RRF)以及纤维细胞色素C氧化酶(COX)染色脱失,部分病例可见线粒体内晶格状包涵体,提示合并线粒体功能异常。肌肉型肉毒碱棕榈酰转移酶Ⅱ缺乏症,约20%的患者骨骼肌中出现脂肪颗粒沉积,50%患者骨骼肌结构正常;酶学检查、基因筛查和串联质谱分析检测血浆肉毒碱和脂酰肉毒碱水平可区分LSM亚型[3]。
2.2 LSM鉴别诊断
因临床表现及生化检查的异质性,故LSM需和以下疾病相鉴别。(1)多发性肌炎。可有LSM临床表现及酶学改变,但肌肉活检常有肌纤维变性坏死与炎细胞浸润,无I型纤维内的脂质沉积。(2)肢带型肌营养不良。近端肌无力较远端严重;肌酶谱异常升高;肌电图示肌源性损害;病理检查显示:肌纤维大小不一,脂肪结缔组织增生,可见肌纤维坏死和再生,可见散在嗜酸性肥大肌纤维。(3)重症肌无力。患者出现肌肉的不耐疲劳性,与LSM临床表现相似;但胆碱酯酶抑制剂治疗有效;病理检查:电镜下可见神经肌肉接头的突触间隙加宽,突触后膜皱褶变浅并且数量减少,免疫电镜检查可见突触后膜崩解,肌纤维本身变化不明显。(4)糖原沉积性肌病。临床表现可与LSM相似[4];糖原沉积性肌病病理检查显示:PAS染色显示两型肌纤维均含弥漫性成堆的阳性颗粒,肌丝排列紊乱,其间见大量糖原颗粒聚集,肌膜下较多糖原颗粒。(5)线粒体脑肌病。骨骼肌也出现极度不能耐受疲劳,神经系统还可出现眼外肌麻痹、肌阵挛、共济失调、智能障碍以及视神经病变等;肌肉活检病理:MGT染色可见RRF,HE染色切片可见散在单个深染颗粒,粗的异常纤维,电镜观察可见在肌膜下线粒体异常增多,并可见晶格状结构形态异常的线粒体包涵体。
2.3 LSM发病机制
运动需要的能量主要来源线粒体脂肪酸氧化,脂肪酸在脂酰辅酶A合成酶作用下活化为脂酰辅酶A。中、短链脂酰辅酶A可直接进入线粒体,而长链脂酰辅酶A需在肉毒碱棕榈酰转移酶I的催化作用下与肉毒碱结合成为脂酰肉毒碱,由肉毒碱棕榈酰转移酶运载进入线粒体。在线粒体内膜内侧面肉毒碱棕榈酰转移酶Ⅱ催化脂酰肉毒碱分离为肉毒碱和脂酰辅酶A。长链脂酰辅酶A进入线粒体,需要有足够的肉毒碱,参与的酶类包括脂酰辅酶A脱氢酶、烯酰辅酶A水合酶、p-羟脂酰辅酶A脱氢酶和p-酮脂酰辅酶A硫解酶等。LSM是在脂肪酸氧化过程中的某一或多个环节出现问题从而导致脂肪酸氧化障碍引起脂质沉积[5]。
2.4 LSM分类
根据LSM生化缺陷,分为以下4类[5−8]。(1)肉毒碱棕榈酰转移酶缺乏症。为肌肉型肉毒碱棕榈酰转移酶Ⅱ缺乏,常染色体隐性遗传,是临床常见的脂肪酸氧化障碍,约占60%,分为3个亚型。①新生儿型:为致死性疾病;②婴儿型:严重的多系统受累;③儿童或成人型即肌肉型。(2)脂酰辅酶A脱氢酶缺乏症。包括短、中、长、极长链脂酰辅酶A脱氢酶缺陷及多种脂酰辅酶A脱氢酶缺陷,病理主要为肝细胞脂肪变性和脑水肿。(3)肉毒碱缺乏症。分为原发性和继发性肉毒碱缺乏症,表现为肌肉疾病、心肌病、反复发作性肝性脑病、肾功能障碍、低血糖性脑病、贫血和生长发育迟缓等,肉毒碱治疗有效。(4)多种脂酰辅酶A脱氢酶缺乏症,常染色体隐性遗传,反复发作低血糖、代谢性酸中毒及高氨血症,尿液戊二酸升高,血浆中、长链脂酰肉毒碱水平升高,核黄素治疗常有效。
2.5 LSM治疗
LSM患者可分为激素敏感型与激素不敏感型,本例激素治疗有效,治疗后症状完全缓解,但激素治疗的作用机制尚不明确,可能与直接激活甘油三酯脂肪酶、加速脂肪分解或促进肌细胞摄取肉毒碱有关[9]。而肉毒碱替代治疗、核黄素治疗分别对不同类型有效,可给予低脂肪高糖或含中链及短链脂肪酸饮食;进食富含肉毒碱的牛羊肉和牛奶制品;服用ATP、辅酶A和B族维生素[10−11]。
总之,LSM发病率低,临床表现各异,易误诊,发病机制、诊断方法有待进一步研究,临床应根据发病机制不同采取个体化治疗方案。
[1]Skuban T, Klopstock T, Schoser B.Lipid storage myopathies:a clinical and pathobiochemical challenge[J].Nervenarzt, 2010, 81(12): 1460−1466.
[2]崔丽英, 汤晓芙, 袁 静, 等.脂质沉积性肌病合并周围神经病变的临床和神经电生理研究[J].中国神经免疫学和神经病学杂志, 1989, 5(3): 157−161.
[3]Volpi L, Ricci G, Orsucci D,et al.Metabolic myopathies:functional evaluation by different exercise testing approaches[J].Musculoskelet Surg, 2011, 95(2): 59−67.
[4]Zhang Y, Huang JJ, Wang ZQ,et al.Value of muscle enzyme measurement in evaluating different neuromuscular diseases [J].Clin Chim Acta, 2012,413(3−4): 520−524.
[5]董碗娟, 陈万金, 王 柠.脂质沉积性肌病[J].中国现代神经疾病杂志, 2008, 8(2): 109−111.
[6]Ohkuma A, Noguchi S, Sugie H,et al.Clinical and genetic analysis of lipid storage myopathies[J].Muscle Nerve, 2009, 39(3): 333−342.
[7]Liang WC, Nishino I.Lipid storage myopathy[J].Curr Neurol Neurosci Rep, 2011, 11(1): 97−103.
[8]Reilich P, Horvath R, Krause S,et al.The phenotypic spectrum of neutral lipid storage myopathy due to mutations in the PNPLA2 gene[J].J Neurol, 2011,258(11): 1987−1997.
[9]李 伟, 焉传祝, 吴金玲, 等.脂质沉积性肌病42例临床治疗和预后随访[J].中华神经科学, 2007, 40(4):229−231.
[10]Ohkuma A, Noguchi S, Sugie H,et al.Disorders of muscle lipid metabolism: diagnostic and therapeutic challenges[J].Neuromuscul Disord, 2010, 20(11):693−700.
[11]DiMauro S, Garone C, Naini A.Metabolic myopathies[J].Curr Rheumatol Rep, 2010, 12(5): 386−393.

