氧化钙和氢氧化钠混合分解锆英砂的工艺及机理
张建东,陈 洋,张顺利,王力军
(北京有色金属研究总院,北京 100088)
氧化钙和氢氧化钠混合分解锆英砂的工艺及机理
张建东,陈 洋,张顺利,王力军
(北京有色金属研究总院,北京 100088)
以氧化钙替代部分氢氧化钠进行混合碱分解锆英砂实验,研究了反应温度、原料配比和反应时间对锆英砂分解率的影响,探讨了氧化钙与氢氧化钠混合分解锆英砂的机理。结果表明:随着反应温度的升高和反应时间的延长,锆英砂分解率逐渐增加;在反应温度800℃和反应时间1 h的条件下,氧化钙与锆英砂物质的量比在0.25~0.75时,锆英砂分解率高于97%,物质的量比超过0.75时,分解率逐渐降低。进一步的机理分析表明:氧化钙与Na4SiO4反应生成Na2CaSiO4和Na2O,Na2O扩散到锆英砂表面继续进行分解反应。
锆英砂;分解率;氧化钙;氢氧化钠
1 前言
氯氧化锆(ZrOCl2·8H2O)是重要的锆盐基础化工产品,是制备氧化锆、硫酸锆、碳酸锆等锆化学制品的主要原料[1]。随着卫生陶瓷、电子、核电、汽车制造等行业的高速发展,对锆化学制品的需求日益增加[2-4]。据中国有色金属工业协会钛锆铪分会统计,2010年我国氯氧化锆产量已超过2×105t,居世界第一位。
锆英砂(ZrSiO4)碱熔法是生产氯氧化锆的主要方法[5],与氯化法、石灰烧结法等相比具有生产规模大、效率高等特点。但锆英砂碱熔法生产氯氧化锆需消耗大量的烧碱资源,每分解1 t锆英砂需烧碱约1.3 t。由于资源消耗、环境污染等问题,美国、日本、欧洲等相继减少或停止氯氧化锆生产,所需锆化学制品主要从我国进口。多年来,人们一直在寻求能耗低、污染少的锆英砂分解新工艺,并取得了一些研究结果[6-12],但仍不能满足工业化要求。与氢氧化钠相比,氧化钙更易获得且价格低廉,但氧化钙分解锆英砂的温度较高,约1 100℃,远高于氢氧化钠的分解温度(650~750℃)。本实验主要研究氧化钙替代部分氢氧化钠分解锆英砂的影响因素,探讨氧化钙和氢氧化钠混合碱分解锆英砂的反应机理,以期为混合碱分解锆英砂的工艺开发提供理论指导。
2 实验
2.1 实验原料
锆英砂为海南海滨砂,平均粒径为72 μm,化学组成见表1。锆英砂的主要成分为ZrO2和SiO2,并含有少量的TiO2和Fe2O3。进一步由锆英砂XRD图谱(见图1)可知,锆英砂中的主要物相是锆英砂(ZrSiO4)、金红石(TiO2)和赤铁矿(Fe2O3)。
其他试剂包括固体氢氧化钠、氧化钙、盐酸等,均为分析纯。在试验之前,氢氧化钠和锆英砂在200℃烘干2 h,氧化钙在800℃煅烧2 h,保存于干燥皿内备用。

表1 海南锆英砂成分组成(w/%)Table 1 Chemical composition of zircon sand

图1 海南锆英砂的XRD图谱Fig.1 XRD pattern of zircon sand
2.2 实验方案
在碱熔法分解锆英砂的工业生产中,氢氧化钠与锆英砂的物质的量比为6∶1(质量比为1.31∶1),锆英砂分解率可达98%。本实验以1 mol氧化钙替代2 mol的氢氧化钠的比例关系,进行氧化钙和氢氧化钠混合碱分解锆英砂的实验。
按照氧化钙、氢氧化钠和锆英砂物质的量关系式:

确定氧化钙、氢氧化钠和锆英砂物质的量比。
在反应时间为1 h的条件下,研究了物质的量比(氧化钙比锆英砂为0∶1、0.5∶1、1 ∶1、1.5 ∶1)、反应温度(分别为 600、650、700、750、800、850 ℃)与锆英砂分解率的关系,找出最佳的反应温度。
以上述实验确定的最佳温度作为反应温度,反应时间仍为1 h,进一步研究了物质的量比(氧化钙比锆英砂为0.25 ∶1、0.5 ∶1、0.75 ∶1、1 ∶1、1.5 ∶1、2∶1)对锆英砂分解率的影响,找出最佳的物质的量比。
最后,以上述两个实验确定的最佳反应温度和最佳物质的量比作为实验温度和物质配比,研究了反应时间(分别为10、20、30、40、50、60、80 min)对锆英砂分解率的影响。
锆英砂分解实验在箱式电阻炉中进行。将一定配比的原料在坩埚内混合均匀,装入电阻炉。在设定温度下,反应一段时间后,取出反应器,在空气中冷却至室温,得到固体产物。水洗除去产物中可能含有的部分可溶物(未反应),再用过量的6 mol/L盐酸在90℃下分解,倾倒上层溶液;用去离子水多次冲洗残留物,除去硅凝胶,收集残留物,烘干后称量其质量,并按式(1)计算锆英砂的分解率。

式中,aZr为锆英砂的分解率;m0(ZrSiO4)为反应初期加入锆英砂的质量;m1(ZrSiO4)为残留物的质量。
选择日本理学PTC-10A型综合热分析仪进行混合碱分解锆英砂的热重-差热分析(TG-DTA)实验,实验条件为:氮气气氛,铂金坩埚,升温速率为10℃/min。采用Philips APD-10型X射线衍射仪分析产物的相结构,试验中X射线衍射仪的工作电压为40 kV,电流为80 mA,Cu靶Kα辐射。
3 结果与讨论
3.1 物质的量比、反应温度与锆英砂分解率的关系
图2为物质的量比(氧化钙与锆英砂的物质的量比)、反应温度与锆英砂分解率的关系。在不添加氧化钙、反应温度在700℃以下时,随着反应温度的升高,锆英砂的分解率逐渐增加;当温度为700℃时,锆英砂的分解率可达98.50%;当温度超过700℃时,锆英砂的分解率随着温度的升高而降低。这可能是由于氢氧化钠挥发而降低了氢氧化钠的含量,也有可能是由于较高的反应温度导致物料熔合和复分解反应发生[6]。在氧化钙替代部分氢氧化钠分解锆英砂的试验中,在600~750℃范围内,随着温度的升高,锆英砂分解率显著增加。在750~850℃范围内,当氧化钙与锆碤砂的物质的量比为0.5∶1时,锆英砂分解率曲线趋于平缓,分解率达到97%,而物质的量比为1∶1时,分解率由87.47%增加至93.19%;物质的量比为1.5∶1时,分解率由68.24%增加至74.62%。升高温度有利于氧化钙参与锆英砂的分解反应,提高锆英砂分解率。但过高的反应温度将消耗过多能源,也可能造成物料的烧结,不利于后续处理。反应温度控制在800℃左右较为适宜。
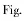
2 物质的量比、反应温度与锆英砂分解率的关系Fig.2 Effect of temperature on decomposition rate with different material ratio
3.2 物质的量比对锆英砂分解率的影响
在反应温度为800℃、时间为1 h的条件下,氧化钙与锆英砂配比对锆英砂分解率的影响如图3所示。由图3可知,原料中氧化钙与锆英砂物质的量比在0.25~0.75之间时,锆英砂分解率基本保持不变,均高于97%;当氧化钙与锆英砂的物质的量比超过0.75时,锆英砂分解率逐渐降低。当氧化钙含量较少时,主要是氢氧化钠与锆英砂发生反应;随着氧化钙含量的增加,相应氢氧化钠含量降低,反应体系的粘度增加,流动性变差,不利于锆英砂分解反应的进行。在锆英砂分解试验中,原料中氧化钙与锆英砂的物质的量比小于1较为适宜。
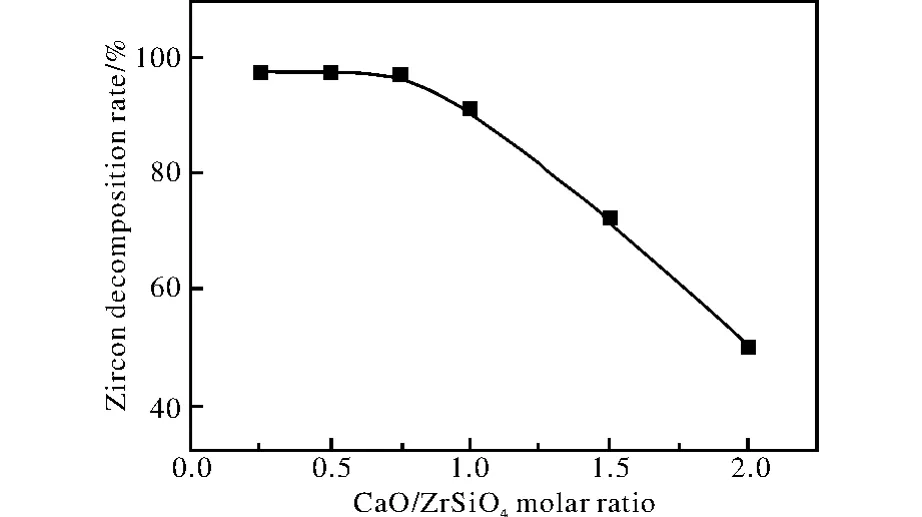
图3 氧化钙与锆英砂物质的量比对锆英砂分解率的影响Fig.3 Effect of CaO and NaOH molar ratio on decomposition rate
3.3 反应时间对锆英砂分解率的影响
依据3.1和3.2的实验结果,选择氧化钙、氢氧化钠和锆英砂物质的量比为0.75∶4.5∶1的样品,在反应温度为800℃的条件下,考察反应时间对锆英砂分解率的影响,结果如图4所示。由图4可知,随着反应时间的延长,锆英砂分解率显著增加;当时间超过40 min后,继续延长反应时间,锆英砂分解率增加较为缓慢。综合考虑锆英砂分解率和能源消耗,反应时间控制在1 h较为适宜。

图4 反应时间对锆英砂分解率的影响Fig.4 Effect of reaction time on decomposition rate
3.4 氧化钙与氢氧化钠混合分解锆英砂的反应机理
3.4.1 TG-DTA分析
为研究氧化钙和氢氧化钠混合碱分解锆英砂的过程,选择氧化钙、氢氧化钠和锆英砂物质的量比为1∶4∶1的样品进行TG-DTA试验,结果如图5所示。

图5 氧化钙与氢氧化钠混合分解锆英砂的TG-DTA曲线Fig.5 TG-DTA curves of CaO and NaOH demposotion of zircon
由图5可知,在DTA曲线上出现了一个吸热峰和一个放热峰,吸热峰温度在298~354℃,峰值温度为316℃,对应的TG曲线上质量无明显变化,可以判断此吸热峰为氢氧化钠融化过程。在528~631℃存在一个放热峰,峰值温度为596℃,对应的TG曲线质量有明显变化,可以判断此峰为化学反应过程。在810℃后随温度增加TG曲线出现失重现象,这是氢氧化钠的挥发引起的。
3.4.2 物相分析
为了研究图5中DTA曲线上放热峰所发生的化学反应,进行了氧化钙、氢氧化钠和锆英砂物质的量比为1∶4∶1的样品在反应温度为650、850℃和反应时间为1 h条件下的分解实验,并对产物进行了XRD分析,结果如图6所示。

图6 650℃和850℃时分解产物的XRD图谱Fig.6 XRD patterns of decomposition products at 650℃and 850℃
由图6可知,产物中主要物相是Na2CaSiO4和Na2ZrO3以及未反应的锆英砂和氧化钙。样品在850℃时的反应产物与650℃时的相同,但在850℃时,氧化钙和锆英砂衍射峰的相对强度已经明显减弱,而产物Na2CaSiO4和Na2ZrO3的相对强度有所增强。结合TG-DTA实验结果,可以推测:锆英砂混合碱分解过程可分为液-固反应和固-固反应两个阶段,在液-固反应阶段,有液态氢氧化钠存在,氧化钙和氢氧化钠与锆英砂反应较为迅速;在固-固反应阶段,受扩散影响反应速率相对较慢。根据上述分析和图5中TG曲线的失重现象,可以认为在氧化钙和氢氧化钠混合碱分解锆英砂过程中发生了式(2)中的化学反应。

3.4.3 机理分析
为了与3.4.2对比分析氧化钙在锆英砂分解过程中的作用,在不添加氧化钙的条件下,进行了氢氧化钠与锆英砂物质的量比为6∶1和4∶1的2个配比的分解实验,实验条件为:反应温度为650℃,反应时间为1 h,并对产物进行XRD分析,结果如图7所示。
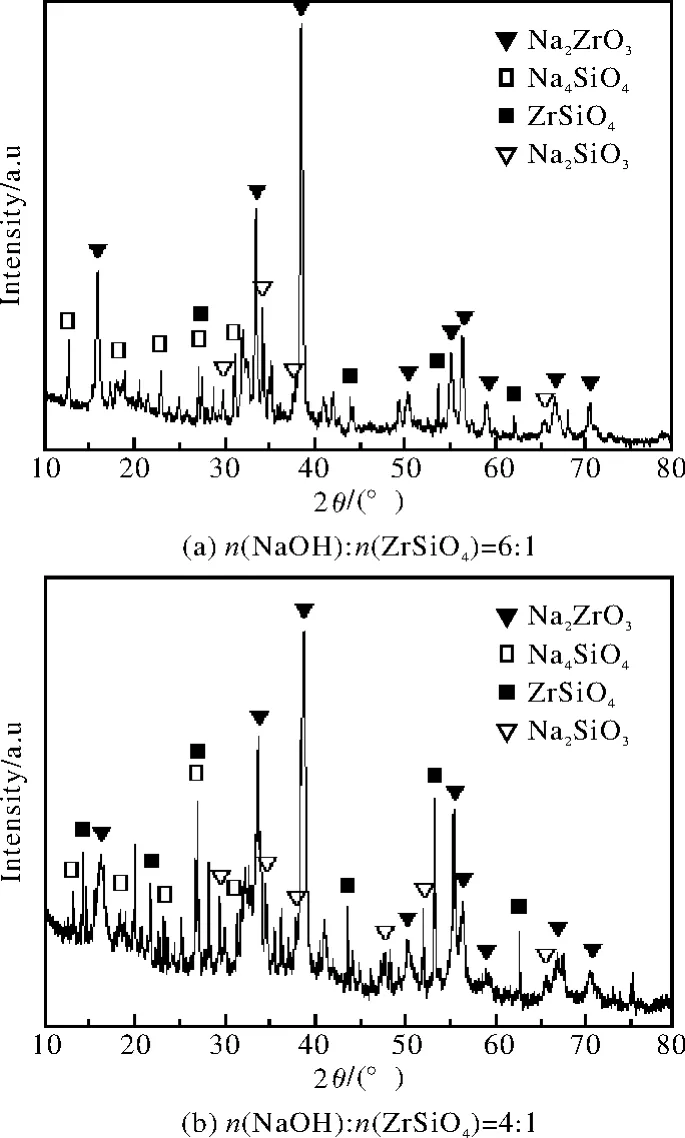
图7 650℃下不同配比的分解产物XRD图谱Fig.7 XRD patterns of decomposition products of different material molar ratio
由图7a可以看出,在氢氧化钠与锆英砂的物质的量比为6∶1时,产物的主要物相为 Na2ZrO3和Na4SiO4,并含有少量未分解的锆英砂,主要发生式(3)化学反应[13-14]。在氢氧化钠与锆英砂的物质的量比为4∶1时,由 Na2O-SiO2-ZrO2相图[15]可知,平衡状态的固体产物为Na2ZrO3和Na2SiO3,如式(4)。但文献[16]认为,在反应的初始阶段,锆英砂浸没于熔融的氢氧化钠中,相对于锆英砂,氢氧化钠过量,反应按式(3)进行,产物Na2ZrO3和Na4SiO4包裹于锆英砂颗粒的表层;随着反应的进行,氢氧化钠被大量消耗,锆英砂则相对过量,Na4SiO4则可能与锆英砂继续反应生成Na2SiO3以及其他低熔点化合物。由图7b可知,产物组成相当复杂(部分衍射峰对应的产物未能标出),支持了文献[16]的观点,出现了较为明显的Na2ZrO3、Na4SiO4和Na2SiO3的衍射峰。图6a与图7b相比,产物中出现了Na2CaSiO4,而Na4SiO4、Na2SiO3等消失。
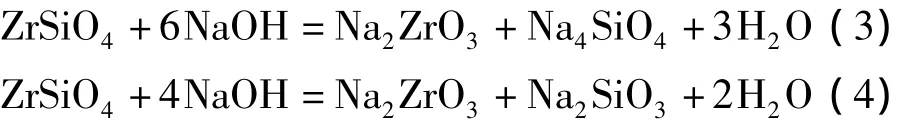
由上述分析,推测氧化钙和氢氧化钠与锆英砂的反应过程为:①在反应的初始阶段,氢氧化钠首先与锆英砂发生式(3)和(4)反应,反应产物Na2ZrO3、Na4SiO4和 Na2SiO3包裹在锆英砂表面;②氧化钙再与Na2SiO3和Na4SiO4分别发生式(5)和(6)反应;③高温下被“释放”出的Na2O扩散到锆英砂的“新鲜表面”,并且与锆英砂发生式(7)反应。上述推测氧化钙和氢氧化钠与锆英砂的反应过程以及氧化钙的作用还有待进一步研究证实,氧化钙和氢氧化钠与锆英砂的总反应可由式(2)表示。
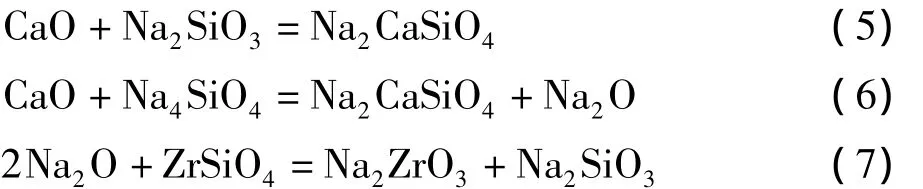
4 结论
(1)在氧化钙和氢氧化钠混合碱分解锆英砂的实验中,锆英砂分解率随着反应温度和反应时间的增加而升高,当反应温度为800℃、反应时间为1 h、氧化钙与锆英砂物质的量比在0.25~0.75范围内时,锆英砂分解率高于97%。
(2)锆英砂混合碱分解过程可分为液-固反应和固-固反应两个阶段,在液-固反应阶段反应速率较快,在固-固反应阶段受扩散影响,反应速率相对较慢,氧化钙和氢氧化钠与锆英砂的总反应为:ZrSiO4+4NaOH+CaO=Na2ZrO3+Na2CaSiO4+2H2O。
(3)氧化钙在锆英砂分解过程中作用机理:氧化钙与Na2SiO3和Na4SiO反应,产物为Na2CaSiO4和Na2O,Na2O扩散到锆英砂表面继续进行分解反应。
[1]熊炳昆,温旺光,杨新民,等.锆铪冶金[M].北京:冶金工业出版社,2006:110-130.
[2]林振汉.中国锆化学制品的发展及前景[J].稀有金属快报,2007,26(1):17-21.
[3]李中奎,刘建章.中国核用锆铪材料的现状和未来发展[J].稀有金属快报,2004,23(5):10-14.
[4]罗方承,吕文广,郑景宜,等.氧氯化锆的生产及其在现代新能源中的应用[J].无机盐工业,2003,35(1):10-12.
[5]刘长河,王泽斌,王力军,等.碱熔法氯化法制备氯氧化锆的技术经济比较[J].稀有金属快报,2007,26(1):97-99.
[6]Biswas R K,Habib M A,Karmakar A K,et al.A novel method for processing of Bangladeshi zircon:Part I:Baking,and fusion with NaOH[J].Hydrometallurgy,2010,103(1/4):124-129.
[7]Abdelkader A M,Daher A,El-kashef Emad.Novel decomposition method for zircon[J].Journal of Alloys and Compounds,2008,460(1/2):577–580.
[8]Singh B P,Bhattacharjee S,Besra L.Optimisation of performance of dispersants in aqueous plasma dissociated zircon suspension[J].Ceramics International,2008,28(4):413–417.
[9]李中军,黄银霞,要红昌,等.碳化锆碱熔制备氧氯化锆的研究[J].稀有金属,2006,30(3):415-418.
[10]Abdel-Rehim Aly M.A new technique for extracting zirconium form Egyptian zircon concentrate[J].International Journal of Mineral Processing,2005,76(4):234–243.
[11]童吉灶,张一兵.以氧化钙为主要原料从铌钽矿富锆尾矿中制备氧氯化锆[J].重庆大学学报,2003,26(6):112-115.
[12]Rodríguez J L,Rodríguez M A,Aza S De,et al.Reaction sintering of zircon - dolomite mixtures[J].Journal of the European Ceramic Society,2001,21(3):343-354.
[13]Mohammed N A,Daher A M.Preparation of high purity zirconia from Egyptian zircon:an anion exchange purification process[J].Hydrometallurgy,2002,65(2/3):103 –107.
[14]熊炳昆,林振汉.二氧化锆制备工艺与应用[M].北京:冶金工业出版社,2008:80-125.
[15]Ondik Helen M,Mcmurdie Howard F.Phase diagrams for zirconium and zirconia systems[M].American:The American Ceramic Society Press,1998:160 -164.
[16] Manhique Arao,Kwela Zola,Focke Walter W.De wet process for the benefication of zircon:optimization of the alkali fusion step[J].Industrial and Engineering Chemistry Research 2003,42(4):777–783.
Decomposition Process and Mechanism for Zircon with Mixed CaO and NaOH
Zhang Jiandong,Chen Yang,Zhang Shunli,Wang Lijun
(General Research Institute for Nonferrous Metals,Beijing 100088,China)
The decomposition process for zircon using mixed base of NaOH partly replaced by CaO has been researched and the mechanism of decomposition process for zircon using mixed alkali was also studied.The influence of varying experimental conditions on the process was studied including reaction temperature,material ratio and duration.The investigation shows that zircon decomposition rate gradually increases as reaction temperature rising and duration prolonging.The decomposition rate is over 97%with the condition that the CaO/zircon molar ratio of 0.25~ 0.75 at 800℃ for 1 h.Whereas the decomposition rate decreases when the molar ratio over 0.75.Further research found that Na2O,which is generated by the reaction of CaO and Na4SiO4,spread to the surface of zircon to continue the decomposition process.
zircon;decomposition rate;calcium oxide;sodium hydroxide
2012-12-26
国家科技支撑计划(2012BAB10B10)
张建东(1980—),男,博士。

