海滨木巴戟组织培养研究
郭 佳,朱鹏飞,房 丹,高中海,徐 梁
(1. 浙江诚邦园林股份有限公司,浙江 杭州 310006;2. 海南诺尼生物工程开发有限公司,海南 海口 570125;
3. 福建生生生物技术开发有限公司,福建 福州 350000;4. 国家林业局林产工业规划设计院,北京 100010;5. 浙江省林业科学研究院,浙江 杭州 310023)
海滨木巴戟组织培养研究
郭 佳1,2,朱鹏飞2,房 丹3,高中海4,徐 梁5*
(1. 浙江诚邦园林股份有限公司,浙江 杭州 310006;2. 海南诺尼生物工程开发有限公司,海南 海口 570125;
3. 福建生生生物技术开发有限公司,福建 福州 350000;4. 国家林业局林产工业规划设计院,北京 100010;5. 浙江省林业科学研究院,浙江 杭州 310023)
以海滨木巴戟(Morinda citrifolia)的嫩芽为外植体进行组培研究,以1/2MS+蔗糖30 g/L+琼脂6 g/L为基本培养基,以TDZ、BA、IBA三种激素进行不定芽的诱导分化实验,以IBA、NAA进行生根实验。结果表明,各因素对外植体分化的影响皆不显著(p < 0.05),IBA抑制外植体分化;在只添加BA的培养基中,随着BA浓度的升高,外植体玻璃化的现象有增加的趋势;生根实验结果表明,NAA和IBA诱导生根效果相差不大(p < 0.05),但是IBA在外植体基部诱导出更多的愈伤组织。
海滨木巴戟;组培;分化;生根
海滨木巴戟(Morinda citrifolia)也称海巴戟、海巴戟天,茜草科,属热带湿地植物。分布于亚洲、澳洲和太平洋诸岛,在中国仅分布于海南及西沙群岛、台湾岛[1]。海滨木巴戟为常绿灌木或小乔木,两性花,每颗果实内有多达上百粒种子。在自然界中海滨木巴戟的发芽率极低,这可能跟种皮不透水的构造有关[2]。波利尼西亚民间把海滨木巴戟应用于医药已经有2 000多年的历史[3],20世纪末,海滨木巴戟的经济价值逐渐得到开发,相关的研究也逐渐展开[4]。海滨木巴戟含有多种药用成分,现代药理实验揭示海滨木巴戟有抗细菌、抗病毒、抗真菌、抗肿瘤、抗寄生虫、镇痛、降血压、消炎和提高免疫力的活性[5]。大溪地、库克等国外品牌开发了海滨木巴戟的果汁饮料、胶囊、香皂等系列产品,且广受欢迎。在我国,海滨木巴戟的研究与开发较晚,目前仅海南省几家企业开展了海滨木巴戟的产品研发和推广。
为了进行大面积商业种植开发,摆脱海滨木巴戟种子极低发芽率的限制,针对海滨木巴戟的育种开展了以下一些相关研究:直接扦插繁殖[1,6],但成活率较低[1];利用种子作为材料进行育种试验,一部分对种子进行处理,直接进行发芽试验[7~8],另外一部分利用种子进行组织培养研究[2,9~10],其中以海滨木巴戟定芽为外植体的试验较少[11],且未见用正交设计的方式进行研究[12~13]。本实验为保持母本的优良性状,采取嫩芽为外植体进行海滨木巴戟组培研究。
1 材料与方法
1.1 材料
海滨木巴戟来源于海南。在久晴的天气采集一年生健康植株的嫩枝,带回实验室消毒。
1.2 外植体消毒方法
修剪掉多余的枝叶后,将外植体用洗衣粉溶液浸泡15 ~ 20 min,流水冲洗1 h,在无菌环境下,用70%乙醇浸泡10 s,无菌水清洗1遍,再用0.1% HgCl2浸泡9 ~ 12 min,无菌水冲洗5遍。
1.3 基本培养基
基本培养基为1/2MS+蔗糖30 g/L+琼脂6 g/L,pH5.6 ~ 5.8。
1.4 不定芽的诱导分化
在基本培养基中,添加浓度梯度分别为0.5、1.0、1.5 mg/L的BA(6-苄氨基腺嘌呤),0.001、0.01、0.1 mg/L的TDZ(苯基噻二唑基脲)和0.05、0.1、0.2 mg/L的IBA(吲哚丁酸)3种激素,进行试验设计。每个处理30个外植体,重复3次试验。在分化培养基上培养1个月后,统计出芽情况。取3次实验的均值,进行统计分析。
1.5 壮苗生根
在基本培养基中,采用IBA、NAA(萘乙酸)2种生长素进行的生根实验,浓度梯度为0.1、0.3、0.6、0.9 mg/L。将分化苗接种到壮苗生根培养基中两周后,观察实验结果并分析。
1.6 统计方法
芽增殖倍数 = 不定芽数/接种茎段数
生根率 =(生根苗数量/接种外植体数)×100%
平均根数 = 根系数量/接种外植体数
2 结果
2.1 分化实验情况
1个月后,统计分化结果,按 L9(34)表进行数据处理,得到表1。
从表1中的各因素均值看,随着BA、TDZ浓度升高,芽的增殖倍数也随之增加;IBA则相反,随其浓度升高芽增殖倍数逐渐降低,表明IBA不利于芽的增殖。

表1 三种激素对海滨木巴戟不定芽分化的影响Table 1 Effect of three hormones on bud differentiation
从表1中可看出,各因素极差值都很小,说明各激素对于不定芽的分化影响都没有显著差异。根据极差大小顺序排出影响分化的因素的主次顺序为IBA>BA>TDZ。该项实验中的各因素较优水平组合是IBA1+BA3+TDZ3,即IBA0.05 mg/L+BA0.5 mg/L +TDZ0.001 mg/L。
由表2可知,在实验的浓度范围内,各种激素浓度水平间差异对芽增殖效果都达不到显著水平。
按正交设计的结果,撤去生长素,将BA浓度设定在1.0mg/L,TDZ浓度设定在0.001、0.01、0.1 mg/L三个梯度,或TDZ浓度保持0.001mg/L不变,BA浓度梯度为0.5、1.0 、1.5mg/L,再进行分化试验,进行2次重复。观察在只添加两种分裂素的诱导分化培养基中外植体的表现,实验结果如表3。
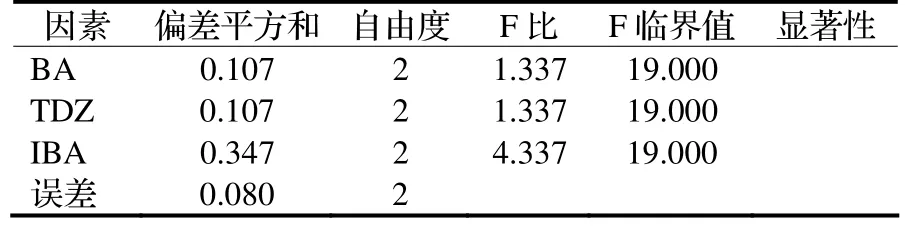
表2 三种激素对海滨木巴戟不定芽分化影响的方差分析Table 2 ANOVA of Effect of three hormones on bud differentiation
由表3可见,当TDZ浓度由0.001 mg/L升至0.0 1mg/L时,或当BA浓度由0.5 mg/L升至1.0 mg/L时,外植体的增殖倍数增加了,当TDZ浓度由0.01 mg/L升至0.1 mg/L时,或当BA浓度由1.0 mg/L升至1.5 mg/L时,外植体的增殖倍数反而随之降低。在统计不定芽的过程中发现,在含TDZ 0.1 mg/L或BA 1.5 mg/L的培养基中,茎段、分化芽玻璃化和畸形苗的出现比率较高,这部分苗不计算在有效不定芽内。
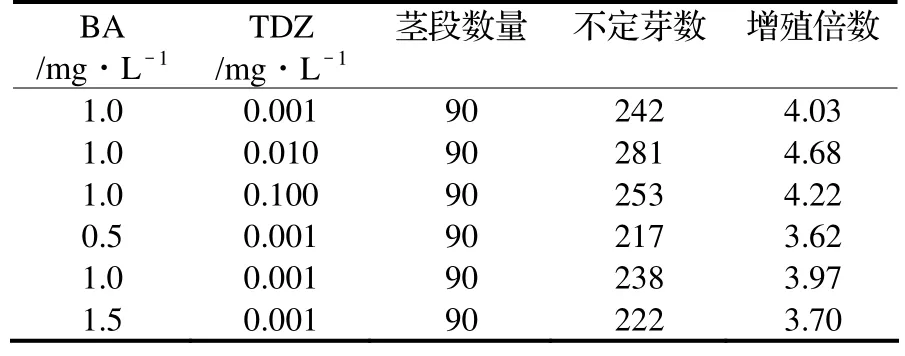
表3 诱导分化实验Table 3 Differentiation experiments
在未添加任何激素的对照培养基中,无菌苗不进行分化,只进行伸长生长,部分同时有生根现象。说明外植体内源生长素浓度水平较高。
2.2 壮苗生根
将分化苗接种到壮苗生根培养基中,1个月后统计生根情况,结果见表4。
由表4可知,当IBA浓度为0.1 ~ 0.3 mg/L,生根率最高,为100%,当IBA浓度为0.6mg/L时,平均生根数量最多,为8.3根;当NAA浓度为0.3~0.6mg/L时,生根率最高,为100%,当NAA浓度为0.3mg/L时,平均生根数量最多,为8.5根。
本试验中,两种生长素在外植体的生根数量上效果相差不大,但在根系的表现上则有较大区别。在添加IBA的生根培养基中,随着IBA浓度的增加,无菌苗基部会诱导出很多的愈伤组织,在NAA中则出现少量或没有愈伤,根系中的毛细根随着NAA浓度的升高而增加。
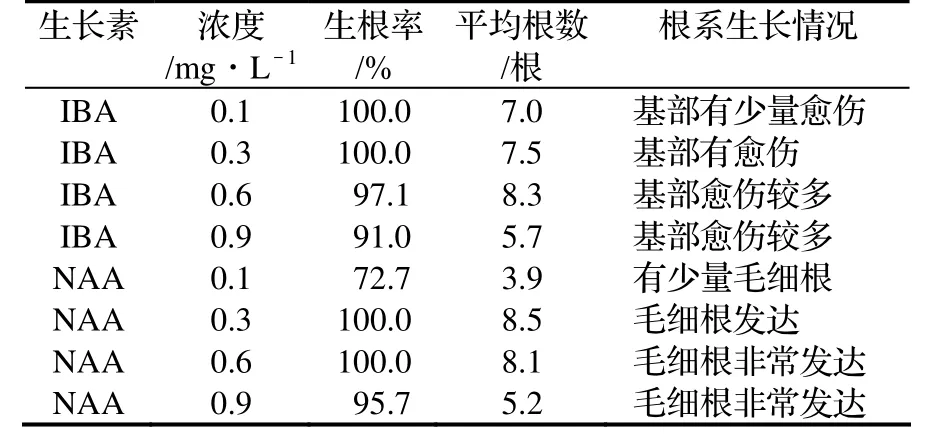
表4 生根培养基及无菌苗生根情况Table 4 Effect of two hormones on rooting
2.3 炼苗
将组培苗移至大棚,1周之后,将生根苗从组培瓶中取出,清洗干净根须上的培养基,用1000倍的百菌清溶液浸泡3 min,清水中浸泡片刻,再移植至已用5%高锰酸钾消毒过的苗圃。移植初期,需要经常进行喷雾,以保持叶片表面水分充足。10 d之内需要进行遮阳,以免叶片水分过快蒸发,影响成活率。10 d之后视情况可以进行全日照培养,成活率80% ~ 90%。
3 结论与讨论
黄骐[2]利用子叶和下胚轴作为试验外植体,单独使用BA即可诱导不定芽的发生,添加NAA0.05 ~ 0.1mg/L则完全抑制不定芽发生,用NAA、IBA、IAA分别进行生根试验,发现均有根群发生,但NAA0.1 mg/L诱导生根时切口愈伤组织较多,部分不定根由愈伤组织发生,而IAA0.1mg/L诱导生根时根系欠发达,以IBA0.1mg/L最佳,部分试验结果与本实验有类似的地方;韦丽君[9]以实生苗为外植体,MS为基本培养基,添加6-BA1.5 mg/L和6-BA1.0 mg/L+NAA0.2 mg/L为芽诱导培养基,添加6-BA0.5 mg/L+NAA0.5 mg/L为芽增殖培养基,1/2MS +NAA0.5 mg/L为生根培养基。芽的平均增殖系数约为5倍,30 d后生根率可达85%,每株的根数有4 ~ 6条;陈雄庭[11]选取幼嫩侧枝,以MS为基本培养基,添加6-BA2 mg/L+NAA0.1 mg/L为初代和继代培养基,40 ~ 50 d后统计增殖系数2 ~ 3倍,切取2 ~ 3 cm新芽接种至1/2MS+IBA0.1mg/L+活性炭1g/L+蔗糖30 g/L,生根率达到100%。
本研究用正交设计的方法进行诱导分化试验,得到三因素较优水平组合是IBA1+BA3+TDZ3,即IBA0.05 mg/L+BA0.5 mg/L+TDZ0.001 mg/L。在试验的浓度范围内IBA、TDZ、BA对不定芽的分化皆没有显著影响,且IBA不利于不定芽分化。在单独添加分裂素的培养基中,虽然TDZ、BA有利于外植体不定芽的分化,但是外植体不耐受高浓度的分裂素,浓度越高畸形苗的现象越严重。观察发现,外植体顶端优势很明显:在同一分化芽丛中,只有其中一两个芽能伸长生长,其余丛芽必须分离后才能长成较大的植株。所以我们推测,IBA对于分化率的影响虽然是负面的,但是适当的生长素/分裂素比例,对保持外置体的正常分化和生长,有一定的促进作用。在一定程度上保证了分化苗的正常生长。在本次试验中,海滨木巴戟的增殖倍数最高为4.8。在海滨木巴戟同类的育种研究文章中,同样没有获得较高的增殖倍数。生根相对分化要容易很多。在未添加任何激素的培养基中,多数外植体也有少量生根现象,再次说明外植体内源生长素浓度水平较高。在生根实验中,我们将NAA和IBA进行了比较,诱导生根效果相差不大,但是观测发现,IBA在外植体基部诱导出更多的愈伤组织。相对生根效果最好的是NAA0.3 mg/L,生根率为100%,平均生根数为8.5。
本实验中海滨木巴戟的组培增殖率偏低,海滨木巴戟不同发育阶段的材料对植物生长调节剂或营养成分的要求可能有较大差异,还需进一步的研究提高其快繁效率。
[1] 何明霞,杨清. 海巴戟的引种栽培及发展前景[J]. 中国热带农业,2006(4):28-29.
[2] 黄骐,何文锦,叶冰莹,等. 海巴戟组织培养研究[J]. 天然产物研究与开发,2006,18(6):910-913.
[3] Scot C Nelson. Morinda citrifolia L.[EB/OL]. http://www.ctahrhawa-ii.edu/noni/Downloads/morinda species profile.Pdf.
[4] 苏文潘,吕平,韦丽君,等. 海巴戟研究进展[J]. 广西热带农业,2006(2):37-39.
[5] Wang M Y, West B J, Jensen C J, et al. Morinda citrifolia ( noni) : a literature review and recent advances in noni research[J]. Acta Pha rmacol Sin, 2002(23):1 127-1 141.
[6] 甘炳春,何明军. 海巴戟天的栽培及其利用[J]. 中国林副特产,2004(2):7-9.
[7] 邢诒旺,符懋修,李承武,等. 海巴戟的种子结构及发芽试验[J]. 海南大学学报(自然科学版),2007,25(2):156-162.
[8] 黄强,苏文潘,吕平,等. 海巴戟种子萌芽试验[J]. 广西热带农业,2006(4):28-29.
[9] 韦丽君,吕平,苏文潘. 海巴戟的组织培养及快速繁殖[J]. 植物生理学通讯,2006,42(3):475.
[10] 黄骐,何文锦,叶冰莹,等. 诺丽离体快速繁殖研究[J]. 福建师范大学学报(自然科学版),2007,23(1):87-90.
[11] 陈雄庭,张秀娟,王颖,等. 海巴戟天的离体快速繁殖[J]. 热带作物学报,2007,28(4):44-46.
[12] 张光楚,王裕霞. 杂种撑麻7号竹的组织培养研究[J]. 林业科学研究,2003,16(3):245-253.
[13] 王建华,王义,孙国伟,等. 人参组织培养的多因子正交试验研究[J]. 吉林农业大学学报,2006,28(6):648-651.
Experiment on Tissue Culture of Morinda citrifolia
GUO Jia1,ZHU Peng-fei2,FANG Dan3,GAO Zhong-hai4,XU Liang5*
(1. Zhejiang Chengbang Landscape Co. Ltd, Hangzhou 310006, China; 2. Hainan Noni Biological Engineering Development Co. Ltd, Haikou 570125, China; 3. Fujian Shengsheng Biotech Corporation, Fuzhou 350000, China; 4. Forest Product Industry Planning and Design Institute of The State Forestry Administration, Beijing 100010, China; 5. Zhejiang Forestry Academy, Hangzhou 310023, China)
The axillary buds of Morinda citrifolia were used as the explants to establish the micro-propagation system. The orthogonal experiment of bud differentiation was carried out by TDZ, BA and IBA. The results showed that three hormones had no significant(p < 0.05) effect on bud differentiation, but IBA inhibited the differentiation. The number of vitrification shoots increased with the concentration of BA when the medium was only added BA. Experiment on rooting induction demonstrated that the influences of NAA and IBA had no obvious difference (p < 0.05). However, more callus were induced from the base of explant in the medium with IBA.
Morinda citrifolia; tissue culture; differentiation; rooting
S723.1+34
B
1001-3776(2013)05-0081-04
2013-05-14;
2013-07-12
浙江省花卉新品种选育重大科技专项重点项目(2012C12909-5);浙江省重大科技专项重点农业项目(2013F10020)
郭佳(1980-),女,浙江金华人,工程师,硕士,从事林木及观赏植物遗传育种研究。

