多年生藤本豆与大豆中黄酮类化合物体外抗氧化活性比较研究
赵丹丹,郑鸿雁
(吉林农业大学食品工程学院,吉林长春130118)
多年生藤本豆,是经过多年研究培植出来的新型蔬菜类新品种[1]。多年生藤本豆是绿色生态抗逆性品种,可在0~42℃无休眠期生长,甚至能在其他农作物不能生长的贫脊土地上顽强存活。北方每公顷土地可产10万公斤鲜豆角,其亩产量远远高于大豆,具有很大的开发与利用价值。同时,多年生藤本豆含有优质的卵磷脂、蛋白质、纤维等,其中的多肽还具有保健功能[2]。大豆(Glycine max),是一种其种子含有丰富的蛋白质的豆科植物[3],目前国内对大豆的研究成果颇多,但从多年生藤本豆中提取黄酮类化合物并进行体外抗氧化的研究尚无报道。通过对大豆和多年生藤本豆黄酮提取液抗氧化活性进行比较,从而对多年生藤本豆的进一步开发、利用和推广提供参考。黄酮类化合物在植物叶片和果实中大部分与糖结合成苷类的形式存在,已发现有5000余种植物含有该物质[4]。黄酮类化合物在生物体内可协同维生素及体内酶起到抗过敏、抗病毒、防止心血管疾病及清除自由基的作用[5],同时还有抗炎症、抗溃疡及肝脏排毒的功效[6-9]。从豆类中提取黄酮类化合物可以添加至保健品中发挥药用价值,从而一定程度上减少了黄酮类物质添加制成的保健品和药品的加工成本。
1 材料与方法
1.1 材料与仪器
多年生藤本豆 由长春市昌达天然植物开发有限公司提供;大豆 吉林48号,由吉林省农科院大豆所育成,购于吉林农业大学农贸市场;无水乙醇、磷酸二氢钠、磷酸氢二钠、邻苯三酚、FeSO4·7H2O、H2O2、抗坏血酸(VC)、石油醚、二丁级羟基甲苯(BHT,食品级)、1,1-二苯基-2-三硝基苯肼、水杨酸、铁氰化钾、三氯乙酸、三氯化铁、硫酸亚铁、三羟基氨基甲烷(Tris)、亚硝酸钠、硝酸铝、氢氧化钠 均为分析纯;以下用水除特殊说明外 均为GB/T 6682-2008中规定的三级水。
JY99-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;UV-1700 pharmaspec紫外-可见分光光度计 岛津仪器(苏州)有限公司;旋转蒸发器上海荣亚生化仪器;微型植物粉碎机 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 芦丁标准曲线绘制[10]分别吸取芦丁标准溶液0、1.0、2.0、3.0、4.0、5.0mL于6个10.0mL容量瓶中,分别加30%乙醇溶液至5.0mL。而后各加5%亚硝酸钠溶液0.4mL,摇匀后静置5min。再加入10%硝酸铝溶液0.4mL,摇匀后静置6min。最后加入1.0mol/L氢氧化钠溶液4.0mL,用30%乙醇定容至容量瓶刻度。所得芦丁与铝盐生成的红色络合物在356nm波长下进行扫描测得吸光度值,如图1所示,标准曲线回归方程为y=23.65x+0.0517,R2=0.9996。
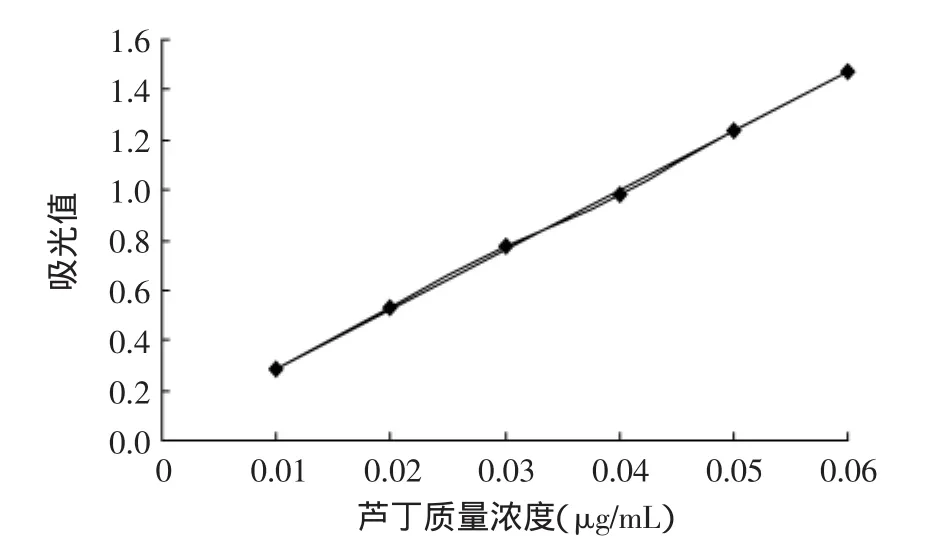
图1 芦丁标准曲线Fig.1 Standard curve of rutin
1.2.2 黄酮粗提物的制备 原料经过干燥、粉碎、过筛(40目)等预处理后准确称取10g,用石油醚为溶剂索氏抽提回流4h除去色素和脂类杂质,挥干石油醚。采用乙醇超声辅助提取法提取黄酮类化合物,提取条件为:70%乙醇为提取溶剂,提取时间30min,超声功率400W,料液比为1∶15。所得滤液经过滤、减压蒸馏的浓缩物进行真空冷冻干燥48h,得到粗黄酮提取物,备用。
1.2.3 总黄酮含量的测定参考NaNO2-Al(NO3)3比色法准确吸取2.0mL的提取液加入10mL容量瓶中,加入5%亚硝酸钠溶液0.4mL,摇匀后静置5min;分别加入10%硝酸铝溶液0.4mL,摇匀静置6min;加入1mol/L氢氧化钠溶液4.0mL,用30%乙醇溶液定容到刻度,在波长356nm处测定吸光度。根据标准曲线计算提取物总黄酮的含量。
1.2.4 多年生藤本豆和大豆中黄酮类组分总还原能力的测定 分别加入pH6.6的PBS缓冲液2.5mL、1g/100mL铁氰化钾溶液1mL、不同质量浓度提取样液1mL于试管中,摇匀后置于50℃水浴锅中加热20min,待冷却后再加入10g/100mL三氯乙酸2.5mL并摇匀,吸取2mL于另一只试管中,并加入蒸馏水5mL和1g/100mL三氯化铁1mL,混匀后静置10min,于700nm处测定反应体系的OD值,以蒸馏水作参比,VC作为对照样品,每组实验重复3次后求得平均值,绘制总还原能力变化曲线[11]。
1.2.5 多年生藤本豆和大豆中黄酮类组分清除超氧自由基的能力 邻苯三酚自氧化速率的测定:准确吸取pH8.2,0.05mol/L Tris-HCl缓冲液5mL于试管中,加蒸馏水4.5mL,置于25℃水浴锅中保温20min后立即加入3mmol/L邻苯三酚0.5mL,充分摇匀,于299nm波长处测定OD值,以加入邻苯三酚后的瞬间开始计时,每隔1min记录一次吸光度(Ao),持续记录10min,以蒸馏水作参比,计算线性范围内每分钟OD值的增加值(Vo)。
多年生藤本豆和大豆总黄酮清除超氧阴离子能力的测定:准确吸取pH8.2,0.05mol/L的Tris-HCl缓冲液5mL于试管中,加H2O 5mL,不同质量浓度的样液2mL,充分摇匀,于299nm波长处测定OD值,以加入邻苯三酚溶液后的瞬间开始计时,每隔1min记录一次OD值,持续记录10min,以蒸馏水调零,计算线性范围内每分钟OD值的增加量(Vm)。以VC作为对照,每组实验重复3次后求平均值,按照式(1)计算总黄酮对超氧自由基的清除率。
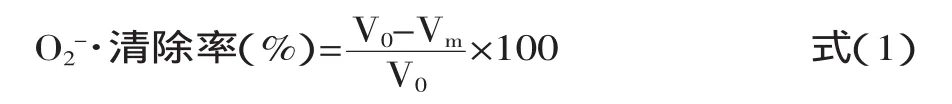
1.2.6 多年生藤本豆和大豆中黄酮类组分清除·OH的能力 在试管中依次加入6mmol/L FeSO4溶液2mL、6mmol/L H2O22mL及不同质量浓度的提取样液1mL,摇匀后静置10min,再加入6mmol/L水杨酸2mL,于37℃的水浴中反应30min后,在510nm波长处测定其OD值(Ai),蒸馏水代替水杨酸测定OD值(Ax),蒸馏水代替样液测定OD值(Ao)。以VC和BHT做为对照样品,每个实验组重复3次,求得平均值,按照式(2)计算总黄酮对·OH的清除率。
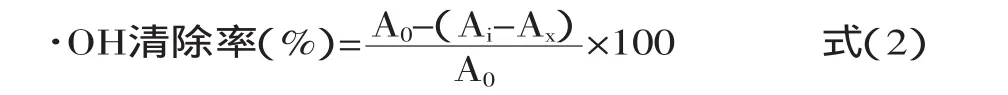
1.2.7 多年生藤本豆和大豆中黄酮类组分清除DPPH自由基的能力 准确称取0.0079g DPPH试剂,用无水乙醇定容至100mL,配制成20μmol/L DPPH溶液。取20μmol/L DPPH溶液2mL、样品溶剂2mL、无水乙醇1mL于试管中,反应30min后于517nm波长处测定OD值(A0);取20μmol/L DPPH溶液2mL、样品溶液(对照样品)2mL、无水乙醇1mL于试管中,反应30min后于517nm波长处测定OD值(Ai);取无水乙醇2mL、样品溶液(对照样品)2mL、无水乙醇1mL于试管中,反应30min后于517nm波长处测定OD值(Aj);以无水乙醇调零,VC作为对照样品,各个实验组重复3次后求平均值,按照式(3)得DPPH自由基的清除率。
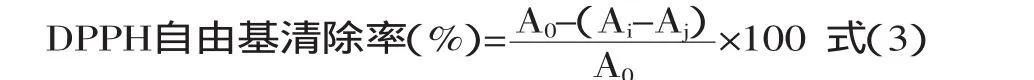
2 结果与分析
2.1 多年生藤本豆和大豆黄酮类化合物的还原能力测定
如图2结果所示,多年生藤本豆和大豆黄酮类化合物提取样液都具有一定的还原能力,其还原能力与样液中黄酮类化合物的质量浓度呈一定的线性关系;样液在0~3.0mg/mL质量浓度范围内,随着样液中黄酮类化合物质量浓度的增大,其还原能力呈逐渐增大趋势,多年生藤本豆、大豆与VC还原能力存在显著性差异(p<0.05),多年生藤本豆与大豆还原能力存在显著差异(p<0.05),多年生藤本豆与大豆的还原能力在实验参考范围内弱于VC。
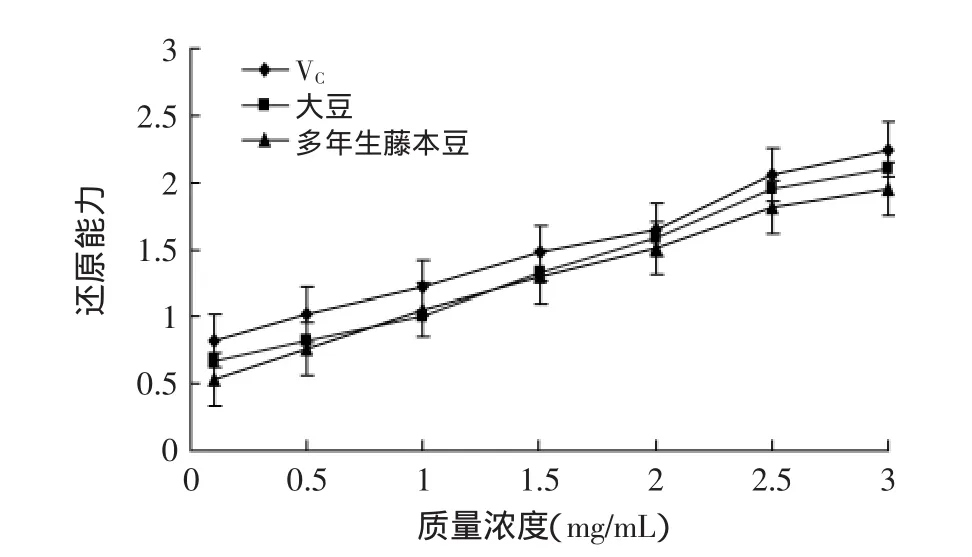
图2 多年生藤本豆和大豆中黄酮类化合物与VC的还原能力Fig.2 Total reducing power of total flavonoids from perennial Fujimoto Zu and Glycine max and VC
2.2 对超氧自由基的清除效果
邻苯三酚在碱性溶液中发生自氧化反应产生超氧阴离子自由基,多年生藤本豆和大豆提取样液中含有的黄酮类化合物可以抑制超氧阴离子自由基的产生,根据该原理可以测定OD值的变化得到多年生藤本豆和大豆中黄酮类化合物对超氧阴离子自由基的清除率[12]。

图3 多年生藤本豆和大豆中黄酮类化合物与VC清除O2-·自由基的效果Fig.3 Scavenging capacity of total flavonoids from perennial Fujimoto Zu and Glycine max and vitamin C against superoxide anion free radicals
如图3结果所示,多年生藤本豆和大豆黄酮类化合物提取液在0.05~0.25mg/mL质量浓度范围内对超氧阴离子具有清除作用;清除率随着质量浓度的增大而逐渐增强呈线性关系,多年生藤本豆与大豆清除O2-·自由基的能力在实验测定范围内存在显著性差异(p<0.05),多年生藤本豆、大豆与VC清除O2-·自由基的能力的存在差异。
2.3 对羟自由基的清除效果
H2O2与Fe2+反应可产生氧化性较强的·OH自由基,加入水杨酸后体系内产生有色产物2,3-二羟基苯甲酸,该物质在波长510nm处有最大吸收[13]。多年生藤本豆和大豆提取样液中含有抗氧化活性的黄酮类化合物,加入反应体系后可以抑制2,3-二羟基苯甲酸的产生,从而达到清除·OH自由基的效果。抗氧化剂2,6-二叔基对甲苯酚(BHT)能够延迟食物的酸败,故多作为食品添加剂添加至食品中,本实验比较多年生藤本豆和大豆对VC和BHT两种抗氧化剂的氧化活性抑制作用。
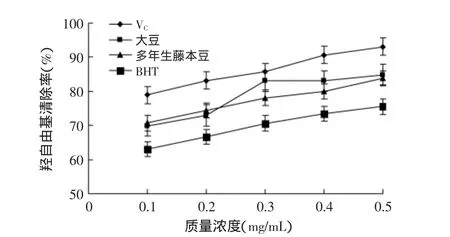
图4 多年生藤本豆和大豆总黄酮与VC和BHT对·OH自由基的清除效果Fig.4 Scavenging capacity of total flavonoids from perennial Fujimoto Zu and Glycine max to vitamin C and BHT against hydroxyl free radicals
如图4结果所示,多年生藤本豆和大豆黄酮类化合物提取液在0.1~0.5mg/mL质量浓度范围内对·OH自由基的清除率呈线性关系;黄酮类化合物提取液质量浓度从0.1mg/mL增加到0.5mg/mL时,VC、大豆、多年生藤本豆、BHT对·OH自由基的清除率分别从78.95%、70.72%、69.91%、63.06%增加为93.04%、84.87%、83.82%、75.56%,在相同质量浓度,多年生藤本豆、大豆、BHT与VC清除·OH能力呈显著差异(p<0.05),多年生藤本豆与大豆清除·OH能力在实验考察范围内略强于BHT,存在差异显著性(p<0.05)。
2.4 对DPPH自由基的清除效果
DPPH-比色法主要利用自由基清除剂提供一个电子与DPPH自由基的孤对电子配对后使反应溶液由紫色变为黄色[14-15],在517nm波长处,随着清除时间的延长,溶液的OD值随即减小,颜色变化程度与自由基清除程度呈线性关系,即自由基清除剂的清除能力越强,吸光度越小。
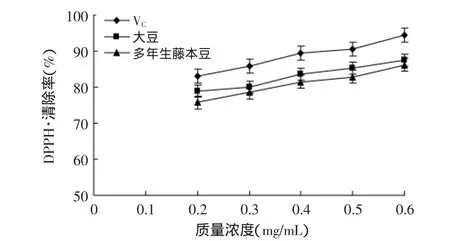
图5 多年生藤本豆和大豆总黄酮与VC对DPPH自由基的清除效果Fig.5 Scavenging capacity of total flavonoids from perennial Fujimoto Zu and Glycine max and vitamin C against DPPH free radicals
由图5可知,多年生藤本豆和大豆黄酮类化合物提取液在0.2~0.6mg/mL质量浓度范围内,对DPPH自由基的清除能力与质量浓度呈线性关系;提取样液质量浓度由0.2mg/mL增加至0.6mg/mL时,VC、大豆、多年生藤本豆对DPPH自由基的清除率分别从83.05%、78.81%、75.76%增加至94.36%、87.46%、86.19%;样液中的黄酮类化合物对DPPH自由基的清除率能力呈缓慢增加趋势,多年生藤本豆、大豆与VC对DPPH自由基的清除效果在考察范围内存在显著差异(p<0.05)。
3 结论
本实验通过测定样品中黄酮类化合物对体外产生的自由基系统的清除率,进而比较了多年生藤本豆与大豆抗氧化活性。在实验测定的质量浓度范围内,多年生藤本豆的还原能力及对超氧自由基、·OH自由基、DPPH自由基清除能力弱于大豆,呈显著性差异(p<0.05),多年生藤本豆、大豆与VC清除能力呈显著差异性(p<0.05)。结果表明,多年生藤本豆中的黄酮类化合物可发挥抗氧化活性,多年生藤本豆与大豆的抗氧化活性呈显著差异(p<0.05)。实验研究多年生藤本豆中黄酮类化合物的抗氧化活性,为其今后的综合利用及提取物的活性研究提供理论依据。
[1]吴润娇,昌友权,任保国,等.多年生藤本豆多肽保健功能的研究[J].食品科学,2006,27(12):733-734.
[2]郑鸿雁,昌友权,孙秀娥,等.多年生藤本豆蛋白对小鼠免疫功能的影响[J].食品科学,2007,28(9):526-528.
[3]刘立新,郑春辉,徐成,等.大豆茎中黄酮类化合物的提取及抗氧化作用研究[J].食品科学,2011,34(5):60-61.
[4]马森林,陈四平.天然黄酮类化合物分离方法研究进展[J].中国医药导报,2011,8(21):8-9.
[5]Meenakshi,Manicka Gnanambigai D,Tamil Mozhi S,et al.Total flavanoid and in vitro antioxidant activity of two seaweeds of rameshwaram coast[J].Global Journal of Pharmacology,2009,3(2):59-62.
[6]Guoyang,Liu Benguo,Zheng Xiangning,et al.Structureactivity relationship of flavonoids active against lard oil oxidation based on quantum chemical analysis[J].Molecules,2009,14:46-52.
[7]Gonzala J R,Buelga C S,Teresa S P.Understanding the Potential Health Promoting Effect of Flavonoids[J].Electronic J Envi& Agri& Food Chemistry,2008,7(8):3146-3150.
[8]Ju Mljeong,Su Kyeong Kang,In-Hwa Lee,et al.Antioxidant and Chemosensitizing effects of flavonoids with Hydroxy and/or Methoxy groups and structure-activity relationship[J].J Pharm Pharmaceut Sci,2007,10(4):537-546.
[9]郭雪峰,岳永德.黄酮类化合物的提取、分离、纯化研究进展[J].中药与天然药物,2009,21(12):101-104.
[10]熊双丽,李安林,任飞,等.苦荞和甜荞麦粉及麦壳中总黄酮的提取和自由基清除活性[J].食品科学,2009,30(3):118-122.
[11]王蓓蓓,牛付阁,段玉峰.高良姜与大高良姜总黄酮抗氧化活性比较研究[J].食品科学,2011,32(7):117-120.
[12]吕慧慧,张晓峰,洪月玲,等.醋蒜和醋蒜液对超氧阴离子和羟自由基的清除作用[J].中国调味品,2009,34(8):46-48,59.
[13]文良娟,刘昊,王维.不同品种芒果总黄酮的抗氧化活性[J].食品科学,2011,32(19):79-82.
[14]吴向阳,范群艳,仰榴青,等.匙羹藤粗多糖的提取及其清除羟自由基活性研究[J].食品科学,2008,29(1):107-110.
[15]熊双丽,卢飞,石敏娟,等.DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J].食品工业科技,2012(8):380-383.

