慢性乙型肝炎HBeAg 血清学转换与HBV 特异性细胞毒T 淋巴细胞、基因型的关系
吴寅涛,周玉麟 ,王学才
(1.宜兴市人民医院感染科,江苏 宜兴214200;2.宜兴市人民医院川埠分院感染科,江苏 宜兴214200)
在慢性乙型肝炎(CHB)患者抗病毒治疗中,乙型肝炎病毒e 抗原(HBeAg)血清学转换是评价抗病毒疗效的重要标志之一。国内外研究显示,影响HBeAg 血清学转换的因素有多方面,但关于阿德福韦酯治疗CHB 患者后,HBeAg 血清学转换与乙型肝炎病毒(HBV)基因型、特异性细胞毒T 淋巴细胞(CTL)关系的相关研究并不多,本文通过观察采用阿德福韦酯治疗的80例CHB 患者,探讨其HBeAg血清学转换与外周血HBV 特异性CTL、HBV 基因型的关系。
1 对象与方法
1.1 临床资料
收集2009年1月至2012年5月我院感染科CHB 患者80例,诊断符合2005年慢性乙型肝炎防治指南的标准。其中男44例,女36例,年龄22 ~59(33.91 ±9.02)岁,病程1 ~10年;HBeAg 阳性50例(62.5%);所有患者均符合HBV DNA 阳性(HBV DNA≥1 ×105拷贝/mL);肝功能异常,丙氨酸转氨酶(ALT)>2 ×正常值上限;人白细胞抗原(HLA)-A2阳性;均排除甲、丙、丁、戊型肝炎病毒感染;无自身免疫性疾病;无长期大量饮酒史;无使用肝毒性药物史;以前未使用核苷(酸)类似物和干扰素抗病毒治疗或使用免疫调节药物。
1.2 治疗方法
患者服用阿德福韦酯(江苏省连云港正大天晴药业公司)10 mg,1 次/d,口服,疗程12 个月。
1.3 检测方法
HBVM 和HBV DNA:HBVM(HBsAg、抗HBs、HBeAg、抗HBe、抗HBc)应用AusBio 全自动酶免分析仪和上海科华公司试剂检测;HBV DNA:采用PCR 法,上海达安试剂检测。肝功能:用Olympus AU2700 全自动生化分析仪检测。
HLA-A2等位型的鉴定:取100 μL 肝素抗凝新鲜全血,加入检测管和对照管,分别加入HLAA2-PE 及同型对照10 μL,室温避光孵育30 min,经溶血处理后用流式细胞仪(BD FACSCalibur)和美国BD 公司试剂检测。HBV 特异性CTL:试管中加入10 μL 藻红蛋白标记的HLA-肽四聚体和CD8-异硫氰酸荧光素、CD3-PC5,再加入100 μL 的肝素抗凝血,同时做同型对照,混匀室温避光孵育20 min,溶血洗涤后,流式细胞仪检测,以CD3+淋巴细胞设门计数50000 个CD8+细胞和HLA-肽四聚体双阳性细胞为特异性CD8+细胞,并以占总计数CD8+细胞的百分比表示,美国BD 公司试剂检测。HBV 基因型:采用PCR 微板核酸杂交-ELISA技术,PE9600 型基因扩增仪(美国PE 公司),试剂为第一军医大学基础生物医学诊断研究中心提供。引物及探针:选择前C 区的不同序列作为PCR引物和核酸杂交探针,6 个基因型通用的序列作为PCR 的引物和通用包被探针,而同一部位的不同序列作为各型的显色探针。显色探针5'标记生物素,由上海生物工程公司合成。引物序列:引物1,5'-CCCTTCTTCGTCTGCG-GTTCC-3'(ntl490-1510),引物2,5'-ACCAATTTATGCCTACAGCCTC-3'(ntl 798-1777),按说明书操作。
1.4 统计学方法
采用SPSS 17.0 统计软件。计数资料用百分数表示,采用χ2检验,计量资料用均数± 标准差(¯±s)表示,采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 HBeAg 血清学转换率
HBeAg 阳性50例中发生HBeAg 转阴14例(28%);HBeAg 血清学转换9例(18%),无HBeAg血清学转换41例(82%)。
2.2 HBeAg 血清学转换率与HBV 基因型的关系
HBeAg 血清学转换9例中,B 基因型7例,占B基因型30.77%,C 基因型1例,占C 基因型4.17%;两种基因型比较,差异有统计学意义(χ2=4.32,P<0.05)。
2.3 CHB 患者治疗前与治疗后12 个月肝功能、HBV DNA 和HBV 特异性CTL 水平比较
80例CHB 患者治疗前与治疗后12 个月肝功能、HBV DNA 和HBV 特异性CTL 水平比较,见表1。
表1 治疗前与治疗后12 个月患者肝功能、HBV DNA 和HBV 特异性CTL 水平比较±s
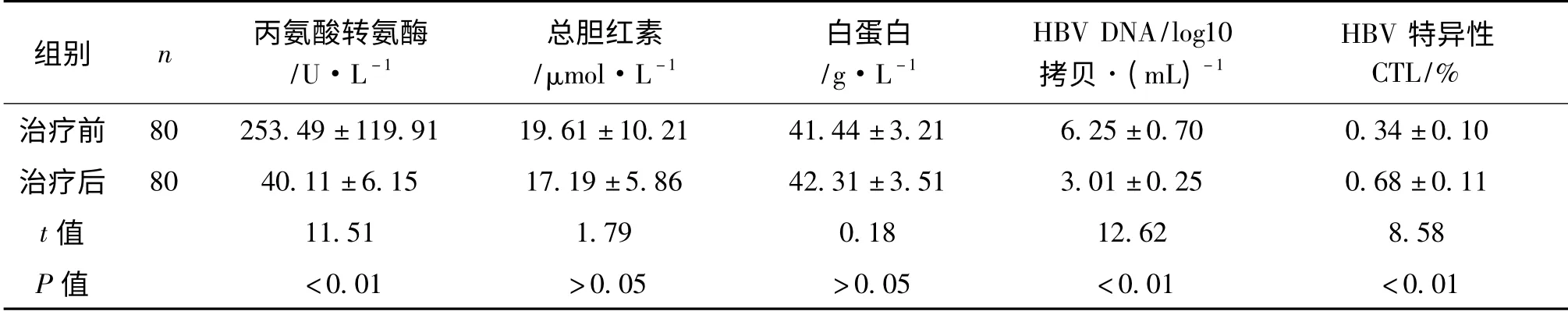
表1 治疗前与治疗后12 个月患者肝功能、HBV DNA 和HBV 特异性CTL 水平比较±s
组别 n 丙氨酸转氨酶/U·L -1总胆红素/μmol·L -1白蛋白/g·L -1 HBV DNA/log10拷贝·(mL)-1 HBV 特异性CTL/%治疗前 80 253.49 ±119.91 19.61 ±10.21 41.44 ±3.21 6.25 ±0.70 0.34 ±0.10治疗后 80 40.11 ±6.15 17.19 ±5.86 42.31 ±3.51 3.01 ±0.25 0.68 ±0.11 t 值 11.51 1.79 0.18 12.62 8.58 P 值<0.01 >0.05 >0.05 <0.01 <0.01
3 讨论
目前研究认为,乙型肝炎的发病机制主要是机体清除HBV 而引发的细胞免疫病理改变;机体清除HBV 的细胞免疫机制可分为特异性与非特异性2种,其中特异性细胞免疫应答可能是机体清除病毒的重要途径。HBV 特异性CTL 应答在乙型肝炎发病机制中的作用日益受到重视,在未经治疗的慢性乙型肝炎患者体内,往往存在T 细胞的低反应[1]。本研究显示,除能明显降低CHB 患者ALT 及HBV DNA 外,阿德福韦酯还能提高CHB 患者的HBV 特异性CTL 功能,治疗12 个月后HBeAg 血清学转换者与HBV 特异性CTL 水平升高可能有关,并可能与HBV 基因型有关。
国外研究认为阿德福韦酯的抗病毒作用与HBV 基因型无关[2],这主要是由于国外研究多关注基因A 型与D 型,观察基因B 型与C 型较少,而我国患者感染以基因B 型与C 型为主[3]。曾爱中等[4]研究认为,阿德福韦酯治疗慢性乙型肝炎48 周时,部分病毒学指标(如血清HBV DNA 下降均值和HBV DNA 阴转率)B 基因型HBV 感染者优于C 基因型。本研究发现,HBeAg 血清学转换者9例中,B基因型7例(占B 基因型30.77%),C 基因型2例(占C 基因型4.17%),B 基因型HBeAg 血清学转换明显高于C 基因型。据此推断,HBV 基因型(B型与C 型)可能是阿德福韦酯治疗HBV 患者发生HBeAg 血清学转换的影响因素之一。
[1]Rehermann B,Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection[J]. Nat Rev Immunol,2005,5(3):215-229.
[2]Westland C,Delaney WT,Yang H,et al. Hepatitis B virus genotypes and virologic response in 694 patients in phase Ⅲstudies of adefovirdipivoxil[J]. Gastroenterology,2003,125(1):107-116.
[3]Zeng G,Wang Z,Wen S,et al. Geographicdistribution,virologic and clinical characteristics of hepatitis B virus genotypes in china[J]. J Viral Hepat,2005,12(6):609-617.
[4]曾爱中,邓惠,彭凤英,等. B 和C 基因型乙型肝炎病毒对阿德福韦酯治疗的病毒学应答比较[J].中华肝脏病杂志,2008,16(6):412-415.

