重组青霉素G酰化酶拆分制备(S)-邻氯苯甘氨酸
刘 学,薛亚平,柳志强,王亚军,郑裕国
(浙江工业大学 生物工程研究所 教育部生物转化与生物净化工程研究中心,杭州 310014)
(S)-邻氯苯甘氨酸[(S)-2-chlorophenyl glycine]是一种具有生物活性的非天然氨基酸,同时也是合成新型抗血小板聚集药物氯吡格雷的一种重要中间体[1]。氯吡格雷(Clopidogrel)是由法国Sanofi公司于1986年研制开发的新型的抗血小板凝聚药物[2]。与传统的抗血小板药物阿司匹林、噻氯吡啶相比,氯吡格雷作用强度和耐受性大大增强,而副作用并没有增高。在抗血栓药物中,氯吡格雷市场占有率一路领先,是目前最畅销的药物之一[3]。近年来,氯吡格雷合成工艺主要是利用手性砌块进行不对称合成技术[4],其中(S)-邻氯苯甘氨酸或(R)-邻氯扁桃酸为主要的手性砌块。因此,探索生物法制备光学纯的(S)-邻氯苯甘氨酸的途径意义重大。
(S)-邻氯苯甘氨酸及其甲酯制备传统方法是化学拆分或不对称合成方法,大多以D-樟脑磺酸[5-8]和 L - 酒石酸[9-12]为拆分剂,但拆分后得到的(S)-邻氯苯甘氨酸光学纯度不高,影响终端产物氯吡格雷的光学纯度。生物催化法拆分具有选择性高、收率高、反应条件温和等优点。目前,生物催化法拆分制备(S)-邻氯苯甘氨酸的报道较多[13-17]。这些研究都有一定的不足,或是反应条件苛刻(需无氮环境),或是产物转化率和选择性不高等。而青霉素G酰化酶源易得,用来制备(S)-邻氯苯甘氨酸的工艺较简单[18-19],但国内外这一方面的报道并不多。
青霉素G酰化酶(penicillin G acylase,PGA)已经适用于多种消旋氨基酸拆分,笔者拟在对青霉素G酰化酶表达条件优化的基础上,以(R,S)-邻氯苯甘氨酸为原料经酰化得N-苯乙酰-(R,S)-邻氯苯甘氨酸,利用PGA催化拆分N-苯乙酰-(R,S)-邻氯苯甘氨酸制备(S)-邻氯苯甘氨酸,未水解的N-苯乙酰-(R)-邻氯苯甘氨酸进行消旋化反应生产成N-苯乙酰-(R,S)-邻氯苯甘氨酸继续循环拆分。工艺路线如图1所示。

图1 重组青霉素G酰化酶催化法制备(S)-邻氯苯甘氨酸Fig.1 Preparation of(S)-2-chlorophenylglycin using penicillin G acylase
1 材料与方法
1.1 菌种和培养基
菌种:重组枯草芽胞杆菌基因工程菌由浙江工业大学生物工程研究所构建和保藏,该工程菌具有卡那霉素抗性标记(Kanr),重组菌不需诱导便能高效表达青霉素G酰化酶。
种子培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,卡那霉素 50 μg/mL,pH 7.0。
发酵培养基:种子培养基基础上再添加各种C、N源进行优化。
1.2 仪器与材料
Dionex UltiMate 3000高效液相色谱仪,美国戴安公司;Bruker Avance III 500 MHz全数字化傅里叶超导核磁共振谱仪,瑞士Bruker公司;Autopol IV鲁道夫全自动旋光仪,美国鲁道夫公司;恒温培养振荡器 NSKY,上海苏坤实业有限公司;Hei-VAP Advantage旋转蒸发仪,德国Heidolph公司;SHZ-88A往复式水浴恒温振荡器,金坛市杰瑞尔电器有限公司;DF-101S集热式恒温加热磁力搅拌器,河南巩义市予华仪器有限公司。
(R,S)-邻氯苯甘氨酸、(S)-邻氯苯甘氨酸,上海海曲化工有限公司;苯乙酰氯,上海玛耀化学技术有限公司;其他试剂均为市售分析纯。
1.3 菌体培养及比酶活、生物量的测定
1.3.1 菌体培养
从甘油管中取出保存的菌株,划线接种于含卡那霉素的固体培养基平板上,在37℃培养箱中培养约12 h,从平板上挑取单菌落接种于种子培养液内,37℃培养过夜。然后以2%接种量转接到含有100 mL培养液的500 mL三角瓶中。
1.3.2 酶活的测定
在50 mL具塞三角瓶中加入含10 mmol/L N-苯乙酰-(R,S)-邻氯苯甘氨酸的磷酸钠缓冲液(100 mmol/L、pH 8.0)5 mL,于 30℃转速为180 r/min水浴摇床上预热5 min后,加0.2 mL发酵上清液,反应6 min,取1 mL置于已加入20 μL 6 mol/L NaOH的 EP管中终止反应,在12 000 r/min、4℃的条件下离心10 min,取上清液,用 HPLC检测。
在30℃、pH 8.0条件下,每分钟催化N-苯乙酰-(R,S)-邻氯苯甘氨酸生成1 μmol的(S)-邻氯苯甘氨酸所需的酶量,即为1个酶活力单位(U)。
1.3.3 生物量的测定
采用干质量法,取一定体积的发酵液,将菌体离心收集后置于烘箱中,80℃烘干至恒质量,每个样平行3次。
1.4 N-苯乙酰-(R,S)-邻氯苯甘氨酸的制备
N-苯乙酰-(R,S)-邻氯苯甘氨酸的合成方法参照Fadnavis等[18]报道的方法。液相色谱测定产品纯度为 99.36%,见图 2。1H NMR(500 MHz,DMSO)δ 13.10(s,1H),8.95(s,1H),7.48(s,1H),7.37(s,2H),7.28(s,5H),7.22(s,1H),5.79(s,1H),3.56(s,2H)。

2 N-苯乙酰-(R,S)-邻氯苯甘氨酸高效液相色谱图Fig.2 Chromatogram of N-phenylacetic-(R,S)-2-chlorophenylglycine
1.5 酶法拆分 N-苯乙酰 -(R,S)-邻氯苯甘氨酸
在500 mL锥形瓶中加入4.856 g N-苯乙酰-(R,S)-邻氯苯甘氨酸,再加入50 mL 2%氨水溶解,用2 mol/L盐酸调pH至10.0,加入728 U青霉素G酰化酶(发酵上清液40 mL),补水定容到200 mL,在40℃、180 r/min水浴中水解反应4 h。
1.6 分析方法
产物及底物浓度的检测方法:采用HPLC法检测。色谱柱为Hypersil ODS2-C18柱(4.6 mm×250 mm,5 μm,Elite,China);流速 0.7 ml/min;流动相V(乙腈)∶V(0.1%高氯酸水溶液)=1∶1;检测波长220 nm;进样量10 μL;柱温30℃。(S)-邻氯苯甘氨酸的保留时间是4.307 min,苯乙酸的保留时间是5.417 min,N-苯乙酰-(R,S)-邻氯苯甘氨酸的保留时间是6.470 min。
产物及底物浓度的手性检测方法:用色谱柱为反相手性柱,Chirobiotic R手性柱(4.6 mm×250 mm,5 μm,Sigma,USA),流动相 V(0.5% 乙酸)∶V(乙腈)=20∶80,流速 1 mL/min,检测波长 220 nm,进样量3 μL;柱温30℃。N-苯乙酰-(S)-邻氯苯甘氨酸的保留时间是3.127 min;N-苯乙酰-(R)-邻氯苯甘氨酸的保留时间是3.713 min;(S)-邻氯苯甘氨酸的保留时间是10.207 min;(R)-邻氯苯甘氨酸的保留时间是12.350 min。
(S)-邻氯苯甘氨酸的光学纯度通过计算对映体过量值(e.e.)来评价,e.e.=[cS- cR]/[cS+cR]×100%,其中,cS和cR为S型和R型异构体的浓度;
酶的对映体选择率(E)根据Chen等[20]的公式进行计算,E=ln[1 - c(1+e.e.)]/ln[1 - c(1 -e.e.p)],其中 e.e.为产物(S)-邻氯苯甘氨酸的对映体过量值。
2 结果与讨论
2.1 重组菌表达PGA的SDS-PAGE电泳分析
重组枯草芽胞杆菌基因工程菌表达的PGA是由大小约为2.4×104的α-亚基和6.1×104的β-亚基形成的杂合二聚体。将重组菌发酵液离心制备上清液试样,进行SDS-PAGE电泳分析,结果如图3所示。由图3可见清晰的PGA的α-亚基和β-亚基,表明重组枯草杆菌系统能够将表达的PGA分泌到细胞外。

图3 上清液的SDS-PAGE电泳图Fig.3 SDS-PAGE of supernatant of recomibinant B.subtilis WB 800
2.2 重组菌表达PGA条件的优化
2.2.1 C源对菌体生长和产酶的影响
研究9种C源(葡萄糖、糊精、甘油、蔗糖、可溶性淀粉、麦芽糖、山梨醇、甘露醇、乳糖)对重组菌PGA表达的影响,结果见图4。从图4(a)可知:可溶性淀粉和糊精是较佳的产酶和菌体生长C源,发酵液中PGA的比酶活分别达到11.98和11.52 U/mL,与对照(不添加C源)酶活7.34 U/mL相比,比酶活分别提高了163%和157%,而添加葡萄糖糖、山梨醇、甘油和甘露醇反而不利于PGA的表达,因此选择可溶性淀粉作为菌株培养基的C源物质。进一步考察了不同浓度的可溶性淀粉对菌体生长和PGA表达的影响,结果如图4(b)所示。发现当可溶性淀粉质量浓度为10 g/L时,发酵液中PGA的酶活最高,继续增加可溶性淀粉菌体浓度有所增大,但对PGA表达影响很小。选择可溶性淀粉的浓度为10 g/L作为菌株后续优化的C源浓度。
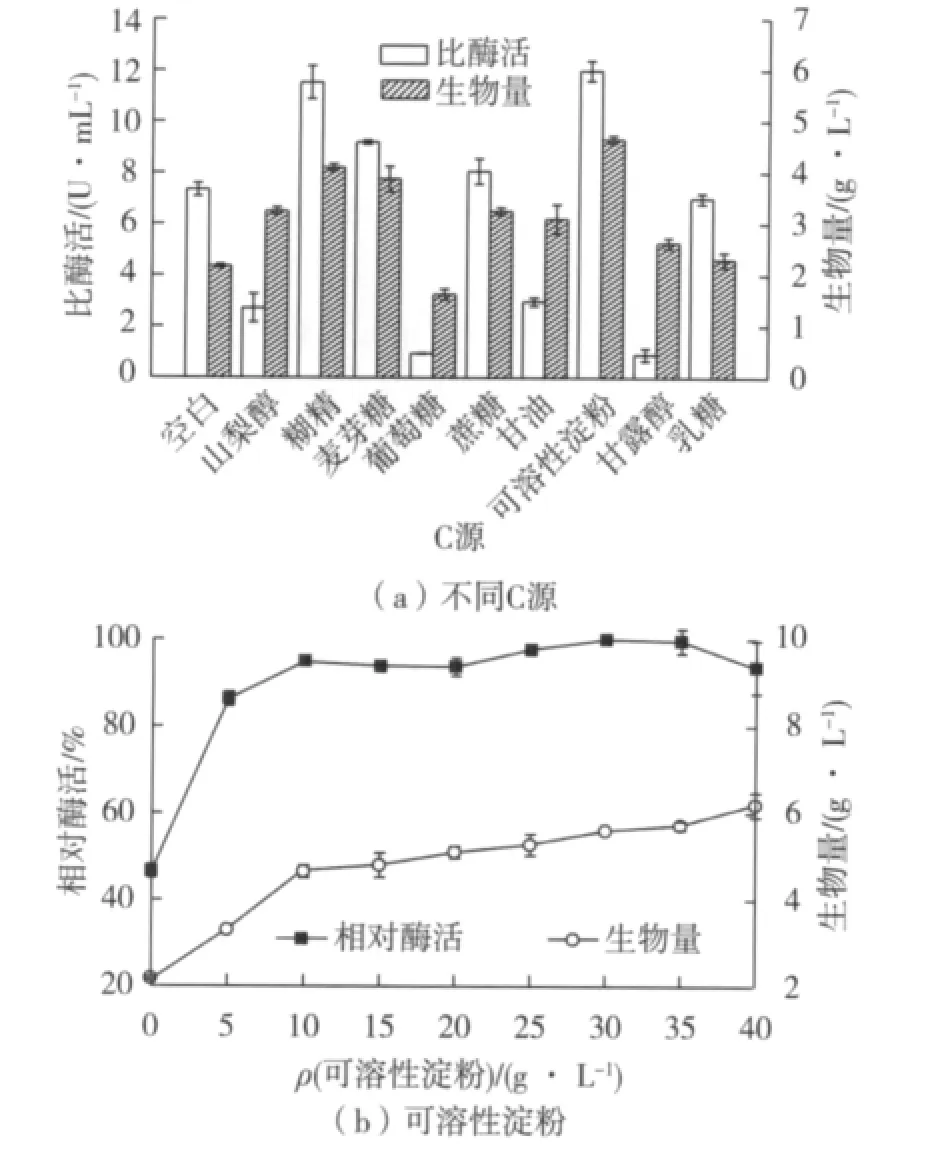
图4 C源对菌体生长及PGA表达量的影响Fig.4 Effects of carbon sources on strain growth and PGA expression
2.2.2 N源对菌体生长和产酶的影响
考察8种有机N源及其组合(酵母粉、蛋白胨、玉米浆、黄豆饼粉、牛肉膏、牛肉膏和蛋白胨、牛肉膏和酵母粉、蛋白胨和酵母粉)和4种无机N源(NH4Cl、(NH4)2SO4、NH4NO3、尿素)对产酶和生长的影响,结果见图5。由图5(a)的结果可知:有机N源的效果要好于无机N源,在含有机N源的培养基中,菌体的生长较好,产生的菌体量也多。以蛋白胨和酵母粉复配作为N源,发酵液中PGA比酶活达到12.58 U/mL,因此选择了蛋白胨和酵母粉复配作为N源。进一步考察了复合N源中不同蛋白胨/酵母粉比例对菌体生长和产酶的影响,如图5(b)所示,发现当其比例为4∶1即12 g/L蛋白胨加3 g/L酵母粉时,菌体生长和产酶均达到极大值。

图5 不同N源对菌体生长及PGA表达量的影响Fig.5 Effects of nitrogen sources on strain growth and PGA expression
2.2.3 初始pH对菌体生长和产酶的影响
研究了发酵培养基的初始pH对重组菌生长和PGA表达的影响,结果见表1。由表1可以看出:初始pH对菌体生长影响不大,但对菌株产酶影响较大。当pH低于7.0时,PGA活力较低,初始pH在7.0~7.5范围内,菌株的PGA活力比较高,其中在pH 7.5时菌株的比酶活达到最高(13.04 U/mL)。pH继续增大至弱碱性时,酶活力呈下降趋势,因此培养该菌株时将培养基的初始pH调至7.5。

表1 初始pH对重组菌生长和PGA表达的影响Table 1 Effects of initial pH on strain growth and PGA expression
2.2.4 培养温度对菌体生长和产酶的影响
研究了培养温度对菌体生长和PGA活力的影响,选择了25、28、30、34、37、40 ℃作为考察的温度,结果见表2。发现温度过低(25℃)不利于菌株的生长,温度在28~34℃范围内,菌体生长良好但酶活偏低,且酶活都是随着温度的增大而增大,菌株在37℃条件下生长最好,酶活最高,发酵液中酶活达13.76 U/mL。温度进一步升高,比酶活有降低趋势,所以选择培养温度为37℃。

表2 温度对重组菌生长和PGA表达的影响Table 2 Effects of temperature on strain growth and PGA expression
2.2.5 摇瓶装液量对重组菌生长和产酶的影响
好氧微生物在培养时,需要足够的溶解氧来维持其生长和代谢。发酵液的溶氧水平又受到摇床振荡方式、摇床转速和培养基装液量等的影响。考察了摇床转速为150 r/min、500 mL时的三角瓶中不同装液量对生物量和产酶的影响,结果见图6。由图6可知,溶氧水平对酶活有较大影响。当装液量为80 mL/(500 mL三角瓶)时,生物量和比酶活均达到极值,比酶活为13.9 U/mL,随后装液量继续增加,PGA活力迅速下降。

图6 摇瓶装液量对菌体生产和产酶的影响Fig.6 Effects of medium volume on strain growth and PGA activity
2.2.6 间歇培养过程中菌体生长及产酶曲线
发酵瓶接种后,在优化后的培养条件下发酵培养,定时取样测定发酵液的pH、菌体浓度和比酶活等参数,结果见图7。由图7可知:在菌体培养过程中,发酵液的pH随培养时间的增加先略微下降再逐渐升高,可能因为在对数生长期菌体生长过快,导致溶氧不足发生厌氧呼吸产生酸导致pH下降,后期随着C源消耗完,利用N源释放出氨及菌体自溶导致pH上升。发酵菌体生长在15 h进入稳定期后,菌株产PGA水平显著增加,说明PGA主要是在稳定期完成加工成熟[21-22],在28 h左右 PGA活力达到最高值18.23 U/mL,此时生物量也达最大5.5 g/L。随后菌株进入衰亡期,生物量和比酶活开始下降。因此发酵培养28 h为宜。

图7 间歇培养过程中菌体生长和产酶时间曲线Fig.7 Time courses of cell growth and PGA activity in batch culture
2.3 酶促反应条件的研究
2.3.1 酶促反应的时间进程
将4.856 g(80 mmol/L)N -苯乙酰 -(R,S)-邻氯苯甘氨酸溶于20 mL 5%氨水中,用2 mol/L盐酸调pH至10.0,加入728 U青霉素G酰化酶(发酵上清液40 mL),补水定容到200 mL,在40℃,180 r/min水浴中反应,定时取样测定酶解产生的(S)-邻氯苯甘氨酸。考察反应时间与产物(S)-邻氯苯甘氨酸生成量的关系,结果见图8。由图8可知:在50 min以内反应速度较快,在50~180 min之间反应速度减缓,在210 min以后(S)-邻氯苯甘氨酸的浓度基本稳定在39.88 mmol/L,酶促反应时间以3.5~4 h为宜,N-苯乙酰-(R,S)-邻氯苯甘氨酸的摩尔转化率达到49.85%。同时用反相手性柱分析了产物的光学纯度,e.e.p大于 99.9%,对映体选择性大于200。该酶具有高度的立体选择性,适用于制备高光学纯的(S)-邻氯苯甘氨酸。

图8 酶促反应过程与底物、产物浓度的变化趋势Fig.8 Effects of enzymatic reaction time on substrate and product concentration
2.3.2 底物浓度对酶法拆分的影响
在pH为10条件下,加酶量为18 U青霉素G酰化酶(1 mL发酵液上清),5 mL反应体系中,改变底物N-苯乙酰-(R,S)-邻氯苯甘氨酸浓度(30~160 mmol/L),在恒温40℃水浴中反应,在6 min测初速度,4 h测定反应转化率及产物e.e.值,结果如图9所示。由图9可知:当底物浓度低于120 mmol/L时,酶促反应的初速率随着底物浓度的增大而增大,在底物浓度为120 mmol/L时,达到最大反应初速率17.74 μmmol/(min·mg),继续增大底物浓度时反应的初速率随之下降,这可能是由底物对酶的抑制作用引起的。在底物浓度小于90 mmol/L时,转化率接近50%,但是产物量偏低,没有工业化优势。继续增大底物浓度,转化率降低,在底物浓度为100 mmol/L时,转化率达到 44.2%。另外产物 e.e.值始终保持在99.9%以上,可见该酶的对映体选择性不受底物浓度影响。

图9 底物浓度对初速率、转化率及e.e.p值的影响Fig.9 Effects of substrate concentration on conversion,initial rate and e.e.p
2.4 (S)-邻氯苯甘氨酸的制备
N-苯乙酰-(R,S)-邻氯苯甘氨酸4.856 g溶于5%氨水中,HCl调pH至10.0,加40 mL酶液,补水定容到200 mL,40℃、180 r/min水浴中反应4 h。反应结束后,将反应液65℃减压浓缩至50 mL,置于冰浴中,用6 mol/L的HCl调节pH至2.0,有大量白色沉淀析出。抽滤,烘干得N-苯乙酰-(R)-邻氯苯甘氨酸和苯乙酸的混合物3.3 g。剩余滤液加入乙酸乙酯(3×20 mL)萃取出剩余的微量的苯乙酸。滤液调pH至7.0,减压蒸干得白色固体,再溶解于热异丙醇去除盐,旋转蒸干得(S)-邻氯苯甘氨酸1.4 g,收率94.29%(以起始原料N-苯乙酰-(R,S)-邻氯苯甘氨酸的0.5倍摩尔量计)。[α]=+90(c 1,1 mol/L HCl),文献值[18][α]=+89(c 1,1 mol/L HCl)。e.e.p大于99.9%。1H NMR(500 MHz,D2O)δ 7.52(d,J=8.0 Hz,1H),7.50 ~7.34(m,3H),5.15(s,1H)。
2.5 N-苯乙酰-(R)-邻氯苯甘氨酸的消旋
将上述N-苯乙酰-(R)-邻氯苯甘氨酸与苯乙酸的混合物置于圆底烧瓶中,油浴加热至170℃共熔消旋15 min,置于冷水进行冷却,取样溶于甲醇,测旋光度为0,消旋率100%。共熔消旋物用热环己烷萃取3次(3×100 mL)除去苯乙酸,固体烘干的得到N-苯乙酰-(R,S)-邻氯苯甘氨酸2.3 g,提取收率94.73%。
3 结论
在优化后培养条件下,可溶性淀粉10 g/L、蛋白胨12 g/L 、酵母粉3 g/L、NaCl 10 g/L;pH 7.5、培养温度37℃、装液量80 mL(500 mL三角瓶),发酵28 h后发酵液的青霉素G酰化比酶活达到18.23 U/mL,相比于优化前比酶活提高了2.48倍。利用重组枯草芽胞杆菌分泌表达的青霉素G酰化酶液拆分制备(S)-邻氯苯甘氨酸,收率94.29%,e.e.p大于99.9%。N-苯乙酰-(R)-邻氯苯甘氨酸与苯乙酸共熔消旋为N-苯乙酰-(R,S)-邻氯苯甘氨酸,收率达94.7%,可继续用于循环拆分。该法具有制备工艺简单、催化效率高、环境友好、立体选择性强、发酵成本低等特点,具有很好的工业应用价值,后期可以考虑将酶进行固定化,以提高酶的使用效率,应用于工业化生产中。
[1] BousquetA,Muslino A.Hydroxyacetic ester derivatives,preparation method and use as synthesis intermediates:US,6573381B1[P].2003-06-03.
[2] HerbertJ M,SaviP,Maffrand J P.Biochemicaland pharmacological properties of clopidogrel:a new ADP receptor antagonist[J].Eur Heart J Suppl,1999,1(Sup):31-40.
[3] Campo G,Fileti L,de Cesare N,et al.Long-term clinical outcome based on aspirin and clopidogrel responsiveness status after elective percutaneous coronary intervention[J].J Am College Cardiol,2010,56(18):1447-1455.
[4] 王威,薛亚平,郑裕国.氯吡格雷生产技术研究进展[J].现代化工,2011,31(5):30-34.
[5] Lin S S-S,Chen C C.Process forpreparation of2-chlorophenylglycine derivatives and enantiomerically separation:US,20040176637[P].2004-09-09.
[6] 梁美好,沈正荣.(+)-氯吡格雷的合成工艺改进[J].中国药物化学杂志,2007,17(3):163-165.
[7] 杨华铮,宋洪海.硫酸氢氯吡格雷的制备方法:中国,101121720A[P].2008-02-13.
[8] 沈立新,袁利,刘福双,等.一种新的制备氯吡格雷及其盐的方法:中国,101787032A[P].2010-07-28.
[9] Maheshwari K K,Sarma R K,Joshi S V,et al.Racemization of optically active 2-substituted phebyl glycine esters:US,20040073057[P].2004-04-15.
[10] Battula S R.A process for resolution of methylamino(2-chloprophenyl)acetate:WO,2006003671A1[P].2006-01-12.
[11] 丁桂俐,赵敏,吴范宏,等.邻氯苯甘氨酸甲酯的拆分[J].广州化工,2007,35(6):44-48.
[12] 吴范宏,赵敏,杨雪艳,等.一种S-(+)-邻氯苯甘氨酸甲酯的拆分方法:中国,101497575A[P].2009-08-05.
[13] Katoh O,Uragaki T,Nakamura T.Process for producing optically active α-amino acid and optically active α-amino acid amide:WO,0187819A1[P].2001-11-22.
[14] Asano Y,Inoue A.L-amino acid amide asymmetric hydrolase and encoding the same:EP,1770166 A1[P].2007-04-04.
[15] 舒亮,包志坚,林昌军,等.一种S-(+)-邻氯苯甘氨酸的制备方法:中国,101560533A[P].2009-10-20.
[16] Ferraboschi P,Mieri M D,Galimberti F.Chemo-enzymatic approach to the synthesis of the antithrombotic clopidogrel[J].Tetrahedron:Asymmetry,2010,21:2136-2141.
[17] Hwang S O,Kim K S,Kim Y J.Method for preparing clopidogrel and its derivatives:WO,2009151256 A2[P].2009-12-17.
[18] Fadnavis N W,Devi V A,Jasti L S.Resolution of racemic 2-chlorophenyl glycine with immobilized penicillin G acylase[J].Tetrahedron:Asymmetry,2008,19:2363-2366.
[19] 夏仕文,方国兰.一种制备氯吡格雷手性中间体(S)-邻氯苯甘氨酸甲酯的化学 -酶法:中国,101864464A[P].2010-10-20.
[20] Chen C S,Fujimoto Y,Girdaukas G,et al.Quantitative analyses of biochemical kinetic resolutions of enantiomers[J].J Am Chem Soc,1982,104:294-1299
[21] De Leon A,Galindo E,Ramirez O T.A postfermentative stage improves penicillin acylase production by a recombinant E.coli[J].Biotechnol Lett,1996,18(18):927-932.
[22] De Leon A,Hernandez V,Galindo E,et al.Effects of dissolved oxygen tension on the production of recombinant penicillin acylase in Escherichia coli[J].Enzyme Microb Technol,2003,33(5):689-697.

