食品中甜菊糖甙检测方法研究进展
尤继明等
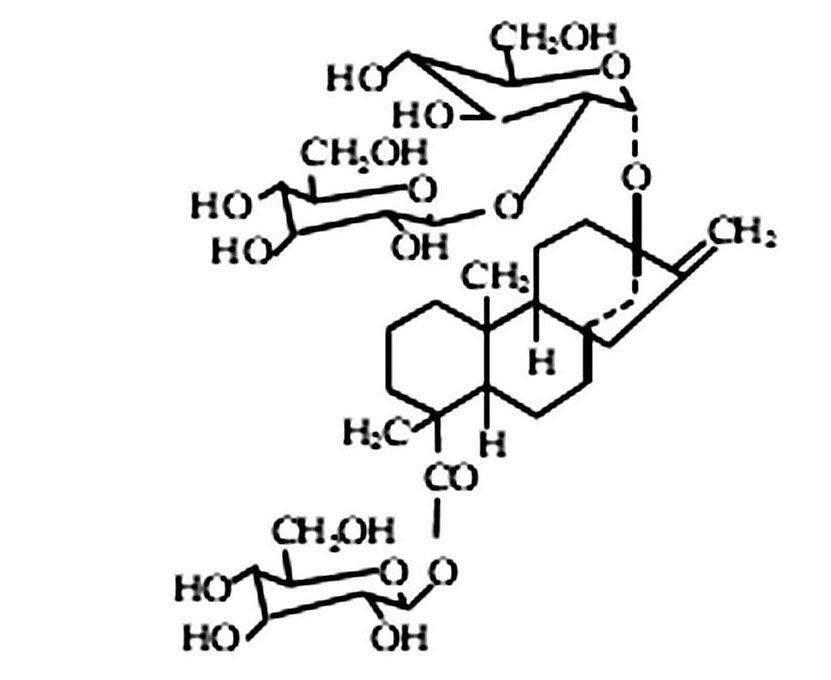
摘 要:介绍了甜菊糖甙的分子结构和理化性质,并综述食品中甜菊糖甙的检测方法,如薄层层析法、分光光度法、毛细管电泳法、液相色谱法等,并展望了食品中甜菊糖甙检测的前景。
关键词:甜菊糖甙;食品;检测方法
中图分类号 TS201.1 文献标识码 B 文章编号 1007-7731(2013)06-140-03
甜菊糖甙(Stevia)又称作甜菊糖(Stevia sugar),为甜叶菊叶子提取物,不含糖分和热量;色泽白色至微黄色,口感适宜、无异味,是发展前景广阔的新糖源。甜菊糖苷是目前世界已发现并经我国卫生部批准使用的甜味剂,其天然低热值并且非常接近蔗糖口味,是继甘蔗、甜菜糖之外第3种有开发价值和健康推崇的天然甜味剂,被国际上誉为“世界第三糖源”,其具有高甜度、低热量、安全无毒等特点,是一种可替代蔗糖的非常理想的甜味剂[1-3]。甜叶菊糖苷的物理、化学性能稳定,无发酵性,无代谢性,长期食用不会使人发胖,特别适宜高血压、糖尿病、肥胖病、龋齿病患者使用,由此甜菊糖甙广泛应用于食品、饮料、调味料、酿酒、医药、日用化工、酿酒、化妆品等行业。甜菊糖主要含有甜菊糖苷(stevioside,SS)、莱鲍迪苷A(rebaudioside A,RA) 、莱鲍迪苷C[7](rebaudioside C,RC)等8种成分[4],莱鲍迪苷A是其中品质最好的成分。
20世纪50年代人工种植甜叶菊成功后,日本、马来西亚、中国、韩国、阿根廷、巴拉圭、巴西等20多个亚洲和拉美国家开始批准使用[5],美国食品药品管理局2008年批准使用甜叶菊提取物莱鲍迪苷A后,甜叶菊产业受到广泛关注,我国卫生部颁布的《食品安全国家标准 食品添加剂使用卫生标准》(GB2760-2011) [6]规定甜菊糖甙的使用范围为蜜饯、坚果及其仔类、糖果、膨化食品、糕点、调味品、饮料等食品,最大使用量按照生产需要适量使用。
目前,针对甜菊糖甙的检测有以下几种方法:薄层色谱法[7-8]、分光光度法[9]、毛细管电泳法[10-11]、高效液相色谱法[12-16]、流动注射分析法[17]等。
1 甜菊糖甙的理化性质
甜菊甙结构式为:
分子式为C38H60O18,分子量为804.86。甜菊糖甙为白色至浅黄色结晶或粉末,吸湿性不大。密度1.53g/cm3,熔点198℃,沸点963.3℃。易溶于水、乙醇,不溶于丙二醇或乙二醇,与蔗糖、果糖、葡萄糖、麦芽糖等混合使用时,不仅甜菊糖苷甜味更纯正,且甜度可起到协同增效效果。同时甜菊糖苷具有良好的耐热耐光性,在pH值3~10范围内十分稳定,易存放。溶液稳定性好,在一般饮料食品的pH范围内,进行加热处理仍很稳定。甜菊糖苷在含有蔗糖的有机酸溶液中存放半年变化不大;在酸碱类介质中不分解,可防止发酵、变色和沉淀;对光稳定,长期储存不会腐败变质;发热量极低,其卡值基本接近零。
2 甜菊糖甙检测方法进展
2.1 薄层层析法 薄层层析法(thin layer chromatography)又称薄层色谱,是快速分离和定性分析少量物质的一种重要实验技术,属固—液吸附色谱,兼备了柱色谱和纸色谱的优点,一方面适用于少量样品(几微克,甚至0.01μg)的分离;另一方面在制作薄层板时,把吸附层加厚加大,用来精制样品,此法特别适用于挥发性较小或较高温度易发生变化而不能用气相色谱分析的物质,是较早用于甜菊糖的分析检测方法之一。
张志[7]等选择适宜的展开剂和显色剂等建立了一种定性鉴别甜叶菊糖苷中含有Stevioside(St)和Rebaudioside A(RA)2种主要成分的实验方法,此法对分离和测定它们不仅灵敏度高而且简单易行,可作为甜菊糖苷测定的常规手段。王圣刚[8]等用薄层层析法对甜叶菊种子所含糖苷进行分析,比对不同显色剂的显色效果,找到了合适的显色剂,定性分析了甜叶菊种子中糖苷成分。
2.2 分光光度法 分光光度法是通过测定被测物质在特定波长处或一定波长范围内光的吸光度或发光强度,对该物质进行定性和定量分析的方法。甜菊糖苷的苷元是四环二萜类化合物,在C-4位上的羧基上连接着一个葡萄糖基,在C-13位上以槐糖形式连接2个葡萄糖基,构成甜菊糖苷。水解条件下,甜菊糖苷可以脱落葡萄糖,与蒽酮试剂反应生成有色化合物,从而进行分析测量。
项秀珠[9]等用乙醚萃取法去除甜菊叶中的脂溶性杂质;用无水乙醇为溶剂达到了提取完全之目的;提取液通过硅胶层析柱去除醇溶性杂质,获得了纯度较高的甜菊甙提取液。提取液在酸性介质中水解后,使甜菊甙基因上的葡萄脱落,与蒽酮试剂显色反应产生绿色的稳定溶液,在622nm处有一最大吸收峰,当甜菊甙含量在0~80μg/mL范围内符合比尔定律,建立了应用分光光度法测定甜菊甙的新方法。
2.3 毛细管电泳法 毛细管电泳是以弹性石英毛细管为分离通道,以高压直流电场为驱动力,依据样品中各组分之间淌度和分配行为上的差异而实现分离的电泳分离分析方法。甜菊糖苷可以在高电压的驱动下,在毛细管中实现与样品中其他各组分的分离,从而达到测定的目的。
邵寒娟[10]等人建立了一种用毛细管区带电泳法筛选甜菊糖苷突变体的有效方法。根据实验结果,优化的电泳条件为:60mmol/L Tris硼酸缓冲液(pH8.0),柱温30℃,工作电压25kV。优化条件下,甜菊苷(Stevioside)迁移时间的RSD为0.45%(15次),且在7.45×10-5~1.74×10-2mol/L的浓度范围内存在良好的线性关系(r=0.999 4),甜菊主要糖苷在5min内均可实现分离。刘露露[11]等将高效毛细管电泳法成功地运用到低热量食品中斯替维苷(St)和莱鲍迪苷(RA)含量的检测。研究试验参数对分离、检测的影响,得到优化的试验条件:在含有23%乙腈和7%甲醇的50mmol/L硼砂缓冲液(pH=10.10)中,RA和St在15min内得到良好的分离。RA和St分别在0.05~10.0mg/mL和0.06~10.0mg/mL的范围内浓度与电泳峰面积呈良好的线性关系,检测限分别为0.01mg/mL和0.02mg/mL。
2.4 高效液相色谱法 高效液相色谱法在经典色谱理论的基础上,采用了高压泵、化学键合固定相高效分离柱、高灵敏专用检测器等新实验技术建立的一种液相色谱分析法,分子量大、难气化、热稳定性差的生化样品及高分子和离子型样品均可检测,因此用途广泛。高效液相色谱法是目前分析甜菊糖甙最常用的分析方法,常用的检测器为二极管阵列检测器、紫外检测器、蒸发光散射检测器和示差折光检测器。
吴岩[12]等建立了高效液相色谱法测定甜叶菊粗糖苷中甜菊苷含量的方法。采用zorbax 80A Extend-C18 4.6mm×150mm 4μm色谱柱,MeOH-水(68∶32,体积比)为流动相,流动相流速1.0mL/min,利用二极管阵列检测器,确定最佳检测波长203nm,通过外标法计算甜菊苷的含量。李红[13]等利用大孔树脂吸附法提取甜叶菊中甜菊糖苷,HPLC采用Zorbax-NH2(250mm×4.6mm,5μm)色谱柱,流动相为乙腈-水(78:22,体积比),梯度洗脱,流速0.8mL/min,柱温30℃,测定波长210nm;进样量15μL,测定了14份不同产地的甜叶菊样品中甜菊糖苷含量。李爱峰[14]等人建立了高效液相色谱-蒸发光散射分离与检测甜菊糖中甜菊糖苷和莱鲍迪苷A的实验方法。色谱分离使用Kromasil NH2柱(50mm×4.6mm,5μm),流动相为85%乙腈水溶液,柱流出物采用蒸发光散射检测器检测,漂移管温度为85℃,空气作载气,流速为2.4L/min。甜菊糖苷和莱鲍迪苷A的线性范围分别为0.05~3.0mg/mL、0.05~3.7mg/mL,平均加标回收率分别为97.63%、99.25%, 相对标准偏差分别为1.04%、1.27%。刘超[15]等采用Kromasil NH2柱(250mm×4.6mm,5μm),以乙腈:水=75∶25为流动相,采用质谱检测器鉴定甜叶菊糖中主要的成分,ST和RA质量浓度分别为9.0~287.6mg/L和3.9~126.1mg/L时线性关系良好,两者平均回收率分别为98.61%和97.40%,RSD分别为2.3%和1.3%(n=5)。赵永良[16]等色谱柱采用Kromasil NH2柱(250mm×4.6mm,5μm),乙腈∶水=80∶20为流动相,采用紫外检测器和运用外标法测定甜菊糖甙中的R-A。其质量浓度在0.1~1.0mg/mL时线性关系良好,平均回收率在101.51%,RSD为1.22%。
2.5 其他检测方法 流动注射分析是20世纪70年代中期诞生并迅速发展起来的溶液自动在线处理及测定的现代分析技术。流动注射化学发光分析法是利用具有流速的试剂流的容量测定,即用聚四氟乙烯管代替烧杯和容量瓶,通过流动注射进行分析的方法。杨丹[17]等人利用以下原理:基于在NaOH碱性介质中,Fe(CN)63-可以直接氧化甜叶菊糖苷产生强的化学发光这一现象,并结合流动注射分析技术,提出了一种直接化学发光测定甜叶菊糖苷的新方法。该方法测定甜叶菊糖苷的线性范围为0.05~10mg/mL,检出限为0.05mg/mL。该方法已经成功用于甜叶菊叶片中糖苷含量的测定。
3 研究展望
甜菊糖甙甜度高、热量低,作为一种新型天然的甜味剂可广泛应用于各类食品和饮料中。随着甜菊糖甙的广泛应用,食品中甜菊糖含量的检测也越来越受到重视,也会有越来越多的检测方法被开发出来。在实际检测中,要基于不同的食品基质,采取灵活的检验方法,既能提高检测速度,又能满足检验需求。
参考文献
[1]朱焕铃,刘景彬,谢印芝. 甜菊糖甙的性质及在食品中的应用[J]. 食品研究与开发,2011,32(11): 189-192.
[2]Li Jie,Chen Zhenbin,Di Duolong. Preparative separation and puri?cation of Rebaudioside A from Stevia rebaudiana Bertoni crude extracts by mixed bed of macroporous adsorption resins[J]. Food Chemistry,2012,132: 268-276.
[3]Tomas Vanek,Ales Nepovym,Pavel Valycek. Journal of food composition and analysis,2001,14: 383.
[4]张亚雄,胡为民, 胡滨.甜菊糖中A3甙分离方法初探[J]. 中国食品添加剂,1998(4):48-49.
[5]邱洪冰,吴一华. 甜菊糖甙在食品饮料工业中的应用[J]. 添加剂,2010,13(3): 38-40.
[6]GB2760-2011《食品安全国家标准 食品添加剂使用卫生标准》[S].
[7]张志,滕祥金,郝再彬. 薄板层析法分析甜叶菊糖苷[J]. 中国调味品,2009,34(3): 94-98.
[8]王圣刚,王贵民. 薄层层析法分析甜叶菊(Stevia Rebaudiana)种子糖苷[J]. 黑龙江医药科学,2007,30(4): 48.
[9]项秀珠,郭秀珠. 应用UV-260紫外分光光度计测定甜菊甙的研究[C]. 第七届光谱分析学术讨论会论文集,1996.
[10]邵寒娟,胡涌刚,丁亮,等. 利用毛细管电泳法分析甜菊糖苷的含量[J]. 植物学通报,2001,18(1): 113-117.
[11]刘露露,顾正荣,饶琴. 毛细管电泳检测低热量食甜菊糖甙的含量[J]. 食品研究与开发,2009,30(4): 113-116.
[12]吴岩,杨长志,刘永,等. 高效液相色谱法测定甜叶菊粗糖苷中甜菊苷的含量[J]. 食品工业科技,214-215.
[13]李红,向增旭. HPLC法测定不同地甜叶菊中糖苷含量[J]. 江苏农业科学,2002,40(8): 306-307.
[14]李爱峰,孙爱玲,柳仁民,等. 高效液相色谱法-蒸发光散射测定甜菊糖中甜菊糖苷和莱鲍迪苷A的含量[J]. 食品工业科技,2011,32(4): 373-375.
[15]刘超,李来生,许丽丽,等. 高效液相色谱法测定甜叶菊糖中的 甜菊苷和菜鲍迪苷A[J]. 分析试验室,2007,26(7): 23-26.
[16]赵永良,崔媛,刘景彬,等. 高效液相色谱法测定甜菊糖甙中莱鲍迪甙A[J]. 食品科技,2009,34(9): 294-296.
[17]杨丹,郝再彬. 流动注射化学发光法测定甜叶菊糖苷[J]. 化学工程师,2005,115(4): 23-41.
(责编:徐世红)

