实时超声检测在脑海绵状血管瘤切除术中的应用研究
楼林 张健 赵元元 陈书达
实时超声检测在脑海绵状血管瘤切除术中的应用研究
楼林 张健 赵元元 陈书达
目的 探讨术中实时超声检测在脑海绵状血管瘤手术中的应用价值。 方法 将39例脑海绵状血管瘤患者按术中是否采用实时超声检测引导手术分为两组。超声引导组20例,术中通过超声检测显示海绵状血管瘤的位置、大小、形态、深度及其与周围组织和血管的关系,制定最佳手术入路,并通过实时扫描,监测病灶的切除情况,病灶切除后再次超声探查有无残留病灶和血肿。另19例为对照组,术中不用超声引导,其他均按传统方法手术。比较两组患者病灶切除时间、脑组织切开次数、切口肿瘤直径比值以及患者症状改善及并发症发生情况。 结果 (1)两组患者均无手术死亡,病灶均在手术显微镜下全切除。影像学与病理检查诊断符合率达100%。(2)两组患者病灶在手术显微镜下均被发现,超声引导组患者术中病灶显示率为100%,并完整显示病灶的大小、位置、范围及形态,准确定位。(3)脑组织切开次数超声引导组均在3次以下,而对照组仅10例(52.63%)在3次以下,7例(36.84%)达3次以上;切口肿瘤直径比值超声引导组为1.22±0.22,低于对照组的1.45±0.36;病灶平均切除时间超声引导组为(55.70±12.66)min,少于对照组的(82.16±31.23)min;并发症发生率超声引导组为5.00%,明显低于对照组的15.79%;两组上述数据的差异均有统计学意义(均P<0.05)。 结论 术中实时超声引导对脑海绵状血管瘤病灶的定位准确、可靠,能指导术者准确选择手术入路,避开重要的脑功能区、血管和其他重要结构,精准切除病灶,缩短手术时间,减少神经组织损伤和降低手术并发症发生率。
术中超声 定位 海绵状血管瘤
脑海绵状血管瘤(cerebral cavernous angiomas,CCA)也称海绵状血管畸形(cavernous malformation,CM),发病率约为0.5%[1-3]。随着MRI检查的广泛应用,临床上CCA检出率越来越高,是第3位常见的颅内血管畸形[4](约占颅内血管畸形的10%)。患者常因癫痫、自发性出血而就医,或因其他原因行MRI检查偶然发现无症状的CCA。由于CCA可反复出血,导致继发性癫痫,部分形成脑内血肿,最后导致神经功能障碍。本病目前尚无可靠的非手术疗法,故位于非重要结构区的CCA宜手术切除。但由于CCA位于脑组织内,体积一般较小,传统手术中往往因定位困难而手术费时,并可导致大脑皮层损伤甚至出现神经功能障碍。对此,近年来我科采用术中实时超声监测引导手术的方法,取得了良好效果,现报道如下,并与传统手术作对照。
1 对象和方法
1.1 对象 2009-12—2012-03我科手术治疗且病理检查证实、临床资料完整的CCA患者共39例,术前MRI检查均诊断为CCA,未合并其他颅内疾病。根据术中是否应用超声监测引导分为超声引导组和对照组。超声引导组20例,病灶直径8~33mm,平均(12.43± 6.19)mm,其中22例在20mm以下;病灶深度(肿瘤表面距大脑凸面皮层的距离)22~51mm,平均(29.86± 5.08)mm。对照组19例,病灶直径8~51mm,平均(13.43±6.07)mm,其中10例在20mm以下;病灶深度15~44 mm,平均(28.08±6.07)mm。两组患者病灶直径和深度的差异均无统计学意义(均P>0.05)。
1.2 方法
1.2.1 手术方法 两组患者均由同一组医师行显微神经外科手术切除病灶。常规开颅、去骨瓣,超声引导组患者使用Mylab30超声仪(意大利ESAOTE公司),凸阵探头表面涂耦合剂,外套无菌塑料套,利用超声定位初步评估脑内病灶位置、大小及深度,确定硬脑膜打开的范围及大小(以适合切除病变为宜)。打开硬脑膜后再次行超声检测,对病变进行定位,了解其与重要脑功能区的关系及血流情况,对比术前MRI所见,制定最佳的脑沟入路手术方案。选择合适脑沟,手术显微镜下解剖脑沟,用小功率电极轻灼脑沟处蛛网膜,经剥离子分离蛛网膜,勿伤及脑沟内动脉及引流静脉。自动脑板向两侧缓慢分离脑组织,逐渐扩大脑沟,用棉条保护两侧脑组织后向下探查。根据超声引导在最接近瘤体处切开皮层,此时常只需探查深入脑组织1cm左右即可见CCA并加以切除。位置较深的CCA先在超声引导下穿刺,并留置软性穿刺导管,然后循该导管迅速找到病灶。尽量完全切除CCA以及周边含铁血黄素沉积带,然后术腔灌注0.9%氯化钠溶液后行超声检查以判断有无残留病灶。最后止血,常规关颅。对照组患者依据术前CT或MRI定位对CCA行显微神经外科切除,手术方法基本同上。
1.2.2 观察指标及术后随访 记录硬膜打开暴露脑皮层至病灶切除时间为手术时间。记录脑组织切开次数。设定手术者切开脑组织建立手术腔道为1次脑组织切开。建立新的手术腔道或改变原有手术腔道的轴向都视为1次新增的脑组织切开。记录脑皮层组织切口与肿瘤直径比值,该比值定义为手术完成时脑皮层的实际切口长度和肿瘤最大径的比值。术后3周内出现原有神经功能障碍加重、偏瘫、癫痫及出血等均记入并发症。术后3 d和3个月患者分别行MRI检查,评定手术切除效果。随访1~2年,了解患者术后恢复情况。
1.3 统计学处理 采用SPSS 16.0统计软件。计量资料以 表达,组向比较采用两独立样本的t检验,计数资料组向比较采用χ2检验或Fisher精确概率法。
2 结果
2.1 手术结果 两组患者均未发生手术死亡或与手术相关的感染;术后3d MRI显示CCA均被完全切除;术后病理检查与术前影像学检查诊断符合率均为100%;均于手术显微镜下发现病灶。超声引导组患者术中超声均清楚显示病灶位置、大小和形态,与术前MRI所见吻合;其中1例在手术结束时再次超声扫描发现瘤腔内有少量深部血肿,手术显微镜下观察证实为隐蔽出血并得到及时处理。
2.2 脑组织切开次数 超声引导组患者脑组织切开次数均在3次以下,而对照组患者仅10例(52.63%)脑组织切开次数在3次以下,7例(36.84%)达3次以上,差异有统计学意义(P=0.003)。超声引导组中仅1例早期病例因对超声影像判定缺乏经验而脑组织切开2次,其余均为1次。对照组大多需要切开脑组织1次以上方能完成手术,最多1例术中因寻找病灶困难而达8次。
2.3 切口肿瘤直径比值 超声引导组最小1.2,最大1.6,平均1.22±0.22;对照组最小1.5,最大2.5,平均1.45±0.36。两组比较,差异有统计学意义(P<0.05)。2.4 手术用时 超声引导组最短为34min,最长为86 min,平均(55.72±12.66)min;对照组最短为38min,最长为145min,平均(83.07±31.23)min。两组比较,差异有统计学意义(P<0.05)。
2.4 并发症发生情况 术后3周内超声引导组发生癫痫发作1例,并发症发生率为5.00%(1/19);对照组发生癫痫发作2例,瘤腔出血1例(不需手术处理),并发症发生率15.79%(3/19)。两组比较,差异有统计学意义(P<0.05)。
2.5 术后随访 术后3个月MRI复查显示两组患者的CCA均完全切除。经1~2年随访,患者原有神经功能障碍改善,未出现新的神经功能障碍。
3 讨论
微侵袭神经外科手术要求术中对病灶精确定位,最大程度切除病灶,减少对正常脑组织的医源性损伤,从而获得最佳疗效[1]。以往仅仅依据术前CT和MRI所见判断脑深部CCA位置,由于开颅后缺乏参照物,偏差常常难以避免。术中CT和MRI检查需要昂贵的专用设备,占用额外的手术室空间和时间。神经导航系统在术中应用时也存在由于开颅、脑脊液流失、病变切除、脱水剂使用及重力等因素影响产生的脑组织移位的问题[2-3]。术中超声检测则不存在这些因素的影响,在手术中可多次重复,通过多切面扫描能明确显示局部结构的空间关系,而且可随时提供实时影像,有其独特的优势。CCA的病理生理特征就是反复的出血,所以往往表现为肿块内有不同时期的陈旧出血,常伴有钙化。这些成分在超声上都表现为明显有别于正常脑组织的高回声。常显示实质或囊性的边界清楚的团块(图1)。同时超声彩色血流图显示团块内无可见血流(图2),其分辨率甚至好于CT。神经外科手术中应用实时超声检测,有助于在切除病变时选择最佳入路,减少手术对重要血管和脑功能区的损伤,大大提高手术的精确性[4-6];而且在判断肿瘤切除范围、检测残存肿瘤方面也具有明显的优势[7-8]。此外,超声检测与术中MRI检查及导航系统等比较,无论是设备价格还是单次使用的费用都大为低廉,同时在大多数医疗单位无需添置新的超声检查仪。本文超声引导组与对照组比较,脑组织切开次数明显较少。反映了由于实时超声的定位优势,明显减少了在脑组织内探查的次数。超声引导组的切口肿瘤直径比值也小于对照组,其原因在于实时超声检测为手术者提供了更精确的肿瘤定位信息和周边组织的相对空间关系,使术者得以更精确地规划手术并操作。同时超声引导组的手术时间也明显短于对照组,由此也可明显减轻手术的创伤。两组患者术后并发症发生率也存在统计学差异,超声引导组优于对照组。而且笔者体会,直径大的CCA术中定位相对容易,直径小的CCA应用实时术中超声检测定位更能体现出明显的优势。本文超声引导组患者术中使用实时超声检测使病灶均获得良好定位,术前影像学检查未能提示肿瘤周围粗大血管的3例,术中超声检测显示了这些粗大血管并经手术证实;并在手术结束时发现1例存在脑深部小血肿,也及时作出了处理。

图1脑海绵状血管瘤回声信号高,与正常脑组织背景有明显区别。同时可以测量其大小
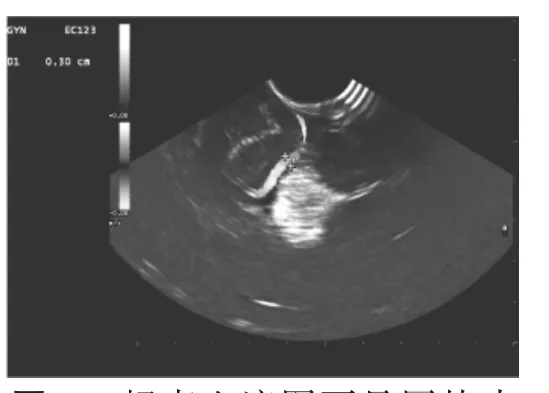
图2 超声血流图可见团块内无血流,团块周围见血管
通过脑皮质入路切除病变,可能造成该处脑组织缺失,脑组织结构和功能的完整性受到一定影响,甚至形成致癫痫病灶。如果功能区皮质损伤,会造成严重的神经功能障碍。CCA一般体积不大,很少因为占位因素导致颅内压增高,因此,手术时通过切除病变即可达到减压的目的,而一般不需切除部分脑组织。通过总结本文病例,笔者认为对于CCA均宜采用脑沟入路的手术方法。此入路可有效保护大脑皮质的重要功能,同时防止术后皮质癫痫灶形成[9]。经脑沟入路,通过松解蛛网膜,充分利用脑沟自然深度和长度,可以提供一条距离病变相对最近的自然通道。只需轻度牵拉脑组织,周围脑组织既可得到良好保护,又能达到术中暴露和切除病变的目的。但采用脑沟入路的前提是确保病灶定位准确。实时超声检测引导可使病变定位简单、准确,从而使选择脑沟入路的准确性得到保证。此外,分离脑沟的手术操作应建立在良好的显微神经外科技术基础上,要特别注意保护脑沟中的引流静脉(中央区附近脑沟中存在重要的引流静脉)。术中实时超声检测可以观察到这些血管,局部的分辨率高于MRI。
通过临床实践,笔者认为:超声引导下脑沟入路可明显提高CCA的手术全切除率,缩短手术时间,降低术后神经功能障碍等并发症的发生率。
[1] 陈忠平,魏大年.脑肿瘤微侵袭治疗理念的扩展[J].中国微侵袭神经外科杂志,2009,14(10):433-434.
[2] Jodicke A,Deinsberger W,Erbe H,et al.Intraoperative three-dimensional ultrasonography:an approach to register brain shift using multidimensional imageprocessing [J].Minim Invasive Neurosurg,1998,41(1):13-19.
[3] Lindner D,Trantakis C,Renner C,et al.Application of intraoperative 3D ultrasound during navigated tumor resection[J].Minim Invasive Neurosurg,2006,49(4):197-202.
[4] 孔文韬,张炜炜,邱君斓,等.术中超声在脑肿瘤切除术中的应用价值[J].实用医学杂志,2008,24(22):3902-3903.
[5] 何文,姜笑千,张懋植,等.超声技术在脑肿瘤术中的应用研究[J].中国超声医学杂志,2006,22(7):499-501.
[6] Shinoura N,Takahashi M,Yamada R.Delineation of brain tumor margins using intraoperative sononavigation:implications for tumor resection[J].J Clin Ultrasound,2006,34(4):177-183.
[7] Erdogan N,Tucer B,Mavili E,et al.Ultrasound guidancein intracranial tumor resection:correlation with postoperative magnetic resonance findings[J].Acta Radiol,2005,46(7):743-749.
[8] Wang J,Duan YY,Liu X,et al.Application of intraoperative ultrasonography for guiding microneurosurgical resection of small subcortical lesions[J].Korean J Radiol,2011,12(5):541-546.
[9] 张懋植,王磊,赵继宗,等.脑沟入路手术切除侧脑室三角区病变(附35例报告)[J].中国微侵袭神经外科杂志,2003,8(2):59-61.
Application of intraoperative real-time ultrasound in resection of cerebral cavernous hemangioma
LOU Lin,ZHANG Jian,ZHAO
Yuanyuan,et al.Department of Neurosurgery,Zhejiang Provincial People’s Hospital,Hangzhou 310014,China
【 Abstract】Objective To investigate the clinical value of intraoperative real-time ultrasound in resection of cerebral cavernous hemangioma. Methods Thirty nine patients with cerebral cavernous hemangioma were randomly assigned to receive ultrasound-guided resection(ultrasound group,n=20)or conventional resection(control group,n=19)of hemangioma.The operating time,number of brain tissue incision,ratio of diameter of incision to tumor,postoperative complications and improvement of symptom were analyzed three weeks after operation. Results The focuses were all successfully resected and there was no fatal case in both groups.The coincidence rate of MRI with pathology was 100%.The intraoperative ultrasound exactly indicated the position,size,modality and depth of cavernous hemangioma.All focuses were found via operating microscope.The operating time of ultrasonic group was significant shorter than that of control group.Numbers of brain tissue incision and ratio of diameter of incision to tumor in ultrasonic group were significant less than those in control group.The incidence of postoperative complications in ultrasonic group was significantly lower than that in control group. Conclusion The intraoperative real-time ultrasound can shorten operative time,minimize cerebral damage and reduce postoperative complications in resection of cerebral cavernous hemangioma.
Intraoperative ultrasound position Cavernous Hemangioma
2012-08-16)
(本文编辑:沈叔洪)
310014 杭州,浙江省人民医院神经外科

