肝损伤活性研究
徐士勋 王咪娜 林锦旋 程亚涛 王艳慧 绪扩 张宇忠 雷海民
目前酒精滥用已经成为世界性的危害,长期大量饮酒对肝脏有直接毒害作用,从而引发酒精性肝病(alcoholic liver disease,ALD)。在中国ALD发病率呈逐年上升趋势,已经严重威胁了人民健康[1],酒精性肝病已成为仅次于病毒性肝炎的第二大肝病[2]。
近年来中医中药防治酒精性肝病的临床和实验研究已有报道[3],鳖甲作为一味常用的保肝、护肝良药[4-6],本课题组从醋炙鳖甲中分离获得寡肽I-C-F-6,通过药理研究证实该物质对CCl4诱导的急性肝损伤具有防护作用,初步推断其机理可能与提升肝脏内抗氧化酶谷胱甘肽还原酶及谷胱甘肽过氧化物酶与超氧化物歧化酶(superoxide dismutase,SOD)活性有关[7-8]。临床和实验研究报道,鳖甲对酒精引起的肝病也具有一定临床应用[9-10],因此本实验探讨了其对小鼠急性酒精性肝损伤的作用。
本实验采用预先注射给药30天后以60%酒精灌胃3次诱导建立小鼠急性肝损伤模型,考察各实验组血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)酶含量及肝脏SOD活力、丙二醛(malondialdehyde,MDA)含量及肝组织病理学检查,观察并分析评价鳖甲寡肽化合物I-C-F-6防治酒精致小鼠急性肝损伤效果,深入研究了该化合物的肝保护作用,为寡肽I-C-F-6用于临床防治酒精性肝病提供一定的实验依据。
1 材料与方法
1.1 动物
健康雄性ICR小鼠18~20 g,北京中医药大学实验动物中心提供,实验动物生产许可证SCXK(京)2012-0001。
1.2 药物和试剂
鳖甲寡肽I-C-F-6(序列:GAGPHGG,纯度大于98%),实验室从醋炙鳖甲中分离纯化确证结构,委托上海科肽生物科技有限公司合成。乙醇,生理盐水,双蒸水。ALT试剂盒、AST试剂盒、SOD试剂盒、MDA试剂盒,均购自南京建成生物工程研究所,其它试剂均为国产分析纯,均购自北京化工厂。
1.3 仪器
万分之一分析天平(上海分析仪器厂);TDL-5-A CENTRZFUGE 高速离心机(飞鸽牌);DK-98-I 型恒温水浴锅;注射器(常州悦康医疗器械有限公司);RM2015 组织切片机( Leicainstruments Ltd. );Nikon ECLIPSE90i显微镜。
1.4 动物分组
雄性ICR小鼠48只,体重(18±2) g,随机分为5组:正常对照组8只,模型组10只,寡肽低剂量、寡肽高剂量组各10只,阳性药组10只,实验过程中无动物死亡。
1.5 给药与造模
动物适应饲养1周后,正常对照组和模型组均按0.12 ml·kg-1剂量皮下注射生理盐水,每天1次;寡肽低剂量组和寡肽高剂量组分别以0.32 mg·kg-1和0.64 mg·kg-1浓度,按0.12 ml·kg-1剂量皮下注射寡肽的生理盐水溶液;阳性药组以240.00 mg·kg-1浓度按0.12 ml·kg-1剂量灌胃还原型谷胱甘肽,连续30天。30天后,除正常对照组以0.12 ml·kg-1剂量灌胃生理盐水外,其余组均以0.12 ml·kg-1剂量灌胃60%乙醇3次(10小时/次)。
1.6 取材
第30天给药结束后,连续3次灌胃60%酒精后(10小时/次),最后一次禁食不禁水12小时,小鼠摘取眼球取血后,分离血清,-20 ℃保存待检;小鼠取血处死后,打开腹腔,观察肝脏色质形态等情况,从肝右叶切取1.0 cm×0.8 cm×0.3 cm大小肝组织一块做苏木精—伊红染色,取肝左叶1.0 g,制备10%的肝匀浆待检。
1.7 观测指标
小鼠行为学状态:小鼠饮食量、毛发光泽、体重、粪便状态、醉酒状态。
小鼠肝体指数:称量小鼠体重及肝重,记录后以肝脏质量除以体重,得到小鼠的肝体指数。
血清ALT、AST测定:按试剂盒说明书步骤操作检测血清ALT,AST活性。
肝组织MDA、SOD的测定:按试剂盒说明书步骤操作检测肝脏MDA, SOD水平。
1.8 统计学处理
2 结果
2.1 小鼠体重及外观行为变化
模型组小鼠毛质粗糙,厌食,精神萎靡,动作迟缓,体重明显减轻,解剖肝脏花斑样改变,苍白、质硬,有的有腹腔积液;给药组有所改善。实验过程中,模型组小鼠无死亡现象。
2.2 小鼠血清ALT、AST比较
与正常对照组相比,模型组血清ALT、AST的活性含量明显升高(P<0.05);与模型组相比,寡肽组和阳性药组血清ALT、AST含量明显降低(P<0.05);与寡肽组相比,阳性药组血清ALT、AST的含量无明显差异(P>0.05)。见表1。

表1 寡肽I-C-F-6对酒精所致急性肝损
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与模型组相比,cP<0.05。
2.3 小鼠肝脏肝体指数、SOD、MDA比较
与正常对照组相比,模型组肝匀浆SOD活力显著降低、MDA含量明显升高(P<0.05);与模型组
相比,寡肽组和阳性药组肝匀浆SOD活力显著升高、MDA含量明显降低(P<0.05);与寡肽组相比,阳性药组肝匀浆SOD活力显著升高、MDA含量明显降低(P<0.05);见表2。
2.4 小鼠肝组织病理学检查
HE染色后,电镜下观察,正常对照组对照肝细胞核深染,胞浆较大,胞质均匀(A)。模型组肝细胞中央静脉周围存在碎片状肝细胞坏死,部分肝细胞核溶解消失,有充血现象(B)。寡肽低剂量组肝细胞水肿范围较大,出现肝细胞空泡(C)。寡肽高剂量组肝细胞水肿较轻(D)。阳性药组肝部分肝细胞侵润,肝细胞正常范围多(E)。见图1。

A

B

C
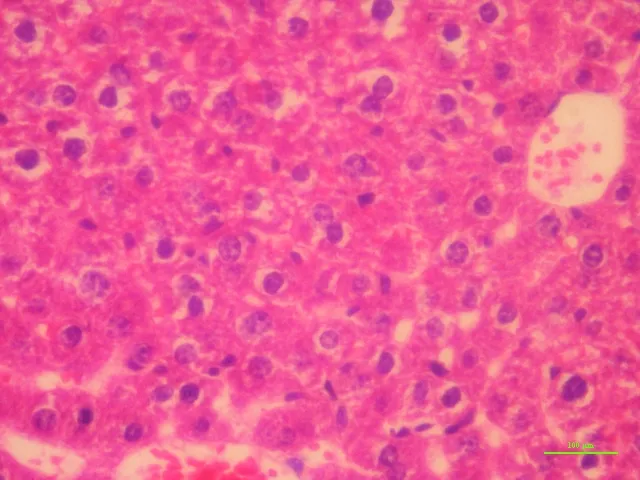
D

EA 正常对照组;B 模型组;C 寡肽低剂量组(0.32 mg·kg-1);D 寡肽高剂量组(0.64 mg·kg-1);E 阳性药组(240 mg·kg-1)图1 小鼠肝组织病理学检查(HE染色 ×400)

组别n给药浓度(mg·kg-1)SOD(U·ml-1)MDA(nmol·ml-1)肝体指数正常对照组8-60.44±5.441.82±0.290.050±0.0033模型组10-45.37±8.55a4.54±1.48a0.059±0.0034寡肽低剂量组100.3257.59±2.58b2.05±0.35b0.052±0.0038寡肽高剂量组100.6454.94±3.55b1.91±0.58b0.050±0.0037阳性药组10240.00 58.01±14.95c 2.01±0.22c0.049±0.0029
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与模型组相比,cP<0.05。
3 讨论
酒精吸收入血后,90%以上主要在肝脏代谢,其肝损伤机制主要有乙醇的直接毒性、乙醇氧化成乙醛导致的化学性损伤、氧应激和脂质过氧化等,可损害肝脏各种细胞器和酶的结构功能[11]。
ALT和AST是用于诊断肝实质损害的主要酶类,是肝损伤的主要指标,当肝细胞被破坏、细胞膜通透性增高及线粒体损伤时,ALT和AST被释放到血液中,使之明显升高[12];自由基引起的氧化损伤被认为是酒精性肝损伤的重要病理机制[13],它可以激活氧分子产生氧自由基导致肝细胞膜的脂质过氧化[14-15],其中SOD对机体的氧化与抗氧化平衡起着重要的作用,它能清除超氧阴离子自由基,保护细胞免受损伤[16];MDA是脂质过氧化反应的终产物,它既能反映机体内氧化反应,也能作为机体损伤的损害因子[17]。
还原型谷胱甘肽(glutathione,GSH)是由谷氨酸、半胱氨酸及甘氨酸组成的一种三肽,能参与体内氧化还原过程,和过氧化物及自由基本结合对抗氧化剂对巯基的破坏,保护细胞膜中含巯基的蛋白质和含巯基酶不被破坏,同时还可对抗自由基对重要脏器的损害,临床上常应用于肝脏疾病[18]。
由实验结果可以发现模型组的肝体指数最大,可能是酒精对肝组织造成了影响,使肝脏肿胀、膨大,造成了一定的肝损伤;由血清指标及肝脏指标的统计比较可见,模型组小鼠血清指标ALT、AST及肝脏MDA较正常对照组有显著升高,肝脏SOD活力明显降低;而给予寡肽药物的两个剂量组肝功能指标均有不同程度的改善,其中寡肽高剂量组在对ALT、AST、MDA的抑制作用方面和SOD活力升高方面尤其明显,阳性药组则优于寡肽组。肝组织HE染色后的形态学观察亦说明,寡肽I-C-F-6可改善酒精导致的急性肝损伤;由此说明鳖甲寡肽I-C-F-6对酒精诱导的小鼠急性肝损伤有较好的预防保护作用。
由鳖甲寡肽I-C-F-6可以升高肝脏SOD酶活力和降低MDA含量可以说明其酒精性肝损伤保护机制可能是通过抗自由基及脂质过氧化而实现,但仍需进一步实验证实。
本实验所用药物鳖甲寡肽I-C-F-6是一种由7个L-氨基酸组成的具有全新结构的小肽化合物,其分子量小于1000,与蛋白质相比,小分子肽的抗原性小,不易引起过敏反应,而且还具有很好的溶解性,在体内吸收快、利用率高,因此更有利于发挥药效。以上研究表明,鳖甲寡肽化合物I-C-F-6在防治酒精诱导形成的小鼠急性肝损伤方面有着较为显著作用,具有保护肝细胞作用,为后续先导化合物的开发和研究奠定基础,为后期临床研究提供一定的参考依据。
[1] 庄辉.酒精性肝病的流行病学[J].中华肝脏病杂志,2003,11(11):689.
[2] 李学锋,周明欢,向平,等.胰岛素抵抗与酒精性肝病血清瘦素水平的关系[J].实用医学杂志,2008,24(4):592-593.
[3] 路瑞华,鲁庆峰.中医药防治酒精性肝损伤的研究进展[J].黑龙江医药,2004,1(17):38.
[4] 姜宏伟.单味鳖甲治疗肝炎肝硬化30例[J].临床医学,2007,27(6):93-94.
[5] 曹铁栓.通络化纤汤治疗肝纤维化66例[J].陕西中医,2006,26(9):1071-1073.
[6] 邝卫红.鳖甲煎汤治疗慢性乙型肝炎27例疗效观察[J].山东中医杂志,2005,24(11):655-657.
[7] 雷海民.抗乙肝病毒寡肽及其衍生物[P].申请号:201010187949.9,实质审查的生效.
[8] 张宇忠.鳖甲寡肽化合物I-C-f-6对四氯化碳诱导小鼠急性肝损伤的保护作用[J].中国病理生理杂志,2010,26(10):2074.
[9] 郝彦开,杨玉巧,贾军峰,等.化肝汤1号对中老年酒精性肝纤维化患者TGF-β1的影响[J].中国老年学杂志,2011,31(20):3916-3917.
[10] 黄文豹.复方鳖甲软肝片治疗酒精性肝硬化疗效观察[J].浙江中西医结合杂志,2007,17(2):93-94.
[11] 厉有名.酒精性肝病的发病机制[J].中华肝脏病杂志,2003,11(11):690-691.
[12] Kew MC.Serum aminotransferase concentration as evidence of hepatocellular damage [J].Lancet 2000,355(9204):591-592.
[13] Kaplowitz N.Mechanisms of liver cell injury[J].J Hepatol,2000,32(1 Suppl):39-47.
[14] MullerA,Sies H.Inhibition of ethanol-and aldehyde-induced release of ethane from isolated perfused rat liver by Pargyline and disulfiram[J].Pharmacol Biochem Behav,1983,18(6):429.
[15] Strubelt O,Younes M,Pentz R.Enhancement by glutathione Depletion of ethanol-induced acute hepatotoxicity in vitro and in vivo[J].Toxicology,1987,45(2):213.
[16] 方允中,李文杰.自由基与酶(基础理论及其在生物学和医学中的应用)[M].北京:科学出版社,1999:200-205.
[17] Masalkar PD,Abhang SA.Oxidative stress and antioxidant status in patients with alcoholic liver disease[J].Clin ChimActa,2005,355(1-2):61-65.
[18] 袁平戈,张大志.还原型谷胱甘肽的作用机制及临床应用[J].药品评价,2006,3(5):385-390.

