丹参多酚酸盐对大鼠骨髓间充质干细胞增殖及血管内皮生长因子表达的影响
王晓娟
丹参多酚酸盐(salvianolate)为丹参的水提物,其主要成分为丹参乙酸镁(magnesium lithospermate B)。文献报道[1-2]丹参多酚酸盐对缺血性疾病有明显的疗效,对人血管内皮细胞有促迁移及增殖的作用。骨折的愈合一直是学者们长期研究的难题[3]。骨折愈合过程中,骨折端新生血管的长入是其重要的步骤之一[4-5],干细胞的归巢是骨折修复的重要来源[6-7]。如果提高干细胞的促新生血管形成能力,将大大提高骨折的愈合能力。本研究采用细胞共培养的方法,观察丹参多酚酸盐对骨髓间充质干细胞的增殖及与血管形成密切相关的血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达情况,初步探讨中药对促骨折愈合的作用机制。
1 材料与方法
1.1 材料与试剂
SD 大鼠骨髓间充质干细胞(赛业生物科技有限公司,广州,中国);DMEM 培养基(赛业生物科技有限公司,广州,中国);胎牛血清(FBS)(杭州四季青生物公司);丹参多酚酸盐(上海绿谷生医药有限公司,国药准字Z20050246);VEGF 及GAPDH 引物均购自上海生物工程有限公司;TRIzol(Invitogen 公司,加利福尼亚,美国),ReverTra Ace qPCR RT Master Mix(TOYOBO Life Science,东京,日本);SYBRⓇGreen Real time PCR master Mix-Plus(TOYOBO Life Science,东京,日本)。
1.2 仪器与设备
二氧化碳培养箱(型号DH-801 上海三腾仪器有限公司,上海,中国);酶联免疫检测仪(型号RJ17DG5033A 中西集团,辽宁沈阳,中国);紫外分光光度计(Beckman DU530 Germany);StepOneTMReal-Time PCR System(Applied Biosystems Company,Carlsbad,USA)。
1.3 分组
实验组为丹参多酚酸盐与大鼠骨髓间充质干细胞(bone mesenchymal stem cell,BMSC)共培养;对照组为大鼠骨髓间充质干细胞单独培养。
1.4 观察指标与实验步骤
1.4.1 镜下观察细胞生长情况 实验组为丹参多酚酸盐(0.5 mg/ml)与大鼠骨髓间充质干细胞(P2代)5×104在六孔板中共培养,将大鼠骨髓间充质干细胞5×104在六孔板中培养做为对照组。用含10%FBS 的DMEM 培养基在37℃饱和湿度及5%二氧化碳孵育箱中分别进行共培养和单独培养48 小时后观察细胞生长情况。
1.4.2 MTT 检测 用含10%胎小牛血清得培养液配成单个细胞悬液,以每孔5 000 个细胞接种到96孔板,每孔体积200 μl。培养细胞同一般培养条件,分别于第1、3、5、7 天,每组分别取5 个孔,每孔加MTT 溶液(5 mg/ml 用PBS 配)20 μl。继续孵育4小时,终止培养,小心吸弃孔内培养上清液,对于悬浮细胞需要离心后再吸弃孔内培养上清液。每孔加150 μl DMSO,振荡10 分钟,使结晶物充分融解。选择490 nm 波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.4.3 细胞VEGF mRNA 检测 将培养7 天后的细胞用胰酶消化后收集。于匀浆器中加入1 ml Trizol,充分研磨后静置15 分钟,经氯仿萃取、异丙醇沉淀、乙醇洗涤后加入30 μl DEPC 水溶解提取总RNA,用分光光度仪检测RNA 纯度及浓度。反转录及扩增均选用东洋纺试剂盒,按其说明书步骤进行。反应条件为95℃预变性60 秒,三步法:95℃15秒,58℃15 秒,72℃45 秒40 个循环。VEGF 引物:上游引物5’-GCGGGCTGCCTCGCAGTC-3’,下游引物5’-TCACCGCCTTGGCTTGTCAC-3’,GAPDH 上游引物5’-GTGCCAAAAGGGTCATCATCTC-3’,下游引物5’-GGTTCACACCCATCACAAACATG-3’,以GAPDH为内参照,根据荧光定量PCR 仪显示的CT 值结果,以对照组做参照通过2-ΔΔCt方法计算RQ 值分析两组相对基因表达差异。

图1 显微镜下观察两组细胞生长情况(×100)
1.5 统计学分析
2 结果
2.1 两组细胞显微镜下观察结果
两组细胞在相同培养条件下培养48 小时后,在倒置显微镜下观察,两组培养细胞均未发现污染及支原体感染迹象,100 倍显微视野下见实验组细胞密集程度明显高于对照组,见图1。
2.2 MTT 测定结果
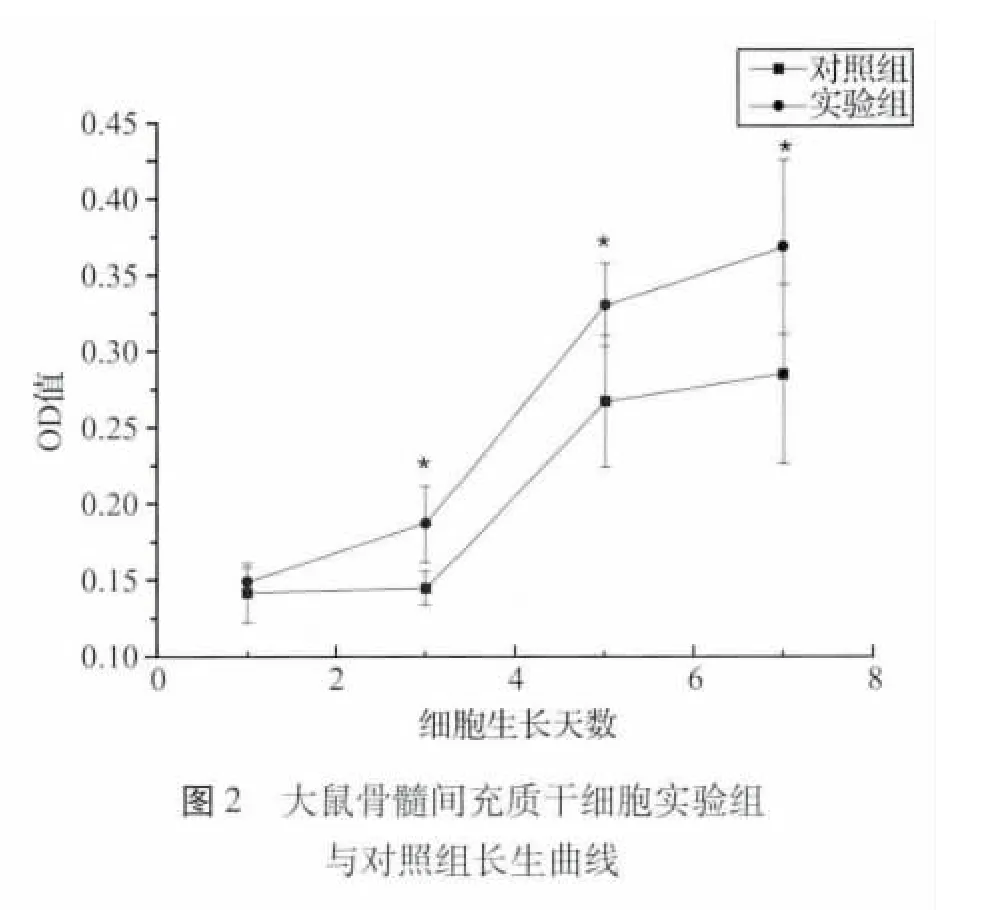
两组细胞在体外培养对数生长期第1、3、5、7 天均呈明显上升趋势,细胞生长第一天两组无统计学差异,实验组于第三天后均高于对照组。P <0.05,有统计学差异。说明丹参多酚酸盐对BMSC 有促增殖作用,见图2。
2.3 qRT-PCR 测定结果
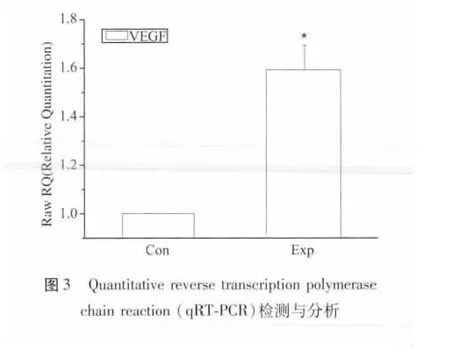
提取RNA,稀释100 位后用分光光度仪检测A260 及A280 的OD 值,求得A260/A280 比值在1.8 ~2.0 之间,说明RNA 纯度较高。据A260 的OD 值计算得RNA 浓度,经反转录及扩增后行荧光定量,获得CT 值,计算RQ 值,结果见图3。丹参多酚酸盐与BMSC 共培养组(Exp)的VEGF mRNA 表达量明显高于BMSC 单独培养组(Con)。
3 讨论
丹参为唇形科鼠尾草属植物干燥的根及根茎,有“一味丹参,功同四物”之美誉。作为经典的传统中药材,最早见于《神农本草经》,具有活血祛瘀、通经止痛、凉血消痈和养血安神的功效[8]。临床上多用于治疗缺血性疾病,研究证实其治疗机制与促血管生成相关[9]。丹参多酚酸盐为丹参的水溶性提取物,具有有效成分明确、质量易控以及疗效稳定等优点。较中医药的复方合剂有效成份更纯更有效,并减少了期副作用[10]。中医认为,骨折的愈合过程是一个“瘀去、新生、骨合”的过程。根据骨折的证候特点,可分为消淤退肿期、活血生新期及固本培元期。而在骨折发生后1 ~2 周内,由于肢体内部筋骨脉络均受损伤,离经之血淤积不散、气血之道不得畅通,故疼痛剧烈,患部淤血肿胀,治宜活血化淤,消肿止痛。
作为一种复合材料,骨组织生长的形成是一个复杂的过程,包括分子、细胞、生化代谢的变化[11]。骨折的直接反应是血肿的形成和炎症反应,血肿形成,阻止更多的流血和损耗因子。炎症反应提供两骨端初始稳定,启动多个愈合过程中的信号转导通路。前体细胞侵入骨折端之间并形成新的血管,成纤维细胞,和其他支持细胞肉芽组织形成。MSCs迁移至骨折端后分化为前体细胞,释放的细胞因子具特异性抗炎作用并促新生血管生成[12]。骨髓间充质干细胞的招募及迁移至骨折部位可有效促进骨折的修复已达成共识[13]。如果能促进骨髓间充质干细胞的增殖及提高其血管生成的能力必将提高骨折的修复能力。VEGF 作为目前研究较清楚,作用最明确的促血管生长因子,其作用是血管内皮细胞特异的有丝分裂原,合成后以旁分泌形成发挥生物效应[2]。目前所报道的与血管生成有关的因子许多均与VEGF 的表达相关。提高VEGF 的表达则说明进一步促新生血管形成。本实验对基因表达的研究采用实时荧光定量PCR 技术的定量分析,其定量分析的准确度和灵敏度均远高于以前的方法。本实验证实丹参多酚酸盐促进了骨髓间充质干细胞的增殖,并可上调其表达VEGF mRNA 水平,进而促进血管生成。丹参多酚酸盐在促血管生成的同时还对脑、肝、肾、肺等组织有保护作用,符合中医对骨折的全身施治的辨证治疗原则,具有良好的发展前景。关于其对骨折早期促进愈合作用的体内实验还有待于进一步研究。
[1] 汪志忠,黎红华,吴非,等.丹参多酚对急性脑梗死患者血清单核细胞趋化蛋白-1 及白细胞介素-10 的影响[J].神经损伤与功能重建,2013,8(1):71-72.
[2] 徐杰,范维琥.丹参多酚酸盐对人血管内皮细胞迁移的影响[J].中西医结合学报,2013,1(3):211-214.
[3] Li,H.,L.H. Le,M.D. Sacchi,et al.Ultrasound imaging of long bone fractures and healing with the split-step fourier imaging method[J].Ultrasound in Medicine and Biology,2013,39(8):1482-1490.
[4] Cheung,W.H.,M.H. Sun,Y.P. Zheng,et al. Stimulated angiogenesis for fracture healing augmented by low-magnitude,high-frequency vibration in a rat model-evaluation of pulsed-wave doppler,3-D power Doppler ultrasonography and micro-CT microangiography[J].Ultrasound in Medicine and Biology,2012,38(12):2120-2129.
[5] Geris,L.,A. Gerisch,J.V. Sloten,et al. Angiogenesis in bone fracture healing:a bioregulatory model[J].Journal of Theoretical Biology,2008,251(1):137-158.
[6] Toupadakis,C.A.,J.L.Granick,M.Sagy,et al.Mobilization of endogenous stem cell populations enhances fracture healing in a murine femoral fracture model[J].Cytotherapy,2013,15(9):1136-1147.
[7] Weaver,A.S.,Y.P.Su,D.L.Begun,et al.The effects of axial displacement on fracture callus morphology and MSC homing depend on the timing of application[J].Bone,2010,47(1):41-48.
[8] 张晓雷,陈俊华,郭春霞,等. 丹参多酚酸盐的药理作用研究[J].世界临床药物,2013,34(5):292-297.
[9] 池晓霞,高心宇.丹参调节血管新生及其机制研究进展[J].海峡药学,2010,22(2):3-6.
[10] 宋芳娇,曾克武,王学美.中药复方有效成分组相关研究方法的研究进展[J].环球中医药,2012,5(12):951-955.
[11] Obermeyer,T.,D. Yonick,K. Lauing,et al. Mesenchymal Stem Cells Facilitate Fracture Repair in an Alcohol-Induced Impaired Healing Model[J].Journal of Orthopaedic Trauma,2012,26(12):712-718
[12] Rubin,C.,A.S.Turner,S.Bain,et al.Anabolism. Low mechanical signals strengthen long bones[J]. Nature,2001,412(6847):603-604.
[13] Granero-Molto,F.,J.A.Weis,M.I.Miga,et al.Regenerative effects of transplanted mesenchymal stem cells in fracture healing[J].Stem Cells,2009,27(8):1887-1898.

