外源siRNA诱导家蚕先天免疫应答
何渐鸣 王明慧 毛钰霞 沈卫德,3 许雅香,3*
(1苏州大学基础医学与生物科学学院,江苏 苏州 215123;2现代丝绸国家工程实验室;3苏州大学蚕桑研究所)
RNAi是由双链RNA引发的序列特异性基因沉默现象[1],可高效、特异地沉默特定基因。这是个应对病毒感染或dsRNA结构分子进化保守的防御应答机制,除RNAi外,病毒或dsRNA也能触发别的免疫应答途径[2]。
昆虫有一个高效的先天免疫系统来区别异己成分和消除外源入侵物。先天性免疫应答系统产生的抗菌肽可以对微生物感染作出迅速有效的免疫应答[3,4]。LPS 是众所周知的病原体相关分子模式(PAMP),能引起昆虫的先天免疫应答,而siRNA作为外源物质,是否也被当做异物识别,发生免疫应答反应,至今鲜见报道。
在这个研究里,我们报道了家蚕在 LPS和siRNA诱导后黑化作用相关基因的转录水平,相关基因表达量的相似说明siRNA在家蚕先天免疫应答中也能充当PAMP。
2 材料和方法
2.1 材料
家蚕品种为本研究室保存的大造,正常桑叶育。LPS购自Sigma公司,Trizol RNA提取及M-MLV反转录试剂及其它化学常规试剂均购自宝生物工程(大连)有限公司,引物由上海生工生物工程技术服务有限公司合成。
2.2 方法
2.2.1 家蚕幼虫注射有效siRNA及LPS
取5龄第4天幼虫,实验组每头家蚕幼虫注射10μL LPS(150mmol/L NaCl溶解,终浓度1mg/mL),对照组每头幼虫注射10μL 150mmol/L NaCl。分别在注射后9h取实验组和对照组幼虫的血淋巴。每组至少取10头家蚕幼虫。
将适量的siRNA溶于不含有RNA酶的无菌水中,轻轻混匀,siRNA为10μg/μL。取5龄第4天幼虫,实验组每头家蚕幼虫注射10μL siRNA,对照组每头幼虫注射10μL无菌水,分别在注射后24h后取实验组和对照组的血淋巴,每组至少取10头家蚕幼虫。
2.2.2 样品制备
取5龄第4天幼虫,在冰上剪腹足取血淋巴,-80℃冷冻保存。
2.2.3 RNA提取和反转录PCR(RT-PCR)
用Trizol(TaKaRa公司)试剂盒说明书分别提取组织总RNA,用M-MLV反转录试剂盒(TaKaRa公司)反转录为为cDNA。
2.2.4 PO活性分析
LPS 注射后 3h、6h、9h、12h、18h、24h、48h 取家蚕的血淋巴,PO活性检测用L-多巴作为底物,固定波长490nm。取96孔U形板,在每个微孔内加入28℃下预温育的300μL 0.1mol/L PH=6的磷酸盐缓冲液,10μL 0.01mol/L 的 L-多巴及10μL 血清,酶标仪震荡4次,立即测反应体系的吸光值,每隔2min读一次吸光值,共10次。
2.2.5 基因表达分析
采用Primer 5.0软件,引物如表1所示。采用SYBR PrimeScriptTM RT-PCR试剂盒测定具体步骤按照说明书进行,反应程序为:95℃预变性1 min,95℃变性15s,60℃退火30s,循环45 次。

表1 实时荧光定量PCR反应体系
反应过程由ABI7300荧光定量PCR仪(Applied Biosystems公司)软件自动设定,每个样品重复3次。

表2 实时荧光定量PCR的检测基因和内参照基因的引物
3 结果
3.1 血淋巴PO活性分析
在用LPS处理后检测家蚕幼虫血淋巴的PO活性,结果显示LPS处理后PO活性是先升高再降低,PO活性在LPS处理后的3h、6h、9h后上升,9h时活性最高,PO活性在12h时开始降低,在18h时PO活性降到初始水平,见图1。
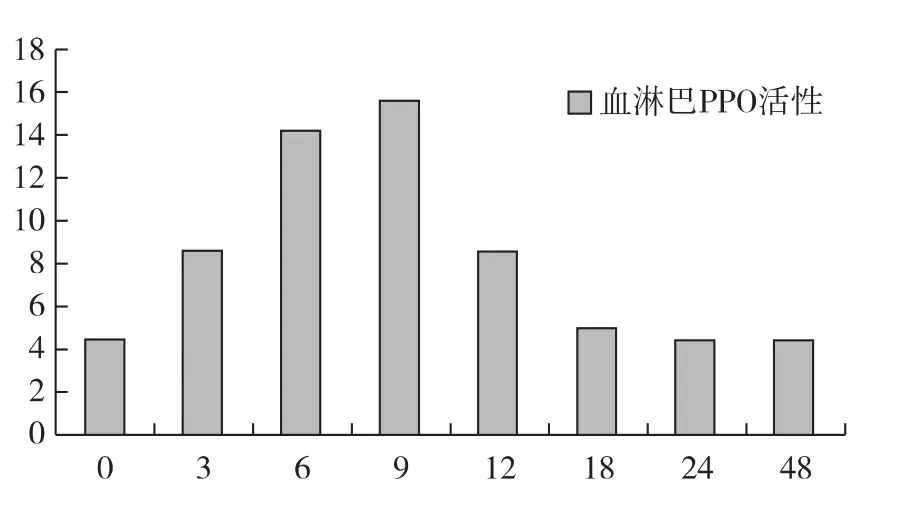
图1 LPS诱导不同时间后PPO活性变化
3.2 基因表达
LPS诱导和siRNA片段干扰后各基因的表达如图2、3所示。
在用 LPS 诱导后 9h,Bmβ-1,3-GRPB2,Bm-PAEE,Bmserpin-3的表达量是上升的,而BmβGRP1,BmPPO2,BmDDC的表达量则下降,见图2。
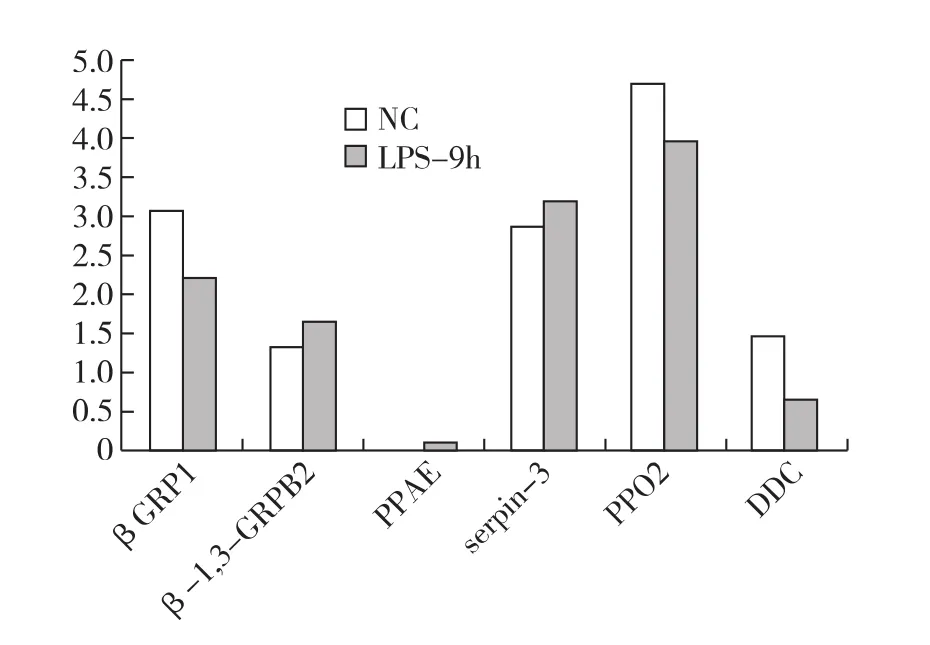
图2 LPS诱导9h后各基因的mRNA相对表达量
在用siRNA片段干扰后24h,BmPPAE,Bmserpin-3 的表达量呈上升,而 BmβGRP1,Bmβ-1,3-GRPB2的表达量则下降,BmPPO2,BmDDC的表达量略下降,见图3。
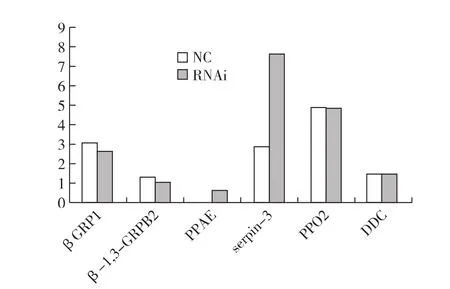
图3 RNA干扰24h后各基因的mRNA相对表达量
4 讨论
在哺乳动物里,dsRNA被认为是以病毒的分子模式引起先天免疫[5,6]。人类 TLR3作为激活 NF-kB途径的dsRNA的PRR,生产Ⅰ型干扰素(IFN-a/b)[7,8]。在昆虫方面,dsRNA 作为一个蛋白触发先天免疫反应鲜为人知,而siRNA与dsRNA相似,猜想是否siRNA也能触发昆虫的先天免疫。
siRNA广泛用于RNAi导致基因沉默。在鳞翅目昆虫中,RNAi效率在不同物种、组织、时期和靶基因显示相当多的变化[9]。我们的研究表明siRNA可以影响免疫相关基因的表达,或许可以解释鳞翅目昆虫RNAi的可变性之多。
LPS是众所周知的病原体相关分子模式(PAMP),能引起昆虫的先天免疫应答,在用LPS诱导后,与模式识别受体(PRRS)相结合,进而激活免疫系统,如多酚氧化酶级联(PPO)反应,我们先检测LPS诱导后PPO的活性,发现其活性升高,推测可能参与黑化作用。
我们推测siRNA引起的免疫反应与LPS类似,因而检测参与黑化作用的3类分子[10],即识别分子,信号分子和效应分子相关基因表达量的变化。结果显示,作为识别分子的 BmβGRP1,Bmβ-1,3-GRPB2,siRNA片段诱导后都下降,而LPS诱导后Bmβ-1,3-GRPB2上升,BmβGRP1 略下降,结果的不同可能是因为两者都是针对于革兰氏阴性菌的识别因子,而siRNA片段不属于此类,作为信号(调节)分子的 BmPPAE,Bmserpin-3,siRNA片段和 LPS诱导后都上升,作为效应分子 BmPPO2,BmDDC,siRNA片段和LPS诱导后都下降,但LPS诱导后下降幅度大。由此可知,两种方式诱导后,各基因的表达模式基本相似,说明siRNA在家蚕先天免疫应答中也能充当PAMP。
[1]Yang M,Mattes J.Discovery biology and therapeutic potential of RNA interference,microRNA and antagomirs[J]PharmacolTher,2008,117(1):94 -104.
[2]Merkling S.H,van Rij R.P.Beyond RNAi:antiviral defense strategies in Drosophila and mosquito.[J]Journal of Insect Physiology,2012,59,159 -170.
[3]许平震.家蚕先天免疫的模式识别信号传导和抗微生物肽基因表达调控机制研究[D],2010重庆:西南大学.
[4]HOFFMANN J A.The immune response of Drosophila[J]Nature,2003,26(6962):33 -38.
[5]DeWitteOrr S.J,Mossman KL.DsRNA and the innate antiviral immune response[J]Future Virology,2010,5,325-341.
[6]Berke.IC,Li Y,Modis Y.Structural basis of innate immune recognition of viral RNA[J].Cellular Microbiology,2012,15,386 -394.
[7]Alexopoulou L,Holt AC.Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3.[J]Nature 2001,413,732-738.
[8]Doyle SE,Vaidya SA.Toll-like receptor 3 mediates a more potent antiviral response than Toll-like receptor 4[J].Journal of Immunology 2003,170,3565-3571.
[9]Terenius O,Papanicolaou A.RNA interference in Lepidoptera:an overview of successful and unsuccessful studies and implications for experimental design[J]Journal of Insect Physiology 2011,57,231 -245.
[10]杨松.昆虫黑化反应的分子机制研究进展[J]2003,30(4):164-168.

