44例蜜蜂蜂毒过敏的临床特点
关 凯,孔 瑞,尹 佳
(中国医学科学院 北京协和医学院 北京协和医院变态反应科,北京 100730)
膜翅目昆虫蛰刺过敏是导致严重过敏反应的常见原因之一。引起蛰刺过敏的膜翅目昆虫主要来自蜜蜂总科、胡蜂总科和蚁科。蛰刺过敏反应包括局部反应(local reactions)、大局部反应(large local reactions)及全身性严重过敏反应(systemic anaphylactic reactions)。
欧美普通人群中,发生过蜜蜂或胡蜂蜂毒过敏所致大局部反应者约占20%,发生过全身性严重过敏反应者占1%~5%[1];在养蜂人中更有高达14%~43%发生过全身性严重过敏反应[2-3]。在欧洲,每年有超过100人死于蜂毒过敏导致的全身性严重过敏反应[4]。
本研究对近10年蜜蜂蜂毒过敏的病例进行了归纳总结,以期更好地认识我国人群蜜蜂蜂毒过敏的特征,为其诊断和治疗提供有益信息。
对象和方法
诊断标准及研究对象
蜜蜂蜂毒过敏诊断标准:(1)具备蜜蜂蛰刺过敏反应的相关临床病史;(2)蜜蜂蜂毒血清特异性IgE(specific immunoglobulin E,sIgE)阳性或蜜蜂蜂毒皮肤试验阳性[5]。由于国内尚无蜜蜂蜂毒相关体内诊断试剂,本研究采用血清sIgE检测的方法评估蜜蜂蜂毒致敏状况。
研究组:2002年6月至2012年2月,因蜜蜂蜂毒过敏在北京协和医院变态反应科就诊,且符合上述诊断标准者。根据蜜蜂蜇刺后的过敏反应类型将患者分为局部反应组、大局部反应组和全身反应组3组。
对照组:同时期因过敏性疾病在北京协和医院变态反应科就诊,其蜜蜂蜂毒血清sIgE检测阳性,但无蜜蜂蛰刺过敏反应的相关临床病史。
血清sIgE检测及阳性标准评定
采用Phadia Uni-CAP系统的放射变应原吸附试验荧光酶联免疫法(RAST FEIA)检测血清sIgE,由北京协和医院变态反应科实验室完成。
蜜蜂蜂毒过敏反应分类
蜜蜂蜂毒过敏反应分为局部反应、大局部反应及全身性严重过敏反应3个类别。局部反应:风团和红晕等。大局部反应指蜂蜇局部肿胀直径超过10 cm,且持续时间大于1 d[1]。全身性严重过敏反应指蜂蜇部位以外的组织和(或)器官出现症状,反应严重程度根据Ring和Messmer标准分为4级(表1)[1,6]。
观察方法
采集研究对象一般信息,记录是否合并其他特应性疾病,如过敏性鼻炎、过敏性哮喘、特应性皮炎、食物过敏及药物过敏。记录血清总IgE(total immunoglobulin E,T-IgE)和sIgE结果。详细了解蜂毒过敏反应,包括局部反应大小、持续时长、是否累及其他系统,如累及其他系统则详细记录各系统表现、处置及转归。分析研究对象的不同过敏反应类型与生活地域、职业、蜜蜂蜂毒暴露类型及IgE比活性(IgE specific activity,sIgET-IgE)各因素之间的关系。蜂毒暴露类型包括自然性暴露(如郊游)、职业性暴露(如养蜂工人)及医源性暴露(如接受中医蜂疗)。
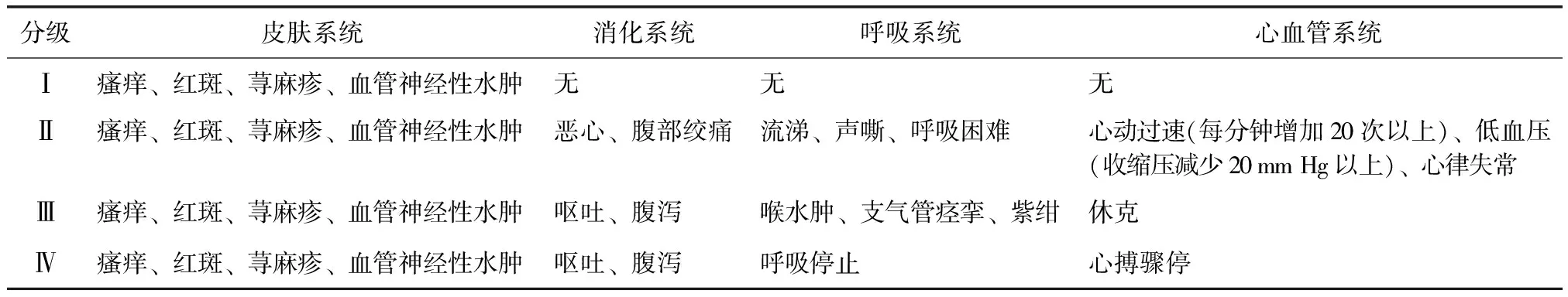
表1 全身性严重过敏反应程度分级(Ring和Messmer标准)Table 1 Severity grading of systemic anaphylactic reactions (Ring and Messmer)
统计学方法
分类资料和等级资料使用例数和百分比描述,定量资料使用中位数(Q1,Q3)描述,分类资料使用Fisher精确检验,多组等级资料比较使用秩和检验,各组间两两比较使用Bonferroni法,P<0.05为差异有统计学意义;当比较次数为N时,以P<(0.05N)为差异有统计学意义。
结 果
一般情况
共收集研究组患者44例,男女之比为31∶13,平均年龄37(29,48)岁。其中,61%(2744)合并过敏性鼻炎,45%(2044)合并过敏性哮喘,16%(744)合并食物过敏,5%(244)合并药物过敏,2%(144)合并特应性皮炎。根据蜜蜂蜇刺后的过敏反应类型将患者分为3组:局部反应组(3044)、大局部反应组(644)和全身反应组(844)。全身反应组按程度分为II级(18)及III级(78)。研究组48%(2144)生活在市区,52%(2344)生活在郊区。全身反应组中有1例患者在首次蜜蜂蜇刺时出现大局部反应,3个月后再次蜜蜂蜇刺出现II级全身性严重过敏反应。
共收集对照组患者25例,男女之比为14∶11,平均年龄20(10,40)岁。36%(925)患有过敏性鼻炎,48%(1225)患有过敏性哮喘,24%(625)患有食物过敏,4%(125)患有药物过敏,12%(325)患有特应性皮炎。
蜜蜂蜂毒暴露类型
将局部反应组、大局部反应组和全身反应组依据蜂毒暴露类型进行分类(表2),3组之间暴露构成百分比差别有统计学意义(P=0.0085)。局部反应组和全身反应组暴露构成比的差别有统计学意义(P=0.004 9),但局部反应组和大局部反应组(P=0.534 8)、大局部反应组和全身反应组(P=0.095 6)的暴露构成比差别无统计学意义。

表2 蜜蜂蜂毒过敏的暴露构成Table 2 exposure types of honeybee venom allergy [n(%)]

表3 蜜蜂蜂毒(i1)血清sIgE检测结果Table 3 honeybee venom(i1)sIgE results (n)
sIgE:特异性IgE;1级:0.35 kUAL≤血清sIgE<0.7 kUAL;2级:0.7 kUAL≤血清sIgE<3.5 kUAL;3级:3.5 kUAL≤血清sIgE<17.5 kUAL;4级:17.5 kUAL≤血清sIgE<50 kUAL;5级:50 kUAL≤血清sIgE<100 kUAL;6级:血清sIgE≥100 kUAL
血清sIgE检测结果
局部反应组、大局部反应组、全身反应组及对照组组间血清sIgE比较,差别无统计学意义(χ2=2.686,P=0.443)(表3)。其中,对照组血清sIgE最小值为0.71 kUAL,最大值为15.2 kUAL。

图1不同研究组和对照组sIgET-IgE比较
Fig1Comparison of sIgET-IgE among different allergy and control groups
sIgET-IgE:IgE比活性
讨 论
据媒体报道,我国蜜蜂养殖相关企业多达2000余家,养殖蜂群数量更达820万群,为世界第一大蜜蜂养殖蜂群拥有国,由此推测国内养蜂从业人员多达万计。此外,随着生活水平的提高,百姓对旅游的需求加大,户外旅游爱好者数以百万,这部分人群和养蜂从业人员一样,均属于蜜蜂蜂毒暴露的高危人群。本研究显示全身反应组的暴露类型构成与局部反应组明显不同,其中50%(4/8)为养蜂者,提示蜜蜂蜂毒导致全身性严重过敏反应以职业养蜂人员最为常见,此类人群暴露几率大、发生反应重,医务工作者应给予足够重视。另外,本研究显示近半数蜜蜂蜂毒过敏患者生活在远离野外的市区,推测户外旅游可能是导致其蜂毒过敏的原因之一。
蜜蜂蜂毒过敏的诊断依赖临床病史,皮肤试验和(或)体外sIgE检测,而单纯皮肤试验和(或)体外sIgE检测阳性不足以诊断蜜蜂蜂毒过敏。孙宝青等[7]对广州地区呼吸道疾病患儿进行16种常见变应原检测,发现蜜蜂蜂毒阳性率0.94%。本研究对照组蜜蜂蜂毒(i1)sIgE最高者达15.2 kUA/L,但均无蜜蜂蛰刺过敏反应的相关临床病史。国外学者对无过敏症状但蜂毒sIgE阳性的人群进行了观察,发现高sIgE水平的患者,其T-IgE水平也高,这可能是针对交叉反应性糖类决定簇(cross-reacting carbohydrate determinants,CCDs)产生的致敏现象,而CCDs也存在于许多容易致人过敏的植物类过敏原中[8-9]。
为了更好地甄别真正的蜂毒过敏患者,Hamilton等[10]提出使用sIgE/T-IgE判断,某种变应原sIgE/T-IgE越高,意味着效应细胞表面锚定的该变应原sIgE分布越紧凑,当出现再次变应原暴露时,效应细胞被激活并释放炎性介质的可能性就越大。Johansson等[11]研究显示54%膜翅目蜂毒过敏患者的sIgE/T-IgE超过4%。本研究显示蜜蜂蜂毒过敏的全身反应组sIgE/T-IgE为3.51%(1.19%,8.84%),高于局部反应组和大局部反应组,并与对照组0.16%(0.09%,0.49%)存在显著差异。一方面提示sIgE/T-IgE越高,发生过敏反应的程度越重;另一方面提示相比sIgE,使用sIgE/T-IgE可以得到更准确的蜜蜂蜂毒过敏诊断。
在所有过敏反应类型中,全身性严重过敏反应最为凶险,该组患者随时可能因再次暴露蜂毒而发生致死性严重过敏反应,对这部分患者除了采取相应的回避措施外,还需配备包含自动注射式肾上腺素笔在内的急救包。在欧美国家,对此类患者还推荐特异性蜂毒免疫治疗。有资料显示,以100 μg蜜蜂蜂毒为维持剂量可以有效预防75%~95%全身性严重过敏反应患者再次发生过敏,如进一步增大维持剂量甚至可以取得更好效果[1]。对大局部反应患者是否需要特异性蜂毒免疫治疗目前尚有争议,但Severino等[12]指出,5%~10%出现大局部反应的蜂毒过敏患者再次遇到蛰刺时将发生全身反应。本研究亦有1例患者在出现大局部反应后3个月因再次蛰刺而出现全身反应,因此对大局部反应患者亦需给予足够重视,应准备和全身性严重过敏反应患者一样的急救包。
本研究对我国蜜蜂蜂毒过敏人群的临床特征进行了初步归纳,并依照不同过敏反应类型进行了初步分析,有助于医务工作者对本病的诊断与治疗。然而,因为受观察例数所限及国内现有检测方法相对单一,本研究尚存在局限性,需要在临床工作中继续收集病例,并开展检测和评估新方法,以期更全面地认识蜜蜂蜂毒过敏,并在临床工作做到正确诊断、恰当处置,避免死亡病例的发生。
[1]Przybilla B, Ruёff F. Hymenoptera venom allergy[J]. J Dtsch Dermatol Ges, 2010, 8:114-127.
[2]Biló BM, Rueff F, Mosbech H, et al. Diagnosis of Hymenoptera venom allergy[J]. Allergy, 2005, 60:1339-1349.
[3]Finegold I. Issues in stinging insect allergy immunotherapy: a review[J]. Curr Opin Allergy Clin Immunol, 2008, 8:343-347.
[4]Müller UR. Hymenoptera venom proteins and peptides for diagnosis and treatment of venom allergic patients[J]. Inflamm Allergy Drug Targets, 2011, 10:420-428.
[5]Incorvaia C, Mauro M, Pravettoni V, et al. Hypersensitivity to Hymenoptera venom: advances in diagnosis and implications for treatment[J]. Recent Pat Inflamm Allergy Drug Discov, 2011, 5:128-135.
[6]Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substitutes[J]. Lancet, 1977, 1:466-469.
[7]孙宝清, 郑佩燕, 王艳萍, 等. 广州地区呼吸道疾病患儿16种常见变应原检测分析[J]. 中华生物医学工程杂志, 2009, 15:45-48.
[8]Hemmer W, Focke M, Kolarich D, et al. Identification by immunoblot of venom glycoproteins displaying IgE-binding Nglycans as crossreacting allergens in honey bee and yellow-jacket venom[J]. Clin Exp Allergy, 2004, 34:460-469.
[9]Sturm GJ, Schuster C, Kranzelbinder B, et al. Asymptomatic sensitization to hymenoptera venom is related to total immunoglobulin E levels[J]. Int Arch Allergy Immunol, 2009, 149:261-264.
[10] Hamilton RG, Macglashan DW Jr, Saini SS. IgE antibody-specific activity in human allergic disease[J]. Immunol Res, 2010, 47:273-284.
[11] Johansson SG, No PPA, Oman H, et al. The size of the disease relevant IgE antibody fraction in relation to ‘total-IgE’ predicts the efficacy of anti-IgE (Xolair) treatment[J]. Allergy, 2009, 64:1472-1477.
[12] Severino M, Bonadonna P, Passalacqua G. Large local reactions from stinging insects: from epidemiology to management[J]. Curr Opin Allergy Clin Immunol, 2009, 9:334-337.

