高压水解芦丁分离制备异槲皮苷
于 婷, 付绍平, 肖远胜, 薛兴亚, 朱靖博
(1.大连工业大学 植物资源化学与应用研究所,辽宁 大连 116034;2.大连博迈科技发展有限公司,辽宁 大连 116034;3.中国科学院大连化学物理研究所 中国科学院分离分析化学重点实验室,辽宁 大连 116023)
0 引 言
月季花药材TLC检测项下首次提出以异槲皮苷作为对照标准[1],异槲皮苷是月季花中的主要活性成分之一,经国内外研究表明,异槲皮苷具有抗炎[2]、抗氧化[3-4]、降压[5]、抗病毒[6]等多种药理活性,常被用作辅助药物或药物有效成分给药,相关制剂开发前景广阔。
由于月季花药材中同时含有金丝桃苷和异槲皮苷,二者互为同分异构体,化学性质极其相似,给大量制备高纯的异槲皮苷造成了很大困难。因此本实验采用高压水解的方法[7],将芦丁水解成主要含有芦丁、异槲皮苷和槲皮素等水解产物,并选用SG64树脂柱色谱对芦丁的高压水解产物进行分离制备,可以快速得到高纯度的异槲皮苷。
1 仪器、试剂与材料
仪器:Ulti Mate3000高效液相色谱仪,美国戴安公司;UPLC-QTOF-MS液质联用仪,美国Waters公司;Br uker AVANCE,瑞士Br uker公司,400 MHz;X-5型显微熔点测定仪,北京泰克仪器有限公司;水蒸气反应釜,上海德兆仪器仪表有限公司;15 c m×100 c m动态轴向压缩色谱柱,大连博迈科技发展有限公司;柱塞计量泵,杭州之江石化装备有限公司;5 L旋转蒸发仪,上海申生科技有限公司;MDF反渗透纯水机,大连美德环保设备有限公司。
试剂与材料:SG64树脂,美国罗门哈斯公司;硅胶薄层板GF254,烟台市化学工业研究所;医用级芦丁,陕西森弗生物技术有限公司;异槲皮苷对照品,中国药科大学余伯阳教授提供;乙腈,色谱纯,美国Fisher公司;甲醇为工业级,沈阳市海洋顺化工有限公司;反渗透水。
2 实验方法
2.1 芦丁高压水解
称取医用级芦丁(90%)350 g,加入3倍质量水搅拌成糊状,将芦丁水浆液倒入反应釜内,每次150 mL。控制反应釜内水蒸气压力为0.60 MPa,维持30 min,可制得混合水解物,停止加热,降温排汽,将所得水解物真空抽滤,并用4倍质量的蒸馏水反复冲洗,得到固体物质230 g。将芦丁水解产物与异槲皮苷标准品点于同一GF254薄层板上,以V(氯仿)∶V(甲醇)∶V(水)(7∶3∶0.5)作为展开剂,喷以0.5%香草醛浓硫酸溶液显色,结果如图1所示。

图1 芦丁水解产物的薄层层析图Fig.1 TLC of hydrolysate of r utin
2.2 分离制备异槲皮苷
将水解产物(230 g)用10%甲醇水溶解,由泵打入装有处理好的SG64树脂的轴向压缩色谱柱中,以甲醇水(10%~50%)进行梯度洗脱,5 L为1个流份,所得各流份经高效液相色谱检测,在40%甲醇水的(1~26号)流分中含有异槲皮苷样品,将异槲皮苷质量分数在85%以上的流份合并浓缩,得到异槲皮苷粗品(含芦丁杂质)。根据异槲皮苷和芦丁在热水中的溶解性不同,用热水反复淋洗异槲皮苷粗品,最终得到异槲皮苷单体化合物。
3 结果与讨论
采用SG64树脂柱色谱对芦丁水解产物中的异槲皮苷进行快速分离,通过热水淋洗纯化得到15 g较纯的异槲皮苷。
3.1 异槲皮苷的纯度检测
色谱条件,Hypersil ODS2色谱柱(250 mm×4.6 mm,5μm);检测波长362 n m;流速1 mL/min;进样量20μL。流动相,A为乙腈,B为0.1%甲酸水;梯度洗脱条件:0~5 min,15%A;5~22 min,15%~20%A;22~37 min,20%~40%A;37~42 min,40%A。在所述色谱条件下,分离得到化合物的HPLC如图2所示,面积归一化法计算纯度达98.5%。
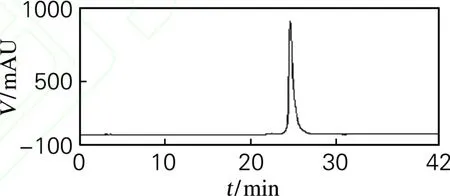
图2 异槲皮苷HPLC图Fig.2 HPLCchro matogram of isoquercitrin
3.2 结构鉴定
黄色粉末(甲醇),熔点225~227℃,TLC喷硫酸香草醛溶液加热显黄色,盐酸-镁粉反应和Molish反应均呈阳性。ESI-MS m/z:465[M+H]+,303[M-gl u+H]+。1H-NMR(DMSO,400 MHz)δ:12.64(1 H,s,OH-5),10.90(1 H,s,OH-7),9.77(1 H,s,OH-3′),9.26(1 H,s,OH-4′),7.59(1 H,d,J=2.5 Hz,H-2′),7.58(1 H,dd,J=2.0 Hz,J=8.0 Hz,H-6′),6.85(1 H,d,J=8.0 Hz,H-5′),6.42(1 H,d,J=2.0 Hz,H-8),6.22(1 H,d,J=2.0 Hz,H-6),5.47(1 H,d,J=7.5 Hz,H-1″),3.08-3.59(6 H,m,Gl ucose pr otons)。13C-NMR(DMSO,400 MHz)δ:177.4(C-4),163.9(C-7),161.2(C-5),156.3(C-9),156.1(C-2),148.3(C-4′),144.7(C-3′),133.3(C-3),121.6(C-1′),121.2(C-6′),116.1(C-5′),115.1(C-2′),104.0(C-10),100.8(C-1″),98.6(C-6),93.5(C-8),77.5(C-5″),76.3(C-3″),74.0(C-2″),69.8(C-4″),60.9(C-6″)。1H-NMR、13C-NMR 光谱数据与文献[8]基本一致,故鉴定化合物为异槲皮苷。
4 结 论
(1)槲皮素是芦丁和异槲皮苷的苷元,槲皮素第3个碳原子上连接一个芸香糖基即是芦丁,去掉芸香糖中的鼠李糖基,仅1个葡萄糖与槲皮素相连即为异槲皮苷(其结构转化如图3所示)。控制反应釜内水蒸气压力为0.60 MPa,维持30 min,水解得到的异槲皮苷最多,当反应压力达到0.80 MPa,维持10 min,芦丁上的葡萄糖和鼠李糖就会被同时水解掉,反应将全部转化为槲皮素,而无法生成异槲皮苷。(2)轴向压缩色谱柱的柱效高,重现性好,柱内壁高度抛光,有效减少了管壁效应,几乎可以达到分析柱的柱效,采用轴向压缩色谱柱与SG64树脂相结合分离芦丁的水解产物,分离操作时间短,样品处理量大,效果明显,适合于异槲皮苷对照品的大规模制备。
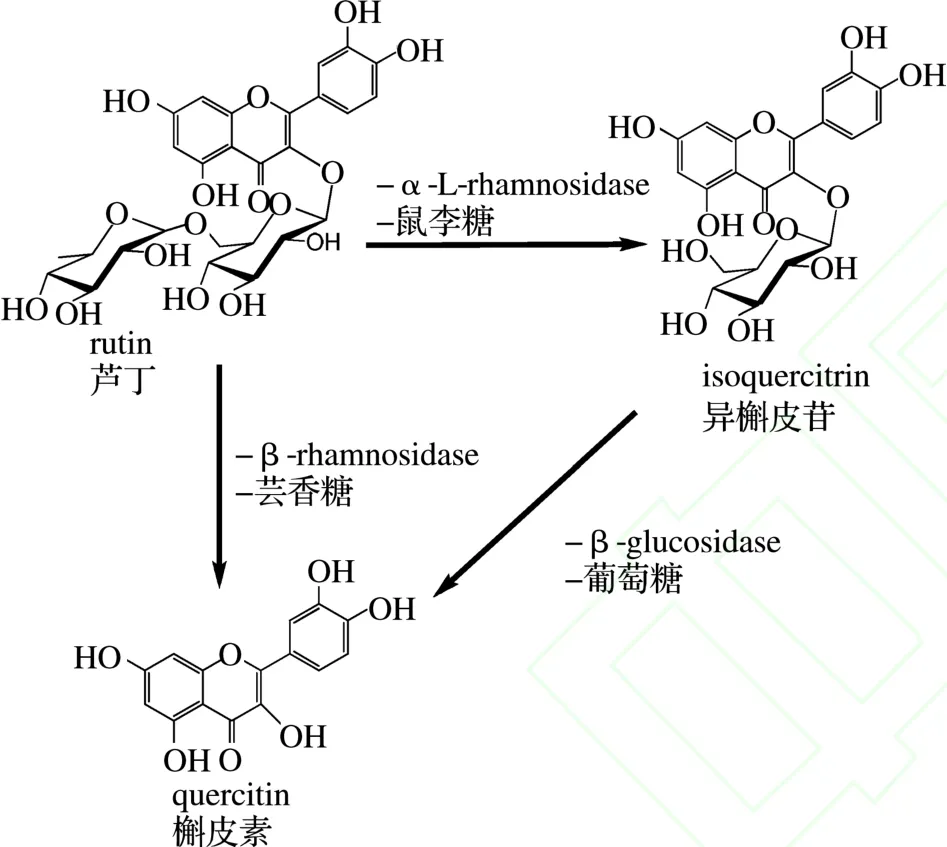
图3 芦丁、异槲皮苷和槲皮素结构转化Fig.3 Str ucturakl transfor mation a mong r utin,isoquercitrin and quercitin
[1]国家药典委员会.中国药典:一部[M].北京:中国医药科技出版社,2010:70.
[2]SOSA S,PACE R,BORNANCIN A,et al.Topical anti-infla mmatory activity of extracts and co mpounds fro m hypericu m perforatu m L[J].Journal of Phar macy and Pharmacology,2007,59:703-709.
[3]VITOR R,MOTA F,TEIXEIRA G,et al.Flavvonoids of an extract of pterospart u m tridentatu m showing endothelial protection against oxidative injur y[J].Jour nal of Ethnophar macology,2004,93(2/3):363-370.
[4]金越,吕勇,韩国柱,等.槲皮素及异槲皮素、芦丁抗自由基活性的比较研究[J].中草药,2007,38(3):408-412.
[5]国家医药管理局中草药情报中心站.植物有效成分手册[M].北京:人民卫生出版社,1996.
[6]LI Yong-jun,LUO Hong-feng,WANG Yong-lin,et al.Studies on the che mical constituents of flavonoids fro m polygonu m capitatu m[J].Chinese Phar maceutical Journal.2000,35(5):300-302.
[7]陜方,任贵兴.用芦丁制备槲皮素及异槲皮苷的方法:中国,200610065217.6[P].2006-08-16.
[8]FUNAYAMA S,HIKINO H.Hypotensive principles of diospyros kaki leaves[J].Che mical&Pharmaceutical Bulletin,1979,27(11):2865-2868.

