中间香型烤烟叶面腺毛形态及分泌特性研究
王霄龙 ,杨永霞,张松涛,冯琦,王晶,武东玲,崔红
河南农业大学烟草学院 ,烟草行业栽培重点实验室,郑州市文化路 95 号 450002
烟草叶面腺毛丰富且具有较强的分泌能力[1],腺毛分泌物不仅对烟株抗性具有积极作用,与烟叶香气品质和风味形成也密切相关[2]。因而,关于烟草腺毛生长发育、分泌及其与烟叶品质关系的研究颇受关注。Severson等[3]报道,氮供给、水分胁迫、机械伤害、光强和光质以及栽培措施都会对叶面分泌物的含量和组分产生影响。Heemann等[4]曾报道,分别种植在美国北卡罗来纳州Oxford和Tifton两地区的烟草品种NC2326,其腺毛分泌物中西柏三烯二醇含量相差3~4倍,而非腺毛产生的烃类含量差异很小。高致明等报道我国云南香料烟腺毛密度远远大于新疆香料烟,烟叶的质量风格也有很大不同[5]。由此推测,在特定生态区,由于环境因子的综合作用,叶面腺毛发育及物质分泌具有其特定特点,进而影响烟叶质量及风格。
我国地域辽阔,生态环境复杂,形成了以浓香型、清香型和中间香型为代表的不同烤烟类型[6]。贵州遵义为中间香型烤烟的典型产区,所产烤烟烟气细腻较柔和、较湿润,杂气轻、刺激轻微,余味干净较舒适,是中式卷烟的重要原料[7-8]。关于中间香型烟叶香气风格的形成机理研究多集中在叶片发育规律、物质代谢规律等方面,而腺毛作为叶面化学物质的主要来源部位,研究相对较少。本文以贵州遵义烟区烤烟品种K326为材料,采用显微观察、GC/MS技术及RT-PCR技术,对叶片发育过程中叶面腺毛形态结构、分泌物含量及分泌物合成相关基因表达进行了系统研究,旨在探索贵州烟叶叶片腺毛发育和物质分泌的特点,为中间香型烤烟风格形成机理研究提供理论依据。
1 材料与方法
1.1 材料
烤烟品种K326种植在贵州省遵义县鸭溪镇试验基地。2011年5月5日移栽,试验地土壤肥力中等,行距100 cm,株距50 cm,按当地烤烟生产标准进行正常栽培管理。于烟株返苗后,挑选生长发育较为均匀一致的烟株300棵,分别挂牌标记,并按照叶龄顺序取样(第十片叶长度达到5 cm时定为第1天)。
1.2 方法
1.2.1 腺毛形态观察
从叶尖向叶基数第6至8条支脉间,主脉至右侧叶缘之间的中央位置[9],每样取5份作为重复取样,4 % 戊二醛(磷酸缓冲液pH=7.2)固定 ,经脱水、置换、干燥、粘样、喷镀等过程后,使用Ouanta 200扫描电镜(美国FEI公司制造)观察并拍照记录,采用气体二次电子成像;工作电压15~20 kV,工作距离14.5~20 mm。腺毛密度统计时选取5个视野作为重复,并进行统计分析。
1.2.2 叶面化学分析
叶面分泌物采用圆片法[10]。分别在叶基部和叶中部于主脉两侧对称位置及叶尖沿主脉位置切取直径为10 cm的圆片共15片,将圆片在1000 mL萃取溶剂中依次浸提2 s,重复3次后加入含正十七烷醇和蔗糖八乙酸酯的内标1 mL,得到的浸提液分别经过过滤、旋转蒸发仪浓缩、氮吹仪吹干、硅烷化处理后采用气质联用分析仪并通过检索谱库(NIST08)确定成分。
GC条件:色谱柱为DB-5MSUI石英毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度为250 ℃;程序升温:40 ℃保持2 min,然后以6 ℃/min升温至180 ℃保持2 min,以2 ℃/min升温至280 ℃保持20 min;载气为高纯氦气,载气流速为恒流0.8 mL/min;进样量为1.0 μL,分流比为15:1。
MS条件:传输线温度为250℃;EI离子源温度为280℃;电离能量为70 eV;质量数范围在50~650 amu之间。
通过保留时间定性物质,后积分各物质对应峰曲线与基线的面积,得出具体数值,各种物质数据经过单位换算之后与参试叶片面积之比,即为单位面积叶片表面分泌物之值。
叶面积采用肖强等[11]的方法用数码相机采集图像后分析得出结果。由于叶龄10 d及20 d的叶片面积较小,故采用总面积相近的整叶替代圆片(面积差异小于5 %)。
1.2.3 RT-PCR分析
选取生长发育良好的中部叶,按叶龄取样,液氮冻保。每次取样将来源于不同烟株的三片叶混合以减少试验误差。按照Invitrogen Trizol Reagent说明书提供方法提取烟草总RNA,样品通过随机引物法反转录合成cDNA。采用Premier Prime 5.0软件,根据Genbank发布的CYC-1、CYP71D16和L25序列设计各基因扩增引物(表1),进行RT-PCR。其中L25是烟草核糖体蛋白[12],本研究中作为内参基因。

表1 扩增引物序列
PCR反应体系为20 μL。PCR扩增程序为:94℃预变性5 min;94℃ 30 s变性,50℃ 30 s退火,72 ℃1 min延伸,共33个循环;72 ℃延伸10 min。
2 结果与分析
2.1 腺毛形态结构及发育过程观察
利用显微技术对叶片发育过程中叶面腺毛进行观察,发现腺毛密度、形态结构随着叶片发育过程呈现规律性变化。图1显示叶龄10 d时腺毛密度达到最高,随后急剧下降。这可能是由于叶片进入快速生长期,叶面积迅速扩展而引起;从20 d到40 d腺毛密度呈平缓下降的趋势,而在叶龄50 d时又有明显的下降。

图1 不同时期腺毛密度变化趋势
对叶龄10 d和50 d的叶片进行扫描电镜观察,发现K326叶面腺毛主要由长柄多腺头腺毛组成。在叶龄10 d时,腺毛密度浓密,腺头细胞主要由1~2个细胞组成;而且大量新生腺毛不断发生(图2-A1,A3)。说明该时期是腺毛分化、形成的重要时期。在叶龄50 d 时,腺毛密度明显降低,而且不再有新生腺毛的发生;腺头由多个细胞组成,并开始皱缩、脱落,推测腺毛进入成熟、衰老阶段(图2-A2,A4)。

图2 腺毛形态结构及发育过程观察
2.2 叶面化学分析
采用叶圆片法提取叶面分泌物,利用GC/MS共检测出物质成分47种,包括未知成分12种;已知成分35种。其中,西柏烷类化合物是腺毛特异分泌的主要成分,另外也检测到烷烃,蔗糖酯等物质,见图3。

图3 不同叶龄色谱分析图
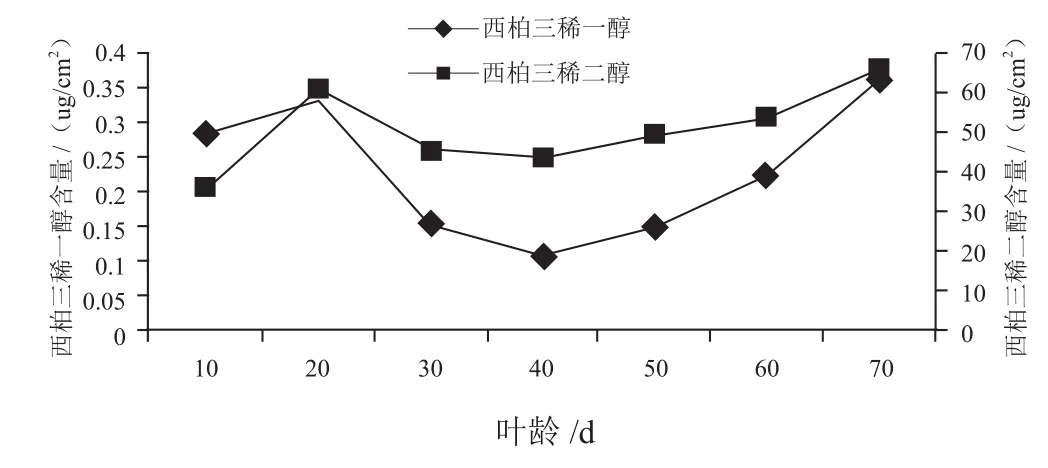
图4 腺毛分泌物西柏三烯二醇和西柏三烯一醇含量
图4显示叶片发育过程中西柏烷类化合物含量的变化趋势。可以看出:西柏三烯二醇含量较高,西柏三烯一醇含量较低。二者都呈现出先上升,后下降,再上升的趋势。而且,在叶龄20 d时都出现一个峰值,随后逐渐降低,40 d后开始缓慢上升,并在70 d时达到最大值。
2.3 西柏烷化合物合成关键基因的表达分析
由于西柏烷类化合物只在腺毛中合成[13],故以叶片总RNA为模板进行RT-PCR分析,亦能反映出腺毛中该基因的表达规律。
西柏三烯一醇合成酶(cembratriene-ol synthase,CYC-1)是将牻牛儿基牻牛儿基焦磷酸转化为西柏三烯一醇的关键酶[14];西柏三烯一醇羟化酶(cembratriene-ol hydroxylase,CYP71D16),则催化西柏三烯一醇向西柏三烯二醇转化[15]。二者都是西柏烷类化合物合成的关键酶,与腺毛的物质代谢和分泌密切相关。以L25基因为内参,对叶片发育过程中这两个基因进行表达分析,结果如图5所示。可以看出,两基因的表达趋势有一定协同性,都在叶龄20 d、40 d和70 d时表达较强,这与腺毛分泌物中西柏烷类化合物的含量变化趋势一致,说明CYC-1和CYP71D16是调控西柏烷类化合物合成的关键基因,其表达强度强烈影响西柏烷类化合物的含量。

图5 不同叶龄腺毛类萜代谢关键基因半定量表达分析
3 讨论
从腺毛形态学来看,贵州遵义地区烤烟品种K326叶面腺毛以长柄腺毛为主,这与河南种植的K326相同(见后续报道),表明生态环境对腺毛的类型影响不大。腺毛密度在20 d前变化明显,之后缓慢减少,这可能是由于烟株进入成熟阶段,腺毛不再发生,成熟腺毛开始脱落而造成,这与时向东等[9]的报道一致。化学分析结果表明,遵义地区 K326叶面化学成分中西柏烷类化合物占据绝对优势,这与史宏志等[16]的研究结果一致,表明不同生态环境中叶面分泌物保持一定的稳定性。但检测结果中发现了许多未知物质,不排除中间香型烟叶叶面分泌物中具有其独特成分,而这需要不同香型烟叶叶面化学的比较研究结果支持。
在叶片发育过程中,西柏三烯一醇和西柏三烯二醇含量变化及其基因表达规律呈现高度一致,并在叶龄20 d时出现一个积累高峰。这可能是由于20 d后腺毛密度的急剧下降所造成。随着叶片形态发育的完成,腺毛密度逐渐稳定,叶面分泌物逐渐积累并在成熟采收前达到最高值,这与杨铁钊等[17]的研究结果基本相同。从CYC-1和CYP71D16的表达规律来看,二者之间有紧密的协同性,变化趋势与腺毛分泌物中西柏烷类化合物的含量变化趋势一致。这说明其表达水平与代谢物质含量密切相关。
即使是在只有1~2个腺头细胞的不成熟腺毛中,西柏烷类化合物的合成和分泌也在活跃进行,叶面化学成分检测和基因表达强度均在20 d、40 d和70 d出现显著增强,推测认为CYC-1和CYP71D16的表达水平与代谢物质含量密切相关。
[1] 闫克玉,赵铭钦.烟草原料学[M].北京:科学出版社.2008:71.
[2] 左天觉.烟草的生产、生理和生物化学[M].朱尊权,译.上海:上海远东出版社,1993:40-43.
[3] Severson R F, Johnson A W, Jackson D M. Cuticular constituents of tobacco: factors affecting their production and their role in insect and disease resistance and smoke quality [J]. Recent advances in Tobacco Science,1985,11:105-174.
[4] Heemann V, Brümmer U, Paulsen C, et al. Composition of the leaf surface gum of some Nicotiana species and Nicotiana tabacum cultivars [J]. Phytochemist ry,1983,22(1):133-135.
[5] 高致明,刘国顺,符云鹏,等.香料烟叶片腺毛及分泌细胞的研究[J].河南农业大学学报,1996,30(4):329-346.
[6] 丁瑞康,王承瀚,朱尊权,等.卷烟工艺学[M].北京:食品工业出版社,1958:49-50,60-71.
[7] 程贵敏,张长云,周淑平,等.贵州中间香型烟叶质量的综合评价[J]. 贵州农业科学,2011, 39( 6) : 46- 50.
[8] 厉福强,梁永江,陈杰,等.遵义烟区南北生态区域的划分[J].中国烟草科学,2009,30(3):33-36.
[9] 时向东,杨会丽,高致明,等.烤烟叶片腺毛发育过程的扫描电镜观察[J].河南农业大学学报,2005,39(2):155-157.
[10] 韩锦峰,王广山,远彤,等.烤烟叶面分泌物的初步研究[J].中国烟草,1995,16(2):10-13.
[11] 肖强,叶文景,朱珠,等.利用数码相机和Photoshop软件非破坏性测定叶面积的简便方法[J].生态学杂志,2005,24(6):711-714.
[12] Schmidt G W, Delaney S K. Stable internal reference genes for normalization of real-time RT-PCR in tobacco (Nicotiana tabacum) during development and abiotic stress [J]. Mol Genet Genomics, 2010(283):233-241.
[13] Keener C K, Wanger G J. Direct demonstration of duvatriendiol biosyntheis in glandular heads of tobacco trichome [J]. Plant Physio,1985,79:1026-1032.
[14] Erming Wang, George J Wagner. Elucidation of the functions of genes central to diterpene metabolism in tobacco trichomes using posttranscriptional gene silencing[J]. Planta, 2003 (216): 686-691.
[15] Wang E, Wang R, DeParasis J, et al. Suppression of a P450 hydroxylase gene in plant trichome glands enhances naturalproduct-based aphid resistance [J]. Nature Biotechnology,2001, 19(4): 371-374.
[16] 史宏志,官春云.烟草腺毛分泌物的化学成分及遗传[J].作物研究,1995,9(3):46-49.
[17] 杨铁钊,李伟,李钦奎,等.烤烟叶面腺毛密度及其分泌物变化动态的相关分析[J].中国烟草科学,2005,26(1):43-46.

