精索静脉曲张程度与精液质量的相关性研究
邓晓俊,郎根强,章益峰,褚 健,庄剑秋,曹建伟
近年来,男性不育症发病率呈上升趋势,约占不育夫妇总数的20%以上[1]。流行病学调查表明,近半个世纪来男性精液中各参数都呈明显下降趋势[2]。其主要病因有环境因素、精子生成和精子成熟受阻的自身因素[3]。精索静脉曲张(varcocele,VC)是男性常见的影响精液质量,导致生殖障碍的一种疾病。2008年1月至2011年1月,笔者对110例精索静脉曲张及35名正常男性的精液进行了研究分析,以探讨精索静脉曲张程度与精液质量的相关性。现报告如下。
1 资料与方法
1.1 一般资料 110例精索静脉曲张患者为观察组,年龄18~35岁,平均25岁,其中已婚87例,未婚23例;轻度36例,中度35例,重度39例,伴不育51例;左侧精索静脉曲张67例,右侧19例,双侧24例。所有患者均排除脑垂体病变、染色体异常、生殖器异常或先天性病变、泌尿生殖系感染、性功能障碍等影响生育的疾病。同期35例正常已婚已育男性为正常组。
1.2 精液样本采集 2组均禁欲5~7 d后,用取精器取精液置于已消毒的干燥量杯中,置37℃水浴箱内液化,按照世界卫生组织精液参数检测方法[4]进行全自动分析。
1.3 统计学处理 采用SPSS 13.0统计学软件包进行统计学处理,所有数据均采用均数±标准差(±s)表示,组间比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2组精液参数见表1。可见,精索静脉曲张程度与阴囊温度、精液量及精液pH值相关性不大(P>0.05);而随着精索静脉曲张逐渐加重,精子密度、精子存活率及a+b级精子比例下降显著,与正常组比较差异有统计学意义(P<0.05)。
表1 正常组与观察组不同程度精索静脉曲张患者精液参数比较(±s)
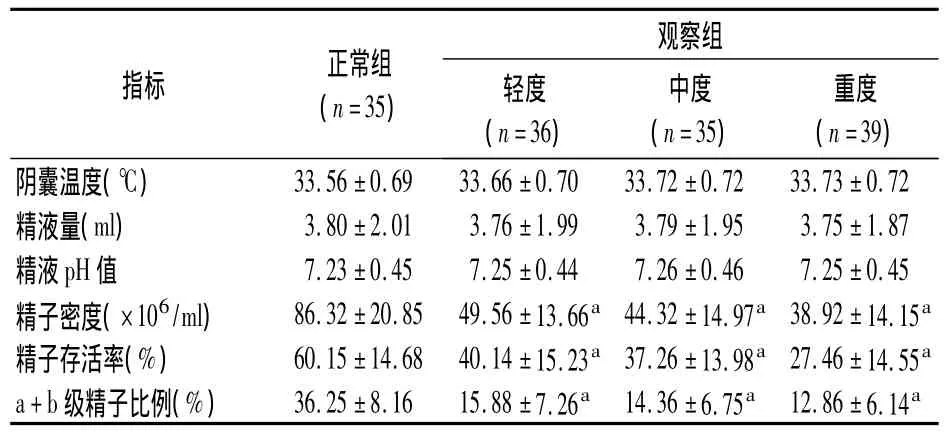
表1 正常组与观察组不同程度精索静脉曲张患者精液参数比较(±s)
注:与正常组比较aP<0.05
指标 正常组(n=35)观察组轻度(n=36)中度(n=35)重度(n=39)阴囊温度(℃) 33.56 ±0.69 33.66±0.70 33.72 ±0.72 33.73 ±0.72精液量(ml) 3.80 ±2.01 3.76±1.99 3.79 ±1.95 3.75 ±1.87精液 pH 值 7.23 ±0.45 7.25±0.44 7.26 ±0.46 7.25 ±0.45精子密度(×106/ml) 86.32 ±20.85 49.56±13.66a 44.32 ±14.97a 38.92 ±14.15a精子存活率(%) 60.15 ±14.68 40.14±15.23a 37.26 ±13.98a 27.46 ±14.55a a+b级精子比例(%) 36.25 ±8.16 15.88±7.26a 14.36 ±6.75a 12.86 ±6.14a
3 讨论
VC与男性不育密切相关,但该病引起不育的机制至今尚未完全阐明。Sakamoto等[5]研究认为,VC患者返向血流的存在是导致不育的重要原因。实际上,VC时精索静脉回流不畅,血液淤滞,导致阴囊内温度升高,而睾丸生精过程需在一个较身体低1℃的环境中才能进行。1980年Nakamura等[6]首先利用热敏电阻探针证实VC患者睾丸温度升高。睾丸温度升高使生精小管变性,影响精子的生成,从而影响生育。本组110例精索静脉曲张患者中,精索静脉曲张程度与阴囊温度、精液量及精液pH值相关性不大。
氧化应激是与男性生殖有关的一个重要因素[7]。氧自由基可以破坏机体细胞。在生理条件下产生的活性氧在精子活力、获能、顶体反应等方面起重要作用。VC时通过多种途径使精索静脉血液活性氧水平升高,抗氧化物水平降低。Mostafa等[8]研究表明,VC患者精浆中过氧化氢(H2O2)和丙二醛(MDA)等明显升高,而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、维生素E和维生素C等抗氧化剂明显降低。Ozbek等[9]研究发现,VC患者精索静脉内SOD和谷胱甘肽过氧化物酶(GSH-Px)明显低于正常生育男性。Agarwal等[10]发现,VC不育患者血液中活性氧的浓度显著增高,同时抗氧化能力显著下降。这些研究均证实VC患者抗氧化的防御体系受到破坏。在此过程中,不仅过氧化物含量逐渐增加,而且酶促体系中SOD和CAT等活力降低,总抗氧化能力亦降低,并且随着发病时间的延长而更加严重。
目前更多的研究主要集中在VC对睾丸的影响上。睾丸质量的变化是评价生育功能的一项基本指标,其与生精质量和精子的密度关系密切。Barqawi等[11]发现,大鼠左精索静脉曲张试验模型建立14 d后左侧睾丸生精细胞、初级精母细胞及精子细胞明显减少。Unsal等[12]证实VC患者存在睾丸微循环障碍。VC可引起睾丸功能下降,VC对睾丸功能的影响主要表现在精子数量减少、畸形精子异常增加、精子活动度降低。本组精索静脉曲张患者精子质量均有不同程度改变,且随着精索静脉曲张逐渐加重精子密度、精子存活率及a+b级精子比例下降显著。可见随着VC程度的加重,患者生育能力也逐步下降。
目前手术仍然是治疗VC不育的主要手段。但手术只能使2/3左右的患者精液质量得到改善[13]。Balci等[14]对VC患者手术前后的对比发现,术后精子质量明显改善。Mohamed等[15]发现,术后精子密度、精子活动度等显著提高。因此,精索静脉手术可以显著提高精液各项参数。但对于精液结果正常或亚临床型VC合并不育的患者,一般不推荐手术治疗[16-17]。
VC对生育的影响,已经有了大量的相关临床和实验基础积累,但由于人类生殖的复杂性,人类对自身生殖的了解仍然非常有限,还有很多未解之谜。相信随着分子生物学、分子遗传学和人类辅助生殖技术的进一步深入,研究手段进一步革新,将来会实现相关诊疗技术的飞跃发展,为广大VC不育患者带来新的希望。
[1] Schulte RT,Ohl DA,Sigman M,et al.Sperm DNA damage in male infertility:etiologies,assays,and outcomes[J].J Assist Reprod Gener,2010,27(1):3-12.
[2] Cooper TG,Noonan E,Von Eckardstein S,et al.World Healthy Organization reference values for human semen characteristics[J].Hum Reprod Update,2010,16(3):231-245.
[3] Joffe M.What has happened to human fertility[J].Hum Reprod,2010:25(2):295-307.
[4] World Healthy Orgnization.WHO laboratory manual for the exam ination of human sperm and sperm-cervical mucus interaction[M].4th.NewYork:Cambridge University Press,1999:3-52.
[5] Sakamoto H,Saito K,Schichizyo T.Color Doppler ultrasonography as a routine clinical examination in male infertility[J].Int J Urol,2006,13(8):1073-1078.
[6] Nakamura M,Hall PF.The mechanism by which body temperature inhibits protein biosynthesis in spermatids of rat testes[J].J Biol Chem,1980,255(7):2907-2913.
[7] Makker K,Agarwal A,Sharma R.Oxidative stress& male infertility[J].Indian J Med Res 2009,129(4):357-367.
[8] Mostafa T,Anis T,Imam H,et al.Seminal reactive oxygen species-antioxidant relationship in fertile males with and without varicocele[J].Andrologia,2009,41(2):125-129.
[9] Ozbek E,Cekmen M,Simsek A,et al.Comparison of antioxidant enzyme activity in the internal spermatic vein and brachial veins of patients with infertile varicocele[J].Int Urol Nephrol,2008,40(3):679-683.
[10] Agarwal A,Prabakaran S,Allamaneni SS.Relationship between oxidative stress,varicocele and infertility:a meta-analysis[J].Reprod Biomed Online,2006,12(5):630-633.
[11] Barqawi A,Caruso A,Meacham RB.Experimental varicocele inducestesticular germcell apoptosis in the rat[J].J Urol,2004,171(4):501-503.
[12] Unsal A,Turgut AT,Taskin F,et al.Resistance and pulsatility index increase in capsular branches of testicular artery:indicator of impaired testicular microcirculation in varicocele[J].J Clin Ultrasound,2007,35(4):191-195.
[13] Chantoda-Abal V,Rey-Fraga D,Gonzalez-Martin M.Medical and surgical treatment of varicocele [J].Arch Esp Urol,2004,57(9):951-961.
[14] Balci A,Karazincir S,Gorur S,et al.Long-term effect of varicocele repair on intratesticular arterial resistance index[J].J Clin Ultrasound,2008,36(3):148-152.
[15]Mohamed T,Ismail,John S,et al.Are sperm motion parametersinfhmnced by ovaricocele ligation[J].Fertil Steril,1999,71(5):886-890.
[16]Grasso M,Lania M,Castelli M,et al.Low-grade left varicocele in patients over 30 years old:the effect of spermatic vein ligation on fertility[J].BJU Int,2000,85(3):305-307.
[17] Unal D,Yeni E,Verit A,et al.Clomophene citrate versus varicocelectomy in treatment of subalinical varicocele:a prospective randomized study[J].Int J Urol,2001,8(5):227-230.

