富氢U W液减轻大鼠肾脏低温保存期缺血损伤
徐如彬,杜洪印,喻文立,翁亦齐,王永旺,任恒昌
(1.天津医科大学研究生院,天津300070;2.天津市第一中心医院麻醉科,天津300192)
肾移植是终末期肾病患者的最佳治疗措施。由于需进行组织配型及供体转运,供肾切取后常需低温保存于器官保存液中,以减缓器官代谢,保存组织活性。然而,低温、缺血、缺氧致使保存期移植器官组织缺氧及微循环障碍,肾小管上皮细胞损伤甚至死亡[1-2]。长时间冷缺血是移植肾功能延迟的主要风险因素之一,严重者导致慢性移植物肾病,移植肾失功能[3-4]。最近研究证实,即使在移植器官再灌注前,低温保存所致的器官损伤也有活性氧簇(ROS)的参与[2,5-6]。另有文献显示,在低温所致的细胞毒性级联反应中,活性氧产生致使下游信号通路激活,导致细胞凋亡[1,7]。因此,在移植器官低温保存期采取抗氧化措施,可减弱缺血损伤。分子氢(H2)是一种新型有效的抗氧化剂,可选择性地清除细胞毒性氧自由基[8]。围术期吸入H2或者应用含氢液体具有抗氧化、抗炎症、抗凋亡作用,可显著减轻移植所致的移植器官损伤[9-13]。最近一些研究将H2加入器官保存液中,发现在低温保存期应用H2,可减轻移植所致缺血再灌注损伤,改善移植器官预后[11-13]。然而,应用含氢器官保存液能否减轻低温保存期相关损伤尚未明确。本研究将 H2加入 University of Wisconsin器官保存液(UW液),制成富氢UW(HRUW)液,验证其是否对低温保存大鼠肾脏具有保护作用。
1 材料和方法
1.1 材料
1.1.1 动物 健康成年雄性Wistar大鼠,体质量200~250g,购于中国人民解放军军事医学科学院实验动物中心,无特殊病原体(SPF)环境下饲养,自由进食、饮水。
1.1.2 主要仪器 光学显微镜(日本Olympus公司,BX51TF);分光光度计(美国Thermo Electron公司,UNICAM UV300);氢气发生器(北京中科汇恒技术开发有限公司,ZK-300);气相色谱分析仪(美国Agilent公司,6890N GC)。
1.1.3 主要试剂 UW 液(美国 Bristol-Myers Squibb公司);脂质氧化(MDA)检测试剂盒、锰超氧化物歧化酶(Mn-SOD)活性检测试剂盒(碧云天生物技术有限公司);Caspase-3活性检测试剂盒(美国BioVision公司,K106)。
1.1.4 HRUW液制备 按Buchholz等[11]的方法,将氢气冲入200mL UW液中,持续30min,制备HRUW液,γ射线杀菌,实验时使用新鲜制备的HRUW液且每6h更换一次以保证稳定的氢浓度。1.2研究方法
1.2.1 动物模型制备 参照Mitchell等[14]的方法进行,腹腔注射10%水合氯醛(0.4mL/100g)麻醉大鼠,腹正中切口暴露左侧肾脏,显微血管钳阻断下腔静脉及腹主动脉上、下端,由腹主动脉下端插入灌注管。在下腔静脉下端剪一开口,灌注UW液,速度1.5~2.0mL/min,左肾和所属血管完全苍白,且自下腔静脉流出液变清澈时停止灌注,摘取左肾。肾脏低温保存后,经中部横切分为上下两部分,上半部浸于4%中性甲醛溶液中过夜,石蜡包埋,用于组织形态学观察。下半部迅速置于液氮中保存,用于提取蛋白检测。
1.2.2 实验分组 采用随机数字表法将24只大鼠随机分为3组,每组8只。正常对照组(C组):肾脏不进行保存;UW液保存组(UW组):将肾脏于4℃UW液中保存48h;HRUW液保存组(HRUW组):将肾脏于4℃HRUW液中保存48h。
1.2.3 肾脏组织的形态学观察 肾组织样本保存于4%中性甲醛溶液内,石蜡包埋,制成5μm薄片,行HE染色,于光学显微镜下观察,依照Gobe的评分方法[15]分析肾小管上皮细胞的损伤程度。
1.2.4 肾脏组织内丙二醛含量、Mn-SOD活性、Caspase-3活性的检测 分别采用MDA检测试剂盒、Mn-SOD活性检测试剂盒、Caspase-3活性检测试剂盒,按说明书进行操作。
2 结果
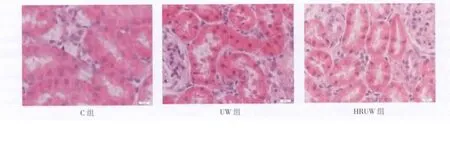
图1 低温保存后大鼠肾脏标本的组织形态学改变(HE×400) Fig 1 Hypothermic storage-induced morphological renal changes(HE×400)
2.1 肾脏组织形态学变化 各组大鼠肾脏组织形态学变化见图1。C组肾脏肾小管结构清晰,无明显病变;UW组可见肾小管损伤严重,小管明显扩张,刷状缘损伤严重甚至缺失,小管细胞内出现明显空泡,细胞核深染,出现较多凋亡细胞;HRUW组病理改变较UW组明显减轻,部分肾小管上皮细胞刷状缘脱落,凋亡细胞较UW组明显减少。各组肾小管损伤的半定量评分结果见图2。UW组肾小管损伤评分明显高于C组(P<0.01),HRUW组肾小管损伤评分明显低于UW组(P<0.05)。
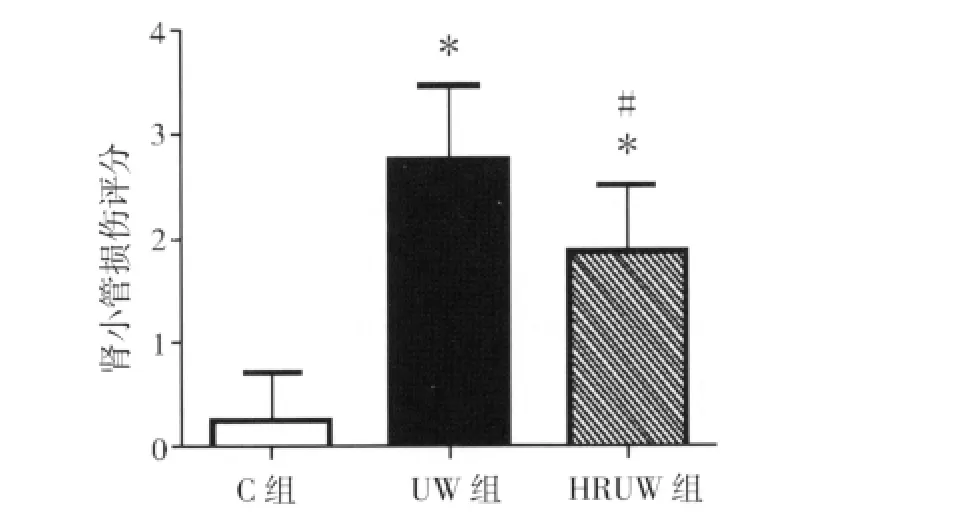
图2 HRUW液对肾小管损伤评分的影响Fig 2 The effects of HRUW solution on tubular injury scores
2.2 肾脏组织内MDA含量 UW组及HRUW组肾脏组织内MDA含量均高于C组(P<0.01);HRUW组肾脏组织内MDA含量低于UW组(P< 0.01),见图3。

图3 HRUW液对肾组织内MDA含量的影响Fig 3 The effects of HRUW solution on MDA levels in renal tissue
2.3 各组肾脏组织内Mn-SOD活性变化 与C组相比,UW组和HRUW组肾脏组织内Mn-SOD活性均显著降低(P<0.01);HRUW组肾脏组织内Mn-SOD活性明显高于UW组(P<0.01)。见图4。
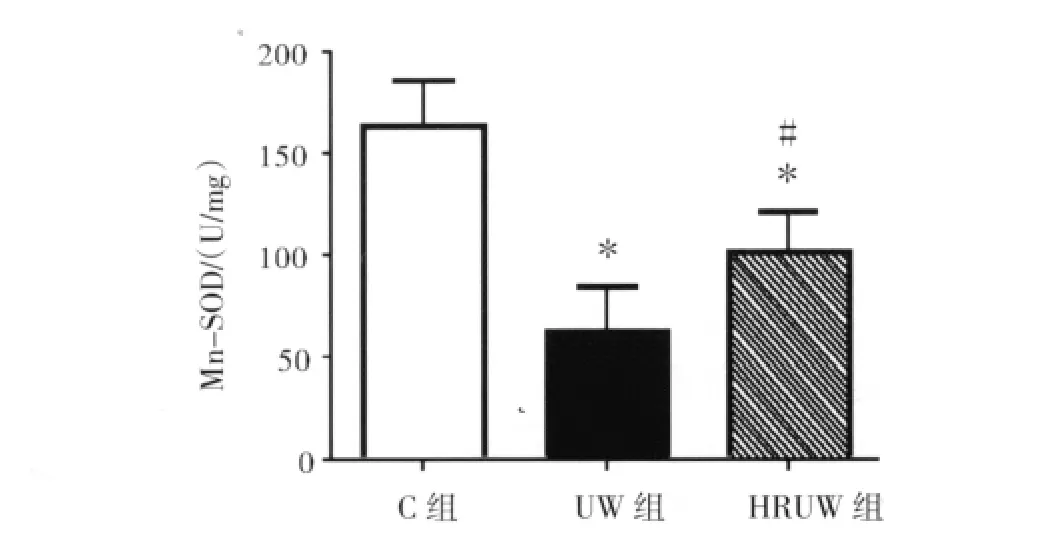
图4 HRUW液对肾组织内Mn-SOD活性的影响Fig 4 The effects of HRUW solution on renal Mn-SOD activity
2.4 各组肾脏组织内Caspase-3活性变化 与C组相比,UW组和HRUW组肾脏组织内Caspase-3活性均显著增高(P<0.01);HRUW组肾脏组织内Caspase-3活性明显低于UW组(P<0.01)。见图5。
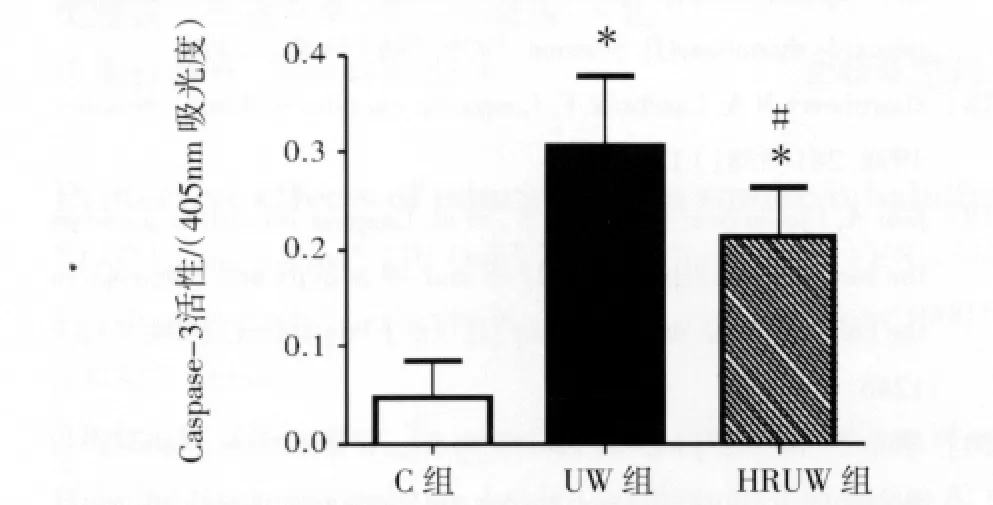
图5 HRUW液对肾组织内Caspase-3活性的影响Fig 5 The effects of HRUW solution on renal Caspase-3activity
3 讨论
本研究将H2充入UW液中用于大鼠肾脏低温保存阶段,首次证明富氢UW液减轻低温保存期离体大鼠肾脏冷缺血损伤。
尸体供体器官常需经历一段低温保存时期。然而,低温、缺血、缺氧常导致低温保存器官产生严重的冷缺血损伤。严重的冷缺血损伤增加移植后器官功能恢复延迟的发生率,影响移植器官的长期预后。最近的文献显示,低温保存器官产生ROS,激活下游信号通路,导致细胞凋亡,低温保存器官产生冷缺血损伤[1,7]。H2是一种新型有效的抗氧化剂,可选择性地清除细胞毒性氧自由基,具有抗氧化应激、抗炎症、抗凋亡作用[8]。
移植器官在低温保存阶段产生ROS,与膜多不饱和脂肪酸稳定结合,导致脂质过氧化,扰乱膜流动性,破坏细胞结构,致使组织损伤。MDA是脂质过氧化反应的终产物,其含量反映脂质过氧化反应的程度及水平[16]。Mn-SOD是一种存在于线粒体内的核编码蛋白酶,可将超氧化物歧化为过氧化氢,后者通过过氧化物酶或谷胱甘肽过氧化物酶分解为水。Mn-SOD是线粒体内的主要抗氧化剂,代表组织清除ROS的能力[17]。本研究结果显示,离体肾脏在UW液中长时间低温保存后,组织内MDA含量显著升高,而HRUW液组肾脏组织MDA含量较UW液组明显降低,同时Mn-SOD活性增强,也即消耗减少,表明将H2加入器官保存液中可清除低温保存器官产生的ROS,产生抗氧化应激作用,从而减轻移植器官低温保存损伤。
凋亡是低温保存器官细胞死亡的一种重要形式,Caspase-3的激活被认为是凋亡过程的关键步骤,它的抑制可以阻止细胞凋亡[18]。既往研究显示,在器官保存液中加入抗氧化剂或Caspase抑制剂可以抑制保存器官的细胞凋亡,减轻组织损伤[15,19]。本研究中,UW组肾组织形态学损伤严重,肾小管损伤评分显著升高,凋亡细胞增加,同时肾组织Caspase-3活性明显升高,表明移植器官长时间低温保存致使肾组织细胞凋亡,产生低温保存缺血损伤,这与此前的一些研究结果一致[1-2,8,19]。HRUW组肾组织形态学改变较UW组明显改善,同时肾组织Caspase-3活性降低,表明往器官保存液中充入H2可以抑制低温保存器官细胞凋亡。低温保存期和再灌注期是移植器官遭受损伤的两个重要阶段。既往有研究显示富氢器官保存液可减轻器官移植所致的缺血再灌注损伤,抑制移植后细胞凋亡,改善移植器官长期预后[11-13]。本研究结果表明,即使仅在再灌注期前的器官低温保存阶段,使用抗氧化剂H2也可抑制保存器官的细胞凋亡,减轻移植器官的低温保存损伤。
H2作为抗氧化剂已经用于大量动物实验研究,它可以迅速透过生物膜性结构,弥散到胞质、线粒体、细胞核产生作用[20]。富氢UW液制备方便,使用安全。最近已有用于制备临床用富氢液体的设备上市[13],富氢UW液将为临床上改善移植器官低温保存条件提供一种选择。
综上所述,将H2加入UW液用于大鼠离体肾脏低温保存阶段,可降低低温缺血所致的氧化应激作用,抑制细胞凋亡,减轻大鼠肾脏低温保存期损伤。
[1] Salahudeen A K,Joshi M,Jenkins J K,et al.Apoptosis versus necrosis during cold storage and rewarming of human renal proximal tubular cells[J].Transplantation,2001,72(5):798
[2] Salahudeen A K.Cold ischemic injury of transplanted kidneys:new insights from experimental studies[J].Am J Physiol Renal Physiol, 2004,287(2):F181
[3] Hetzel G R,Klein B,Brause M,et al.Risk factors for delayed graft function after renal transplantation and their significance for longterm clinical outcome[J].Transplant Int,2002,15(1):10
[4] Schwarz A,Mengel M,Gwinner W,et al.Risk factors for chronic allograft nephropathy after renal transplantation:a protocol biopsy study[J].Kidney Int,2005,67(1):341
[5] Rauen U,de Groot H.New insights into the cellular and molecular mechanisms of cold storage injury[J].J Investig Med,2004,52(5): 299
[6] Hauet T,Mothes D,Goujon J M,et al.Protective effect of polyethylene glycol against prolonged cold ischemia and reperfusion injury: study in the isolated perfused rat kidney[J].J Pharmacol Exp Ther, 2001,297(3):946
[7] Salahudeen A K,Huang H,Joshi M,et al.Involvement of the mitochondrial pathway in cold storage and rewarming-associated apoptosis of human renal proximal tubular cells[J].Am J Transplant, 2003,3(3):273
[8] Ohsawa I,Ishikawa M,Takahashi K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nat Med,2007,13(6):688
[9] Buchholz B M,Kaczorowski D J,Sugimoto R,et al.Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury[J].Am J Transplant,2008,8(10):2015
[10]Kawamura T,Huang C S,Tochigi N,et al.Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats[J].Transplantation,2010,90(12):1344
[11]Buchholz B M,Masutani K,Kawamura T,et al.Hydrogen-enriched preservation protects the isogeneic intestinal graft and amends recipient gastric function during transplantation[J].Transplantation, 2011,92(9):985
[12]Tan M,Sun X,Guo L,et al.Hydrogen as additive of HTK solution fortifies myocardial preservation in grafts with prolonged cold ischemia[J].Int J Cardiol,2011,12:109
[13]Abe T,Li X K,Yazawa K,et al.Hydrogen-rich University of Wisconsin solution attenuates renal cold ischemia-reperfusion injury [J].Transplantation,2012,94(1):14
[14]Mitchell T,Rotaru D,Saba H,et al.The mitochondria-targeted antioxidant mitoquinone protects against cold storage injury of renal tubular cells and rat kidneys[J].J Pharmacol Exp Ther,2011, 336(3):682
[15]Gobe G,Zhang X J,Willgoss D A,et al.Relationship between expression of Bcl-2genes and growth factors in ischemic acute renal failure in the rat[J].J Am Soc Nephrol,2000,11(3):454
[16]Cuzzocrea S,Reiter R J.Pharmacological action of melatonin in shock,inflammation and ischemia/reperfusion injury[J].Eur J Pharmacol,2001,426(1/2):1
[17]Estevez A G,Crow J P,Sampson J B,et al.Induction of nitric oxide-dependent apoptosis in motor neurons by zinc-deficient superoxide dismutase[J].Science,1999,286(5449):2498
[18]Thornberry N A,Lazebnik Y.Caspases:enemies within[J].Science, 1998,281(5381):1312
[19]Jani A,Ljubanovic D,Faubel S,et al.Caspase inhibition prevents the increase in caspase-3,-2,-8and-9activity and apoptosis in the cold ischemic mouse kidney[J].Am J Transplant,2004,4(8): 1246
[20]Ohta S.Recent progress toward hydrogen medicine:potential of molecular hydrogen for preventive and therapeutic applications[J]. Curr Pharm Des,2011,17(22):2241

