盐胁迫筛选对三裂叶漆实生苗群体遗传结构的影响1)
任亚超 蒋海月 杨 青 王进茂
(河北农业大学,保定,071000) (北京师范大学) (河北农业大学)
近年来,植物耐盐种质资源评价[1-2]及耐盐育种材料的筛选[3-4]在国内外被广泛关注,许多学者从盐碱胁迫下树木生长发育[5]、生理生化反应[6]、基因工程在树木抗盐碱方面的运用[7-8]等方面开展了大量研究。植物种子繁殖的实生个体、基因型不同,存在广泛的遗传多样性,通过盐胁迫筛选,能否筛选出适应高盐质量分数条件的基因型,是通过盐胁迫筛选培育耐盐新品种的重要理论基础。
三裂叶漆具有较高的耐盐性,在0 ~0.5%质量分数盐胁迫下能够正常生长。相关研究已经对三裂叶漆在不同盐质量分数下各生理特性发生的变化进行了分析[9]。但迄今有关不同盐胁迫对实生个体基因型筛选及对筛选个体所组成的群体遗传结构影响的研究尚少见报道。基于此,本研究通过设置4个盐质量分数(分别为园土(CK)、0.2%、0.4%、0.6%),对三裂叶漆实生苗群体进行盐胁迫筛选,筛选出耐高质量分数盐胁迫的三裂叶漆实生苗群体,并通过对不同盐质量分数下筛选出的群体进行SSR 标记分析,从DNA 水平分析群体的遗传结构的变化,揭示盐胁迫筛选对三裂叶漆群体遗传结构的影响,证明盐胁迫筛选耐盐基因型的可行性。
1 材料与方法
三裂叶漆(Rhus trilobata)由格林种业从美国引进,试验土壤为天津市大港区盐碱土与河北农业大学标本园土壤混合配制,经盐分测定,天津市大港区盐碱土壤含盐率为1.4%,河北农业大学标本园土壤含盐率为0.06%,按照试验设定的盐分质量分数标本园土(CK)、0.2%、0.4%、0.6%进行配比,将标本园土壤作为对照(CK)。做(长11 m×宽1.4 m×深0.3 m)畦,畦内整体覆以整块厚塑料布,防止盐分渗漏,将配比好的土壤置于畦内,做成不同盐质量分数的4 个畦。种子在播种前用1% Na2CO3浸泡半天后搓洗,再沙藏处理90 ~120 d,2008年春天,进行播种。同时将种子平均分成4 份(每个处理播种一份,每份为600 粒种子),以条播方式播种于试验土壤中,并覆薄膜以保温、保湿。播种后60 d,从不同质量分数盐胁迫下形成的4 个群体中,每个群体30 个个体上采集新鲜叶片,取样30 株,带回实验室低温保存备用,用于DNA 提取,并观测各群体的出苗情况。
DNA 的提取及检测:由于三裂叶漆叶片中含有大量酚类等不利于DNA 提取的物质,在常规的CTAB 法基础上进行了技术改进,即采用先充分碎破组织和细胞,离心去除存在于细胞质中的大量影响DNA 提取质量的多酚类等次生代谢物质,收集细胞核,再行裂解、分离提纯的方法[10-12]。其中经过去除蛋白和色素物质后,在DNA 溶液中加入核糖核酸酶,去除其中存在的RNA。采用1%的琼脂糖凝胶电泳对提取的DNA 进行检测,观察其完整性。
SSR 引物筛选:9 对SSR 引物引自文献[13],采用Ahmad[14]SSR 原始扩增条件进行引物筛选,试验重复2 次。选取条带清晰、带型简单且具稳定多态性的7 对作为本试验的引物。凡是个体中出现无效等位基因扩增或SSR 位点无扩增产物处,PCR 和电泳产物分析再重复1 次。本研究所用的7 对SSR 引物的退火温度均为48 ℃,详细信息见表1。
PCR 及电泳:本试验所采用的PCR 反应体系参照文献[15]、[16],并在此基础上进行优化改动。反应体系为10 ×PCR buffer 1.0 μL,2.5 mM dNTP 0.25 μL,Forward primer (10 mM)0.4 μL,Reverse primer (10 mM)0. 4 μL,Template DNA (5 ng·μL-1)5.0 μL,rTaq DNA 聚合酶(5 U·μL-1)0.2 μL,补充ddH2O 至总体系为10 μL。
PCR 反应程序参照文献[15]、[16],在此基础上有改动,具体程序如下:95 ℃10 min(95 ℃1 min,48℃50 s,72 ℃50 s),35 个循环;72 ℃延伸7 min。
PCR 扩增反应结束后,配制10%非变性聚丙烯酰胺凝胶,取扩增产物1 μL 进行上样电泳,恒压200 V,当指示剂距胶底部1 cm 处停止电泳,剥胶染色。试验中所用标准相对分子质量为SSR(pUC18/MspI)DNA Marker。银染程序参照文献[17]。
对试验结果分别用“1”和“0”记录带的有或无。用POPGENE 1.32 软件计算等位基因频率、等位基因数(A)、有效等位基因数(Ne)、观测等位基因数(Na)、香农指数(Ⅰ)和Nei’s 指数(H)。根据遗传距离用UPGMA(Unweight Pair-group Method using Arithemetic Averages)方法进行聚类分析,并绘制树状图。
2 结果与分析
2.1 盐胁迫对种子发芽的影响
以CK 出苗率为100%,计算每个盐质量分数胁迫下的相对出苗率。在0.2%和0.4%质量分数胁迫下,相对出苗率分别为115%和110%,盐胁迫对种子发芽影响很小;在0.6%质量分数胁迫下,相对出苗率为90%,种子萌发受到一定的抑制。
2.2 SSR 扩增结果
首先用CK 群体的1 ~30 号进行引物筛选,除ptms-7 和ptms -45 不能扩增出条带外,其余7 对引物均能稳定重复地扩增出相应产物。用筛选出的7 对SSR 引物对4 个三裂叶漆群体(CK、0.2%、0.4%、0.6%)进一步扩增,7 对SSR 特异引物共扩增出32 条带,多态性条带为32,多态位点百分率为100%。平均每个引物可扩增出4.6 条带。等位位点的范围在3 ~8 个,引物ptms -10 的等位位点数最多,其中以引物ptms-10 对样品的扩增产物为例,其扩增条带的大小为175 ~450 bp,共有8 个等位位点。图1为SSR 引物ptms-10 对21 个三裂叶漆个体的多态性检测结果。
在所有引物中扩增出3 个等位位点的有2 对引物,片段大小为100 ~350 bp。扩增出4 个位点的有2对引物,片段大小为125 ~200 bp;扩增出5 个等位位点的有2 对引物,片段大小为100 ~400 bp(表2、图1)。
2.3 三裂叶漆群体遗传多样性及遗传分化
根据7 对引物对4 个三裂叶漆群体扩增条带的统计结果,计算了各基因座的多态信息含量、有效等位基因数、香农指数等。从表2可见,7 对引物的有效等位基因数为1.408 0 ~1.566 1,平均有效等位基因数为1.528 6,其中,质量分数为0.6%群体的有效等位基因数最大,对照的最小。多态信息含量和有效等位基因数的大小顺序具有一致性;H 值变化范围为0.252 7 ~0.330 5,变幅为0.077 8,其中,质量分数为0.6%群体的最高,为0.330 5,CK 群体最低,为0.252 7,物种水平H 值为0.319 2;而Ⅰ值变化范围为0.392 0 ~0.494 9,质量分数为0.6%的群体最高,为0.494 9,CK 群体最低,为0.392 0,物种水平Ⅰ值为0.487 3。种群内基因多样性为0.301 5,Nei’s 总基因多样性为0.319 8,表明群体的差异主要来自群体内部,群间遗传差异不大。同时4 个不同质量分数三裂叶漆群体间的遗传分化系数(Gs,t)为0.057 2,群体间基因多样性(Ds,t)为0.096 5,表明4 个群体具有高度的遗传相似性。
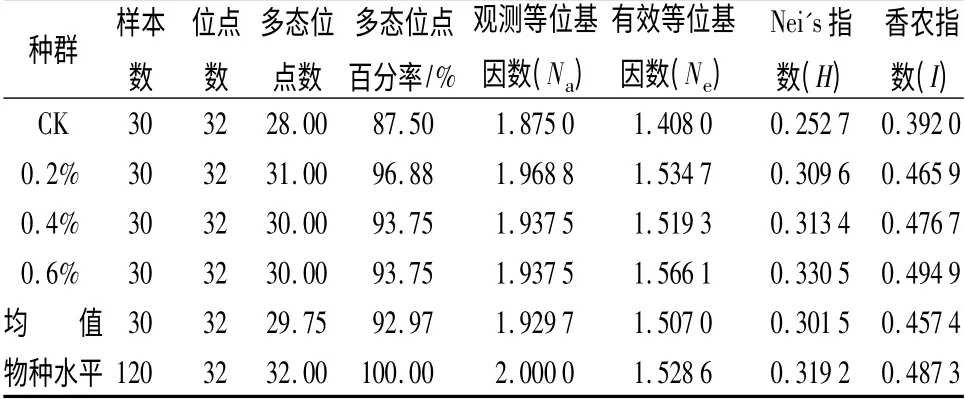
表2 4 个三裂叶漆群体内的遗传多样性
2.4 遗传距离和聚类分析
根据Nei(1978)的方法计算居群的无偏差遗传距离及无偏差遗传一致度。结果表明,4 个群体的遗传一致度为0.027 1 ~0.053 3,其平均值为0.034 9,说明居群间遗传分化程度较小。其中质量分数为0.2%的群体遗传一致度最小,CK 群体的遗传距离最大;为直观地显示4 个三裂叶漆群体之间的相互关系,依据各居群间Nei’s 遗传距离,采用非加权算术平均聚类方法(UPGMA)对4 个三裂叶漆群体进行聚类分析,并绘制树状图(图2)。
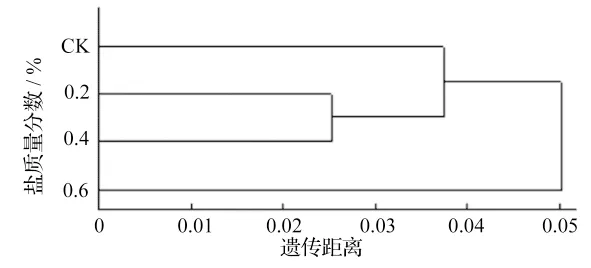
图2 三裂叶漆居群基于遗传距离的聚类图
从树状图可以看出,在遗传相似系数为0. 03处,可以分为三类:CK 群体独自聚为一类;质量分数为0.2%和0.4%的两群体聚为一类;质量分数为0.6%的群体独自聚为一类。
3 结论与讨论
张华新等[18]在盐胁迫下11 个树种生理特性及其耐盐性研究中阐述三裂叶漆属耐盐能力较强树种,但有关三裂叶漆SSR 标记开发应用的报道甚少,且在国内至今尚未见SSR 分子标记应用于盐胁迫筛选出的实生群体遗传多样性分析、分类鉴定等方面的报道。本研究采用7 对SSR 引物对4 个盐胁迫筛选出的三裂叶漆群体进行遗传结构和遗传多样性分析表明,7 对SSR 引物在4 个三裂叶漆群体120个个体的基因组中共得到32 条清晰稳定的电泳条带,每对引物的条带数为3 ~8,平均每对引物包括4.6 个条带,种内多态位点百分率达100%。
三裂叶漆群体的遗传分化系数Gs,t为0.057 2,表明4 个三裂叶漆群体具有高度的遗传相似性。Shannon’s 信息指数和Nei’s 基因多样度分析结果分别表明,4 个群体中,质量分数为0.6%群体的遗传多样性和基因多样性最高,分别为0.330 5、0.494 9,CK群体最低,分别为0.252 7、0.392 0。Shannon’s 信息指数和Nei’s 基因多样度揭示的结果是一致的。
依据各居群间Nei’s 遗传距离,采用非加权算术平均聚类方法(UPGMA)对4 个三裂叶漆群体进行聚类分析,从树状图可以看出,在遗传距离0.03处,可以分为三类:CK 群体独自聚为一类;质量分数为0.2%和0.4%的群体聚为一类;质量分数为0.6%的群体独自聚为一类。质量分数为0.2%、0.4%的两个群体首先聚为一类,然后与CK 群体聚为一类,说明低度盐胁迫筛选的三裂叶漆群体遗传结构发生较小变化,与CK 无盐胁迫筛选的群体遗传关系较近。最后与质量分数为0.6%群体聚合,说明中度盐胁迫筛选的三裂叶漆群体的遗传结构发生了定向的改变,淘汰了不适应的基因型,保留了适应性强的基因型。盐胁迫对三裂叶漆实生苗群体进行筛选后,通过聚类分析可以看出群体的遗传结构和遗传多样性发生了定向变化,筛选出了耐盐基因型,从而为通过盐胁迫筛选培育耐盐品种奠定了重要的理论基础。
[1] 宋丹,张华新,白淑兰,等.植物耐盐种质资源评价及滨海盐碱地引种研究与展望[J].内蒙古林业科技,2006(1):37-38,44.
[2] 宋丹,张华新,耿来林,等.植物耐盐种质资源评价及耐盐生理研究进展[J].世界林业研究,2006,19(3):27 -32.
[3] 刘寅,贾黎明,张博,等.滨海盐碱地绿化植物筛选及耐盐性评价研究进展[J].西南林业大学学报,2011,31(3):80 -85.
[4] 杨升,张华新,张丽.植物耐盐生理生化指标及耐盐植物筛选综述[J].西北林学院学报,2010,25(3):59 -65.
[5] 杨升,张华新,刘涛.16 个树种盐胁迫下的生长表现和生理特性[J].浙江农林大学学报,2012,29(5):744 -754.
[6] 乔慧萍,李建设,雍立华,等.植物盐胁迫生理及其适应性调控机制的研究进展[J].宁夏农林科技,2007(3):34 -36.
[7] 尹建道,孙仲序,王玉祥,等.转抗盐碱基因八里庄杨大田释放试验[J].东北林业大学学报,2004,32(3):23 -25.
[8] 杨春霞,李火根,程强,等.南林895 杨抗旱耐盐基因DREB1C的转化[J].林业科学,2009,45(2):17 -21.
[9] 宋丹.几个引进树种幼苗耐盐特性及耐盐性评价研究[D].呼和浩特:内蒙古农业大学,2006.
[10] Doyle J J,Doyle J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochem Bull,1987,19:11-15.
[11] 潘晓华,黄儒珠,朱锦懋. 樟树总DNA 提取技术的研究[J].福建林业科技,2004,31(1):33 -35,43.
[12] 王经源,郭明亮,林文雄,等. 高多糖含量植物:莲DNA 的提取方法[J].福建稻麦科技,2004,22(1):8 -9.
[13] 吴志庄.木本能源植物黄连木单株选择、类型划分与群落调查研究[D].北京:中国林业科学研究院,2008:41 -45.
[14] Ahmad R. Molecular marker analyses of pistachio rootstocks by simple sequence repeatsand sequence-Related amplified polymorphisms[J]. The journal of horticultural science&biotechnology,2005,80(3):382 -386.
[15] Silfverberg-Dilworth E,Matasci C L,Van de Weg W E,et al.Microsatellite markers spanning the apple (Malus × domestica Borkh.)genome[J]. Tree Genetics & Genomes,2006,2:202 -224.
[16] Gianfranceschi L,Seglias N,Tarchini R,et al. Simple sequence repeats for the genetic analysis of apple[J]. Theor Appl Genet,1998,96:1069 -1076.
[17] Rajora O P,Rahman M H,Buchert G P,et al. Microsatellite DNA analysis of genetic effects of harvesting in old-growth eastern white pine (Pinus strobus)in Ontario[J]. Mol Ecol,2000,9(3):339 -348.
[18] 张华新,宋丹,刘正祥. 盐胁迫下11 个树种生理特性及其耐盐性研究[J].林业科学研究,2008,21(2):168 -175.

