阿托伐他汀通过抑制RhoA活性减少非小细胞肺癌的增殖
刘 冰,阳 洁 (.广东药学院药科学院药理系,广东 广州 50006;.广西医科大学药学院药理学教研室,广西 南宁5300)
肺癌中80%为非小细胞肺癌(non-small cell lung carcinomas,NSCLCs),早期诊断率极低,大多数患者确诊时已属晚期或发生转移,失去手术治疗的机会,需要化学药物治疗[1]。近年的研究表明,他汀类还能显著抑制前列腺癌、乳腺癌、胃癌、食管癌等多种肿瘤细胞增殖和促进肿瘤细胞凋亡[2-3]。但阿托伐他汀(ATV)能否影响NSCLCs的增殖仍不清楚。本实验旨在研究阿托伐他汀对三株NSCLCs细胞(A549细胞、H358细胞、Calu3细胞)增殖的影响及其可能的作用机制,为NSCLCs的临床治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 主要试剂 阿托伐他汀,DMEM、胎牛血清,青霉素、链霉素、噻唑蓝、二甲基亚砜,RhoA siRNA、control siRNA、单克隆抗RhoA抗体、辣根过氧化物酶标记的抗兔抗体、β-actin抗体,Lipofectamine 2000,RhoA特异性抑制剂 C3 transferase,增强化学发光检测试剂盒,Rho-GTP亲和力测试板。
1.1.2 NSCLCs细胞株 A549 细胞、H358 细胞、Calu3 细胞用含10%胎牛血清及0.1%青霉素/链霉素的DMEM培养基,于37℃、5%CO2培养箱中常规培养、传代。
1.2 方法
1.2.1 细胞增殖实验 采用改进的MTT法测定细胞增殖情况[4]。取对数生长期的 A549细胞、H358细胞、Calu3细胞,用无血清DMEM重悬后,以5×105/mL接种于96孔板,每孔100 μl,细胞培养过夜,待细胞贴壁后,用不同浓度的阿托伐他汀和RhoA siRNA、control siRNA、RhoA特异性抑制剂(RhoA inhibitor)C3 transferase处理细胞,同时设置阴性对照组(细胞不加药物处理)、空白对照组(无细胞、仅加无血清DMEM),各组均设3个复孔,72 h后,每孔加入5 mg/mL的噻唑蓝20 μl,培养4 h后终止培养,吸去孔内培养液,每孔加入150 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,用酶标仪在波长570 nm处测量各孔的吸光值(OD)。实验重复3次。细胞的相对增殖率(%)=(OD处理组-空白对照组)/(OD阴性对照组-空白对照组)×100%。
1.2.2 siRNA转染 三株细胞常规培养至50% ~70%以上融合时进行转染。RhoA siRNA、control siRNA转染采用Lipofectamine2000转染试剂进行[5],细胞孵育过夜后,再培养48 h。同时设置空脂质体组,每组设3个复孔,实验重复3次。用Western blotting检测RhoA的蛋白表达,观察 siRNA的干扰效果。
1.2.3 Western blotting 根据文献[6]的方法,裂解细胞、提取总蛋白并测定浓度,SDS-PAGE凝胶电泳,转移到硝酸纤维素膜,在含5%脱脂奶粉的TBST中封闭30 min,单克隆抗RhoA抗体(1∶2 000)4℃孵育过夜,TBST洗膜,辣根过氧化物酶标记的抗兔抗体(1∶1 000)室温孵育1 h,TBST洗膜后,用增强化学发光检测试剂盒显色,凝胶成像仪扫描并分析图像。实验重复3次。
1.2.4 RhoA 活性测定 采用 Sterpetti的方法[7],收集细胞膜提取物25 μg,在Rho-GTP亲和力测试板上孵育45 min,再与抗体检测试剂孵育2 h,酶标仪测定发光信号,观察RhoA活性的变化,实验重复3次。
1.3 统计学分析
2 结果
2.1 ATV对NSCLCs细胞增殖的影响
与未处理组(control)相比,0.1%DMSO溶剂对照组对三株NSCLCs细胞的增殖无明显影响(P>0.05);与DMSO溶剂对照组比较,0.1~25.0 μmol/L 的 ATV 能明显抑制三株 NSCLCs细胞增殖,且呈浓度依赖性(P<0.05或P<0.01),见图1。
2.2 ATV对NSCLCs细胞RhoA活性的影响
与未处理组(control)相比,0.1%DMSO溶剂对照组对三株NSCLCs细胞的 RhoA 活性无明显影响(P >0.05);0.1~25.0 μmol/L的ATV处理细胞48 h后,能明显抑制A549细胞、H358细胞的 RhoA 活性,0.5~25.0 μmol/L的 ATV 能明显抑制Calu3细胞的 RhoA活性,均呈浓度依赖性(P<0.05或P <0.01),见图2A。此外,2.5 μmol/L ATV 能持续地抑制三株细胞的 RhoA活性至96 h,且均呈时间依赖性(P<0.05或P <0.01),但2.5 μmol/L ATV 在处理 Calu3 细胞细胞 48 h后才明显抑制细胞的RhoA活性,并持续抑制到96 h(P<0.05或P <0.01),见图2B。
2.3 RhoA特异性抑制剂对NSCLCs细胞增殖的影响
与未处理组(control)比较,用1 g/mL的RhoA特异性抑制剂C3 transferase预处理细胞1 h后,能使A549细胞、H358细胞、Calu3细胞的RhoA活性分别显著下降70.79%(P<0.01)、79.60%(P <0.01)、77.75%(P <0.01),见图3A。与未处理组(control)比较,单用 2.5 μmol/L ATV、单用 10.0 μmol/L ATV、单用1 g/mL的RhoA特异性抑制剂C3 transferase、合用1 g/mL C3 transferase+2.5 μmol/L ATV、合用 1 g/mL C3 transferase+10.0 μmol/L ATV等5个组均能明显抑制A549细胞、H358细胞、Calu3细胞增殖(P<0.01)。但是,与单用1 g/mL的RhoA特异性抑制剂C3 transferase组比较,合用1 g/mL C3 transferase+2.5 μmol/L ATV、合用 1 g/ml C3 transferase+10.0 μmol/L ATV两个组均无显著差异(P>0.05),见图3B。

图1 ATV对NSCLCs细胞增殖的影响

图2 ATV对NSCLCs细胞RhoA活性的影响
2.4 RhoA siRNA对NSCLCs细胞增殖的影响
各组间β-actin表达无显著差异(P>0.05),表明各组间蛋白的上样量基本一致。与未转染组比较,A549细胞、H358细胞、Calu3细胞被转染control siRNA后,三株细胞内RhoA表达无显著变化(P>0.05);但细胞被转染RhoA siRNA后,RhoA蛋白的表达明显下降,其抑制率分别为(76.23±8.05)%、(73.83±6.04)%、(77.97 ±10.98)%,表明转染 RhoA siRNA 能有效沉默三株NSCLCc细胞的RhoA蛋白表达,见图4A。与未转染组(control)比较,转染control siRNA组的细胞增殖无显著变化(P >0.05);转染 control siRNA 并合用 2.5 μmol/L ATV 组、转染 control siRNA 并合用10.0 μmol/L ATV 组、转染RhoA siRNA组、转染 RhoA siRNA 并合用2.5 μmol/L ATV 组、转染 RhoA siRNA并合用10.0 μmol/L ATV组均能显著抑制三株细胞增殖(P <0.01)。但是,与仅转染RhoAsiRNA组比较,转染RhoA siRNA并合用2.5 μmol/L ATV组、转染 RhoA siRNA并合用10.0 μmol/L ATV 组均无显著差异(P >0.05),见图 4B。

图3 RhoA特异性抑制剂对NSCLCs细胞增殖的影响
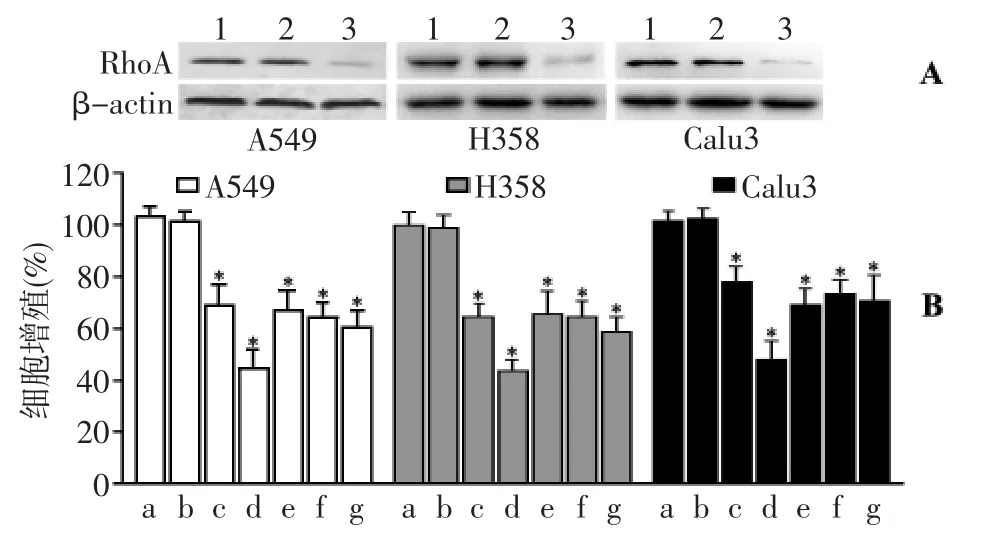
图4 RhoA siRNA对NSCLCs细胞增殖的影响
3 讨论
近年来发现,他汀类药物还对肿瘤细胞具有抑制增殖、诱导分化或凋亡、抑制血管生成及降低侵袭转移能力等作用[8]。ATV对乳腺癌、膀胱癌、胰腺癌、结肠癌、前列腺癌等肿瘤细胞增殖均有显著抑制作用[9],是一种很有潜力的抗肿瘤药物。
RhoA属于GTP/GDP结合GTP酶的Ras超家族,已被证明在促进肿瘤细胞的增殖和凋亡中发挥重要作用[10]。RhoA在多种肿瘤细胞中过度表达和过度激活[11]。过度活化的RhoA能触发后续的PI3K-Akt通路的激活,而该通路被认为是调节细胞生成及细胞增殖的关键通路[12]。Fromigue 等[13]研究发现,高剂量的ATV(10 μmol/L)可有效抑制RhoA介导的基质金属蛋白酶的激活,从而抑制骨肉瘤细胞生长和侵袭。然而,ATV能否影响 NSCLCs细胞的 RhoA活性以及RhoA激活是否与NSCLCs细胞增殖有关仍不清楚。本研究中,ATV呈浓度依赖性地显著抑制NSCLCs细胞增殖,并且呈浓度依赖性和时间依赖性地显著抑制NSCLCs细胞的RhoA活性。用RhoA特异性抑制剂C3 transferase降低RhoA活性会明显抑制NSCLCs细胞增殖。我们进一步用RhoA siRNA转染NSCLCs细胞,证实在有效沉默RhoA蛋白表达后,也会明显抑制NSCLCs细胞增殖。该结果提示,ATV能有效地抑制NSCLCs细胞增殖,其机制与其降低 NSCLCs细胞的RhoA活性密切相关。
此外,本研究发现,用 RhoA特异性抑制剂C3 transferase或RhoA siRNA抑制RhoA活性时,联合应用ATV不能产生抑制NSCLCs细胞增殖的协同效应,而是与单用RhoA特异性抑制剂C3 transferase或RhoA siRNA的作用相似。这提示,在RhoA活性被抑制后,ATV不能抑制NSCLCs细胞增殖。如果ATV抑制NSCLCs细胞增殖不是通过抑制RhoA活性而产生,那么在RhoA活性被抑制后,ATV还应发挥本身对NSCLCs细胞增殖的抑制作用。相似结果在其他文献中也有报道,如Wang等研究发现[14],重组的人肝细胞生长因子(rh-HGF)能促进骨肉瘤细胞生存从而抵消顺铂的治疗作用,用抗HGF中和抗体治疗能明显增强顺铂的细胞毒性,但用Akt siRNA阻断Akt表达时,rh-HGF和抗HGF的中和抗体对顺铂的细胞毒性仅为微弱作用或无作用。因此Wang等认为rh-HGF和抗HGF中和抗体对顺铂疗效的影响主要是依赖于对PI3K-Akt通路的抑制。本研究的上述结果也证实了此观点。因此,本文认为,RhoA激活与NSCLCs细胞增殖密切相关,ATV主要依赖于抑制RhoA活性从而减少NSCLCs细胞增殖。这提示,ATV可能作为一种有潜力的抗肿瘤药物用于NSCLCs的治疗,但其具体的作用机制和信号途径仍需进一步阐明。
[1]Pao W,Chmielecki J.Rational,bologically based treatment of EGFR-mutant non-small-cell lung cancer[J].Nat Rev Cancer,2010,10(11):760-774.
[2]Hoque A,Chen H,Xu XC.Statin induces apoptosis and cell growth arrest in prostate cancer cells[J].Cancer Epidemiol Biomarkers Prev,2008,17(1):88-94.
[3]Kotamraju S,Williams CL,Kalyanaraman B.Statin-induced breast cancer cell death:role of inducible nitric oxide and arginase-dependent pathways[J].Cancer Res,2007,67(15):7386-7394.
[4]Kim WH,Chon CY,Moon YM,et al.Effect of anticancer drugs and desferrioxamine in combination with radiation on hepatoma cell lines[J].Yonsei Med J,1993,34(1):45-56.
[5]Chen J,Hou J,Zhang J,et al.Atorvastatin synergizes with IFN-gamma in treating human non-small cell lung carcinomas via potent inhibition of RhoA activity[J].Eur J Pharmacol,2012,682(1-3):161-170.
[6]Liu B,Wang G,Yang J,et al.Berberine inhibits human hepatoma cell invasion without cytotoxicity in healthy hepatocytes[J].PLoS One,2011,6(6):e21416.
[7]Sterpetti P,Hack AA,Bashar MP,et al.Activation of the Lbc Rho exchange factor proto-oncogene by truncation of an extended C terminus that regulates transformation and targeting[J].Mol Cell Biol,1999,19(5):1334-1345.
[8] Miraglia E,Hogberg J,Stenius U.Statins exhibit anticancer effects through modifications of the pAkt signaling pathway[J].Int J Oncol,2012,40(3):867-875.
[9]Parada B,Reis F,Pinto A,et al.Chemopreventive Efficacy of Atorvastatin against Nitrosamine-Induced Rat Bladder Cancer:Antioxidant,Anti-Proliferative and Anti-Inflammatory Properties[J].Int J Mol Sci,2012,13(7):8482-8499.
[10]Aznar S,Lacal JC.Rho signals to cell growth and apoptosis[J].Cancer Lett,2001,165(1):1-10.
[11]Touge H,Chikumi H,Igishi T,et al.Diverse activation states of RhoA in human lung cancer cells:contribution of G protein coupled receptors[J].Int J Oncol,2007,30(3):709-715.
[12]Denoyelle C,Albanese P,Uzan G,et al.Molecular mechanism of the anti-cancer activity of cerivastatin,an inhibitor of HMG-CoA reductase,on aggressive human breast cancer cells[J].Cell Signal,2003,15(3):327-338.
[13]Fromigue O,Hamidouche Z,Marie PJ.Blockade of the RhoA-JNK-c-Jun-MMP2 cascade by atorvastatin reduces osteosarcoma cell invasion[J].J Biol Chem,2008,283(45):30549-30556.
[14]Wang K,Zhuang Y,Liu C,et al.Inhibition of c-Met activation sensitizes osteosarcoma cells to cisplatin via suppression of the PI3K-Akt signaling[J].Arch Biochem Biophys,2012,526(1):38-43.