酶联免疫吸附法检测动物源性食品中氨苯砜残留
陶光灿, 李 勇, 崔廷婷, 王 娇, 扶 胜
(北京勤邦生物技术有限公司,北京 102206)
氨苯砜(dapsone,DDS)为砜类抑菌剂,对麻风杆菌有较强的抑菌作用,大剂量使用时显示杀菌作用[1]。由于其作用机制与磺胺类药物相似,两者具有协同增效作用,在动物和水产养殖中常作为磺胺增效剂使用[2]。然而氨苯砜毒性较大,可引起血液系统反应,如高铁血红蛋白血症和溶血性贫血,还可能出现肝肾功能损害和精神障碍[1,3],因此我国农业部235号公告明确规定禁止在所有食品动物中使用,且在动物性食品中不得检出[4];欧盟2377/90也明确规定氨苯砜为禁用药物[2]。
目前,国内外关于食品中氨苯砜残留检测的报道较少,且多与磺胺类药物同时检测,方法主要为高效液相色谱法[5-6]和液质联用法[2,7-8],仪器方法可以精确地进行定量分析,但设备昂贵、操作复杂、对样品纯度要求较高、检测成本高、周期长,只能用于小批量样本抽检,无法满足食品安全检测中对大批量样本现场快速筛查的需要[9]。而酶联免疫吸附技术(ELISA)具有特异性高、敏感性强、快速方便、不需要昂贵仪器设备、检测成本低、适合于大批量样品的检测等优点,已在农兽药残留及微量毒素检测中被广泛应用,但目前尚未见该技术在动物源性食品中氨苯砜残留检测中应用的报道。因此,作者在利用合成的氨苯砜人工抗原,通过细胞融合技术制备出DDS单克隆抗体的基础上,建立了动物源性食品中氨苯砜残留的间接竞争酶联免疫吸附法,为商品化试剂盒的研制打下基础。
1 材料与方法
1.1 材料与试剂
氨苯砜(纯度≥99%)、琥珀酸酐、吡啶、二甲基亚砜、碳化二亚胺、N,N-二甲基甲酰胺、牛血清白蛋白(BSA)、卵清蛋白(OVA):Sigma公司产品;其他常规化学试剂均为分析纯:北京化学试剂公司产品;复溶工作液:pH 7.6,含质量分数8%~12%酪蛋白、0.1~0.3 mol/L的磷酸盐缓冲液。
1.2 仪器与设备
8010S匀浆机:上海斯伯明仪器设备有限公司产品;2000SBL电子天平:美国Setra公司产品;KS-Ⅱ振荡器:上海跃进医疗器械厂产品;QL-901漩涡混合器:海门市其林贝尔仪器制造有限公司产品;Anke TDL-40B低速离心机:上海安亭科学仪器有限公司产品;DSY-Ⅲ氮吹仪:北京金科精华苑科技有限公司产品;微量移液器(单道 20~200 μL、100~1 000 μL,多道 20~300 μL):美国 Thermo 公司产品;DHP-600生化培养箱:天津市中环实验电炉有限公司产品;MK3酶标仪:美国Thermo公司产品。
1.3 方法
1.3.1 氨苯砜半抗原的合成 0.50 g氨苯砜、0.40 g琥珀酸酐和2 mL吡啶在10 mL二甲基亚砜中混合,在60℃下搅拌反应10 h,蒸除溶剂,柱层析后在乙醇-水体系中重结晶得到氨苯砜单琥珀酸酰胺,即为氨苯砜半抗原。
1.3.2 氨苯砜人工抗原的制备及鉴定
1)氨苯砜免疫原的制备 取氨苯砜半抗原12 mg用1.5 mL N,N-二甲基甲酰胺溶解,得到溶液Ⅰ;取质量分数50%的戊二醛10 μL加入溶液Ⅰ中,室温下搅拌反应18 h,得到溶液Ⅱ;取牛血清白蛋白60 mg用4.5 mL水稀释后加入溶液Ⅱ中,反应过夜后加入24 mg NaBH4反应3 h,用三蒸水透析48 h,即得氨苯砜免疫原。
2)氨苯砜包被原的制备 取碳化二亚胺50 mg用2 mL水使之充分溶解,得到溶液A;取氨苯砜半抗原13 mg用1 mL N,N-二甲基甲酰胺溶解,得到溶液B;取卵清蛋白30 mg溶于2 mL 0.01 mol/L PBS(pH=8.0)溶液中,得到溶液C;将B液与C液混合,在磁力搅拌下逐滴加入A液中,室温下搅拌反应24 h,用三蒸水透析48 h,即得氨苯砜包被原。
3)人工抗原的鉴定及偶联比测定 采用TNBS方法[10]初步鉴定了人工抗原的合成情况,并测定了氨苯砜半抗原与牛血清白蛋白和卵清蛋白的偶联比。
1.3.3 单克隆抗体的制备 用150 μg的氨苯砜免疫原与等量弗氏完全佐剂(FCA)混合制成乳化剂,颈背部皮下多点注射。二免和三免时,将FCA换成弗氏不完全佐剂(FIA),剂量和方法同上,每次免疫间隔时间为2周,三免后第7 d,小鼠尾部静脉采血,室温静置1 h,4℃过夜,12 000 r/min离心10 min,收集血清,4℃保存,用间接ELISA法测定血清效价,待效价较高时,按照150 μg/只的剂量腹腔注射加强免疫。3 d后取小鼠脾脏进行细胞融合,以有限稀释法筛选阳性克隆,并按照常规方法制备腹水抗体[11],用饱和硫酸铵法纯化后备用。
1.3.4 酶联免疫方法的建立
1)抗原抗体最佳工作浓度的确定 采用方阵滴定法确定包被抗原 (氨苯砜半抗原-卵清蛋白偶联物)与单克隆抗体的最佳工作浓度。每孔加入100 μL最佳工作浓度的包被原包被酶标板,37℃温育2 h;倾去包被液,经PBST洗涤液洗涤3次,用封闭液37℃条件下封闭2 h,洗涤3次,干燥备用。向包被有包被原的酶标板微孔中加入氨苯砜标准品溶液50 μL,随机加入辣根过氧化物酶标记的羊抗鼠抗抗体溶液50 μL,再加入最佳工作浓度的单克隆抗体溶液 50 μL,用盖板膜封板,25℃反应 30 min,用洗涤液洗涤4~5次。每孔再加入底物液A液(过氧化脲)和 B 液(四甲基联苯胺)各 50 μL/孔,25 ℃显色 15 min后每孔加入 50 μL 2 mol/L H2SO4终止液,设定酶标仪于450 nm处测定每孔吸光度值。
2)标准曲线的制作 采用间接竞争ELISA方法建立标准曲线,分别选择标准品质量浓度0、0.1、0.3、0.9、2.7、8.1 μg/L,以质量浓度为 0 μg/L 时的OD值为B0值,其它浓度氨苯砜标准品的OD值为B值,以百分吸光度值(B/B0)为纵坐标,标准品浓度的对数值为横坐标,绘制标准曲线。
1.3.5 样本前处理方法的建立
1)鸡肉、猪肉前处理方法 称取(2.0±0.05)g样本至50 mL聚苯乙烯离心管中,加入7.5 mL乙腈和 0.5 mL 水,振荡 2 min,4 000 r/min 室温(20~25℃)离心5 min;取出2 mL上层有机相至10 mL干净的玻璃试管中,50℃下氮气吹干或旋转蒸发仪蒸干;加入1 mL正己烷,涡动30 s,再加入1 mL复溶工作液,涡动 30 s;室温(20~25 ℃)4 000 r/min 离心5 min;除去上层有机相,取下层50 μL用于分析。
2)鸡蛋、蜂蜜前处理方法 称取(1.0±0.05)g样本至10 mL离心管中;加入4 mL去离子水,振荡30 s,取上层清液200 μL加入600 μL复溶工作液混匀;取50 μL用于分析。
3)牛奶前处理方法 取100 μL样本至2 mL离心管,加入 500 μL 复溶工作液,混匀;取 50 μL用于分析。
1.3.6 酶联免疫方法技术参数的确定
1)样本检测限试验 取空白样本20份,按1.3.4所述方法前处理后进行ELISA检测,从标准曲线上查出对应于各百分吸光度值的氨苯砜浓度,以20份样本的质量分数平均值()和标准差(S)表示检测限(MDL),即 MDL=+3S。
2)准确度和精密度试验 以3个不同质量分数的氨苯砜标准品分别对空白鸡肉、猪肉、鸡蛋、蜂蜜、牛奶样本进行添加回收试验,计算回收率和变异系数。

式中:CX为添加了一定氨苯砜的样本经过标准曲线分析得到的实际质量分数,μg/kg;C0为空白样本经过标准曲线分析得到的实际质量分数,μg/kg;C为实际添加的氨苯砜质量分数,μg/kg。
3)稳定性试验 将酶联免疫方法相关的试剂组装成试剂盒后,取足量保存于37℃环境中,每隔1 d取出适量,分别测定零标准品的OD值、半数抑制浓度(IC50),及按2)所述方法进行添加回收试验所测得的回收率,直到试剂盒的灵敏度和回收率开始下降为止,根据试验结果判断试剂盒的稳定性。
4)可靠性试验 随机抽取鸡肉、猪肉、鸡蛋、蜂蜜、牛奶样本各20份,用本方法与标准方法《SN/T 2219—2008进出口动物源性食品中氨苯砜及其代谢产物残留量检测方法 液相色谱-质谱/质谱法》(对鸡肉、猪肉、鸡蛋和牛奶中氨苯砜的测定低限为0.5 μg/kg)[12]和《GB/T 22940—2008 蜂蜜中氨苯砜残留量的测定 液相色谱-串联质谱法》(方法检出限为2.0 μg/kg)[13]分别对其进行检测,根据试验结果验证ELISA方法检测实际样本的有效性。
2 结果与分析
2.1 氨苯砜半抗原与载体蛋白偶联比的测定
通过TNBS法证明偶联反应是成功的,并测得半抗原与BSA的偶联结合比为10.45∶1,与OVA的偶联结合比为7.28∶1。TNBS能特异性地与蛋白质分子上的自由氨基结合,专一性比较强,对仪器要求更低,操作也较简单。
2.2 最佳工作质量浓度的选择
方阵法测定不同包被原和单克隆抗体的间接竞争抑制ELISA测定结果 (A450nm值)见表1。在ELISA包被过程中,包被效果与浓度呈正相关,但浓度过高,不仅浪费试剂,而且会降低待测物的竞争能力,从而影响曲线灵敏度[14]。考虑到酶标仪测定OD450nm值的敏感范围在1.00左右,为了既保证测定结果的灵敏可靠,又减少抗原的用量,试验应选择的最适包被原稀释倍数为1∶40 000,最佳抗体稀释倍数为 1∶100 000。
2.3 标准曲线的建立
根据建议的间接竞争ELISA方法,选择氨苯砜标准品质量浓度 0、0.1、0.3、0.9、2.7、8.1 μg/L, 以百分吸光度值(B/B0)为纵坐标(Y),标准品质量浓度的对数值为横坐标(X)绘制标准曲线如图1。以lg(B/B0)为纵坐标,标准品浓度的对数值为横坐标,将图1转换后可知,在0.1~8.1 μg/L质量浓度范围内,lg(B/B0)与氨苯砜浓度对数呈现良好的线性关系(图 2), 得回归方程 Y=-2.492 6X-0.982 4,R2=0.995 6,IC50为 0.369 μg/L。

图1 氨苯砜的标准曲线Fig.1 Calibration curve of dapsone by ELISA

图2 氨苯砜的检测标准曲线Fig.2 Calibration curve for detection of dapsone by ELISA
2.4 样本检测限
一定条件下,ELISA方法检测限(MDL)符合正态分布的规律[15],因此用20个空白样本通过ELISA测定的光密度在标准曲线上对应的氨苯砜浓度的平均值()和标准差(S)来表示,即 MDL=+3S,结果见表2。综合考虑几种样本的检测限数据,得本方法对鸡肉、猪肉样本的检测限为0.2 μg/kg,对鸡蛋、蜂蜜样本的检测限为2 μg/kg,对牛奶样本的检测限为 0.6 μg/L。

表2 酶联免疫方法对不同样本的检测限Table 2 Detection limit for different samples of ELISA
2.5 准确度和精密度
ELISA测定的准确度以回收率表示,精密度以变异系数表示。取空白鸡肉、猪肉、鸡蛋、蜂蜜、牛奶样本,按表3所述的氨苯砜添加质量分数对其进行添加回收试验,每个质量分数做5个平行,用3个批次的产品测定,分别计算回收率和批内、批间变异系数,结果见表3。
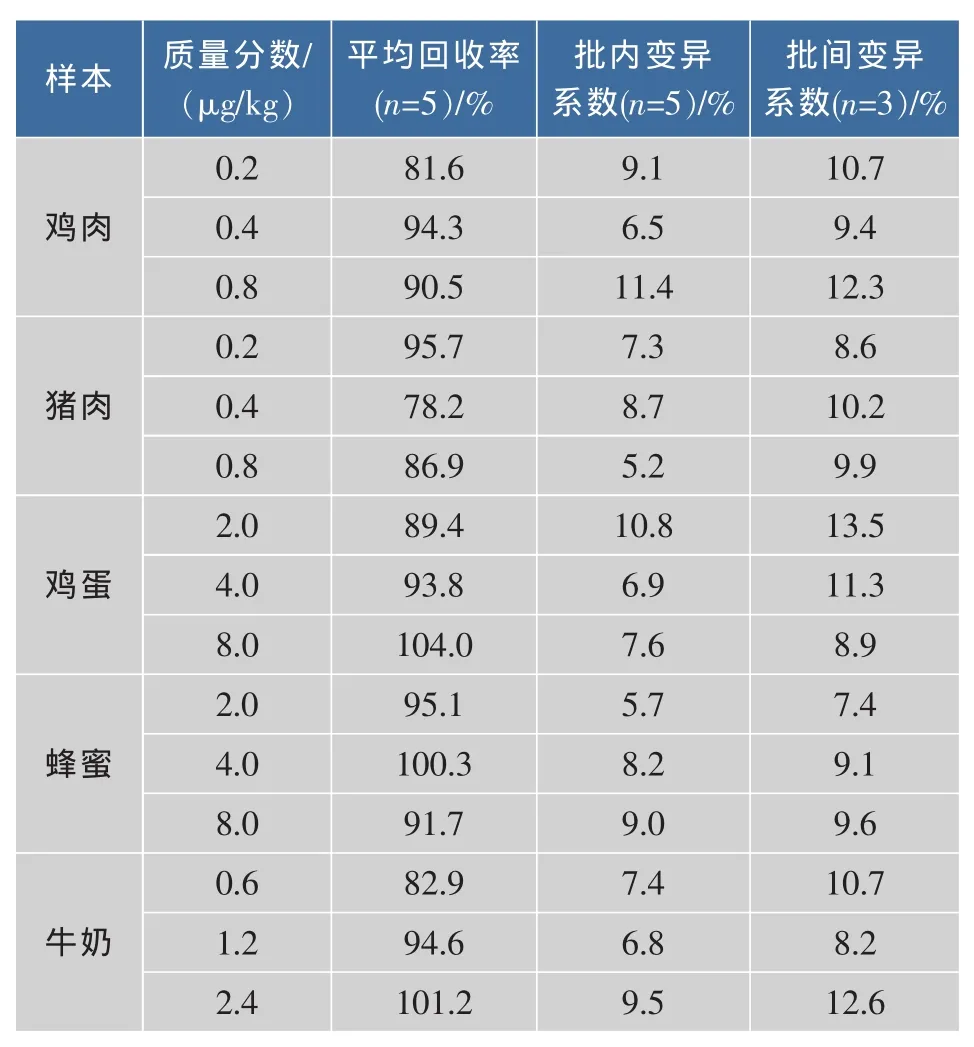
表3 酶联免疫方法的准确度和精密度Table 3 Accuracy and precision of ELISA
由表3可知,以3个不同质量分数的氨苯砜标准品对空白鸡肉、猪肉、鸡蛋、蜂蜜、牛奶样本进行添加,其加标回收率范围为78.2%~104.0%,说明方法准确度较好;批内变异系数范围为5.2%~11.4%,批间变异系数范围为7.4%~13.5%,均小于15%,说明方法精密度(重复性)较好。
2.6 稳定性试验
将ELISA方法涉及到的各种试剂组装成试剂盒后在37℃条件下存放,每隔1 d取出,测定灵敏度和回收率等参数,结果见表4。经测定,该试剂盒能在37℃条件下稳定保存9 d,第10 d开始各项参数下降。根据生化试剂在37℃每稳定1 d,相当于4~10℃保存一个半月[16],可知,试剂盒可在4℃下至少稳定保存12个月。

表4 酶联免疫试剂盒稳定性测定Table 4 Stability of the ELISA kit
2.7 可靠性验证
通过ELISA方法和仪器方法对随机抽取的鸡肉、猪肉、鸡蛋、蜂蜜、牛奶样本进行测定,鸡肉、猪肉样本的阳性判定线为0.5 μg/kg,鸡蛋、蜂蜜样本的阳性判定线为2 μg/kg,牛奶样本的阳性判定线为0.6 μg/L,结果筛选出7份阳性样本,比较结果见表5。

表5 ELISA法和LC-MS/MS法检测结果比较Table 5 Comparison determination results of ELISA with LC-MS/MS
由表5可知,用ELISA法和LC-MS/MS法的测定结果基本一致,符合度达到100%,适用于动物源性食品中氨苯砜残留的筛选。
3 结语
氨苯砜(DDS)为小分子物质,不具备免疫原性,只有反应原性,因此需要与一大分子物质共价结合后才能使动物免疫系统识别,产生相应的抗体。合成免疫抗原通常采用小分子物质与载体蛋白直接偶联的方法,但是由于DDS相对分子质量较小,含有的可反应基团较少,使与载体蛋白偶联上的可能性大大降低;同时其结构简单,与载体蛋白偶联后由于缺少间接臂,可能影响DDS与抗体的特异性识别。因此,本研究先对DDS小分子物质进行结构改造,在保留其基本结构特征的基础上引入一定长度的间接臂,然后再与蛋白偶联,可以制备得到较高偶联比的人工抗原,在免疫时更易诱发产生特异性抗体。
目前,用高效液相色谱法、液相色谱-质谱联用法检测食品中氨苯砜的定量下限多在0.12~5 μg/kg。作者建立的检测方法的半数抑制浓度 (IC50)为0.369 μg/L,对鸡肉、猪肉样本的检测限为0.2 μg/kg,对鸡蛋、蜂蜜样本的检测限为2 μg/kg,对牛奶样本的检测限为0.6 μg/L,与仪器方法相比,灵敏度较低。但由于ELISA方法对仪器、样品纯度和技术人员的要求不高,操作简便,检测时间短(45 min)、成本低,适合于大量样本中氨苯砜残留检测的快速筛选,能够更好地满足我国基层检测单位、政府职能监管部门等开展检测工作,具有较好的应用前景。
[1]廉佳,张峻岭,卢桂玲.羟氯喹、氨苯砜、沙利度胺在皮肤科的应用[J].中国皮肤性病学杂志,2007,21(10):632-633.LIAN Jia,ZHANG Jun-ling,LU Gui-ling.Hydroxychloroquine,dapsone and thalidomide applications in dermatology[J].The Chinese Journal of Dermatovenereology,2007,21(10):632-633.
[2]田云,岳振峰,叶卫翔,等.动物组织中氨苯砜及其代谢产物残留量的液相色谱串联质谱法测定[J].分析测试学报,2009,28(1):88-92.TIAN Yun,YUE Zhen-feng,YE Wei-xiang,et al.Determination of dapsone and its metabolite residue in animal tissue by liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis,2009,28(1):88-92.(in Chinese)
[3]Coleman M D.Dapsone toxicity:some current perspectives[J].General Pharmacology:The Vascular System,1995,26(7):1461-1467.
[4]中华人民共和国农业部.中华人民共和国农业部第235号公告[B].北京,2002.
[5]Hela W,Brandtner M,Widek R,et al.Determination of sulfonamides in animal tissues using cation exchange reversed phase sorbent for sample cleanup and HPLC-DAD for detection[J].Food Chemistry,2003,83(4):601-608.
[6]Suhren G,Heeschen W.Detection of eight sulphonamides and dapsone in milk by a liquid chromatographic method[J].Analytica Chimica Acta,1993,275(1-2):329-333.
[7]Hadjigeorgiou M,Papachrysostomou C H,Theodorou Z,et al.Determination of dapsone in meat and milk by liquid chromatography tandem mass spectrometry[J].Analytica Chimica Acta,2009,637(1-2):220-224.
[8]Vanrhijn J A,Lasaroms J J P,Berendsen B J A,et al.Liquid chromatographic-tandem mass spectrometric determination of selected sulphonamides in milk[J].Journal of Chromatography A,2002,960(1-2):121-133.
[9]涂顺,裘雪梅,谢少霞,等.苏丹红Ⅰ酶联免疫吸附检测方法的建立[J].食品与生物技术学报,2009,28(6):791-794.TU Shun,QIU Xue-mei,XIE Shao-xia,et al.Enzyme linked immunosorbent assay for the detection of sudanⅠ [J].Journal of Food Science and Biotechnology,2009,28(6):791-794.(in Chinese)
[10]李颖.苦豆子生物碱间接竞争酶联免疫分析方法(IC-ELISA)初步研究[D].杨凌:西北农林科技大学,2012.
[11]杨利国,胡永昶,魏平华,等.酶免疫测定技术[M].南京:南京大学出版社,1998.
[12]中华人民共和国深圳出入境检验检疫局,中华人民共和国重庆出入境检验检疫局,中华人民共和国安徽出入境检验检疫局.SN/T 2219-2008进出口动物源性食品中氨苯砜及其代谢物残留量的检测方法 液相色谱-质谱/质谱法[M].北京:中国标准出版社,2009.
[13]中华人民共和国秦皇岛出入境检验检疫局.GB/T 22940-2008蜂蜜中氨苯砜残留量的测定 液相色谱-串联质谱法 [M].北京:中国标准出版社,2009.
[14]余鹏敏.丙草胺和乙草胺的酶联免疫吸附分析方法研究[D].南京:南京农业大学,2010.
[15]国占宝,武玉香,田文礼,等.食品中四环素类残留的酶联免疫检测试剂盒的研制[J].食品科学,2011,32(2):333-337.GUO Zhan-bao,WU Yu-xiang,TIAN Wen-li,et al.Development of a new ELISA kit for tetracycline residue detection in foods[J].Food Science,2011,32(2):333-337.(in Chinese)
[16]唐伟国.医学检验诊断试剂的制备与应用[M].上海:上海科学技术文献出版社,1996.

