肝退变结节癌变及超声下微波治疗后的MRI随访观察
孟令平,周宁明,李扬,邹彪,吴强,韩芳
肝硬化退变结节(dysplastic nodule,DN)进展为肝细胞癌是一个渐进过程,磁共振随访观察对肝结节癌变有着较好的依从性[1-4]。笔者随访观察一组肝硬化DN 及其癌变的磁共振影像表现,探讨高场强MRI时肝硬化退变结节和结节癌变的信号变化,以及其对超声下微波治疗的癌变结节的随访价值。
材料与方法
1.临床资料
2005年4月-2011年3月经MRI诊断肝硬化患者225例,从中选取在MRI平扫T1WI上呈稍高信号和/或T2WI上明确可见至少1个以上(直径≥1cm)稍低信号并且动态增强无强化的结节病灶作为肝DN病例,符合上述条件者6 8例,其中1 6例有2次以上MRI随访,此16 例列入研究范畴。随访次数2~10次,平均5次;随访间隔3~12个月,平均8个月,随访时间3~58个月,随访3次以上11例。其中5例出现结节癌变,并进行超声引导下微波处理,微波术后1周内行磁共振检查。16 例中,男10 例,女6 例,年龄38~72岁,平均51岁,肝炎后肝硬化15例,血吸虫性肝硬化1例。16例近期均行肝脏超声检查,14例同期行CT检查。16 例中经手术、病理证实9 例,经超声活检诊断及随访诊断7例;5例肝硬化退变结节合并肝细胞癌均经超声穿刺活检病理证实。
2.MRI检查
使用GE Signa MR/i超导磁共振成像仪。常规肝脏平扫:横轴面快速扰相梯度回波序列T1WI(同/反相位),TR 120~150ms,TE 4.2~4.6ms/2.1~2.3ms,视野40cm×30cm,层厚8mm,层间隔2mm,矩阵256×160~192×160,激励次数1,翻转角80°,采集时间18~21s;FSE T2WI(抑脂),TR 6000~9231ms,TE 86.5~103.6ms,视野40cm×30cm,层厚8mm,层间隔2mm,矩阵(288~320)×(160~256),激励次数3~4,采集时间2.30~4.34min;冠状面FSE T2WI,TR 2200ms,TE 103.3~103.6ms,视野46.0cm×34.5cm,层厚8mm,层间隔2mm,矩阵256×160,激励次数1,采集时间18~21s。31例患者均行动态增强扫描,经肘静脉团注Gd-DTPA,剂量0.2mmol/kg,流率3mL/s,5~7s内注射完毕。分别于注射后15~20s、45~65s和3~5min采用横轴面快速扰相梯度回波序列T1WI(同相位)行动脉期、门脉期及延迟期扫描,扫描参数同平扫。
3.观察指标
观察各种结节灶在T1WI、T2WI及动态增强不同时间窗信号强度变化以及大小、分隔、假包膜显示情况。将病变的Gd-DTPA 动态增强信号改变分为4种类型。速升速降型:动脉期呈等或高于肝实质信号,门静脉期及延迟期呈低信号;缓升速降型:动脉期呈低或等于肝实质信号,门静脉期呈等信号,延迟期呈低信号;速升缓降型:动脉期呈等或高于肝实质信号,门静脉期及延迟期仍呈高或等信号;缓升缓降型:动脉期呈低或等于肝实质信号,门静脉期及延迟期呈高或等信号。
结 果
16例DN 直径1.2~3.2cm,平均2.3cm,T1WI(同/反相位)呈稍高信号12 个、等信号4 个;抑脂T2WI上呈相对低信号14个、等信号2个,15个结节周边有不规则网状分隔。Gd-DTPA 动态增强检查,16个肝结节中呈缓升速降型14 个,呈缓升缓降型1个,假包膜样强化1个(图1a-f)。
5例退变结节MRI随访期间出现癌变征象,随访时间6~42个月,平均25个月。其MRI表现为抑脂T2WI上等、低信号区域出现高信号;增强扫描动脉期示病灶血供增加,呈速升速降型3例,呈缓升缓降型2例。1例及时治疗,4例定期随访均发现结节不同程度增大(图1g-l)。
5例癌变结节最后均进行超声下微波热凝治疗,治疗范围是超过肿瘤边缘5~10mm 进行微波灭活。术后1周内行MRI检查,显示病灶范围扩大,T1WI示病灶由低或略低信号变为高信号而中央可见点状低信号,T2WI上结节由相对高信号变为等或略低信号,可见边缘薄层相对高信号环;动态增强扫描示病灶区呈“缓升缓降”型4例,局部呈“速升速降”型1例,提示残存活瘤组织(图1m-r)。
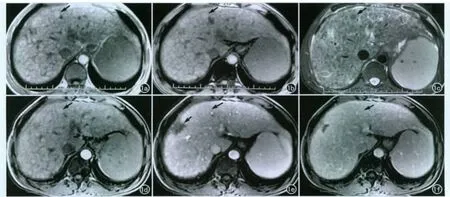
图1 弥漫肝硬化结节,肝S4段DN。a)同相位T1WI示肝DN 呈稍高信号(箭);b)反相位T1WI示肝DN 呈稍高信号(箭);c)抑脂T2WI示肝DN 呈相对低信号,周边纤维隔呈高信号(箭);d)增强扫描动脉期示肝DN 呈相对高信号(箭);e)增强扫描门脉期示肝DN 呈等信号,周边似见纤维隔(长箭),肝右叶不规则低信号为术后填塞(短箭);f)增强扫描延迟期示肝DN 呈等信号(箭)。
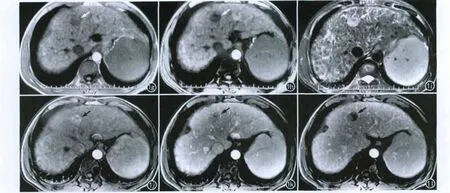
图1 间隔18个月,肝S4段DN 癌变。g)同相位T1WI示HCC呈不均匀稍低信号(箭);h)反相位T1WI示HCC 呈低信号(箭);i)抑脂T2WI示HCC呈不均匀高信号(箭);j)增强扫描动脉期示HCC明显不均匀强化呈相对高信号(箭);k)增强扫描门脉期示HCC呈等、低信号(箭);l)增强扫描延迟期示HCC呈低信号,可见包膜强化(箭)。
讨 论
肝退变结节癌变过程及节点,是目前临床及磁共振影像学研究的主要方向[2-8]。本文随访1组肝硬化DN 病例,动态观察肝退变结节及结节癌变微波治疗前后的信号变化,旨在探讨早期判断DN 及DN 癌变的MRI特征。
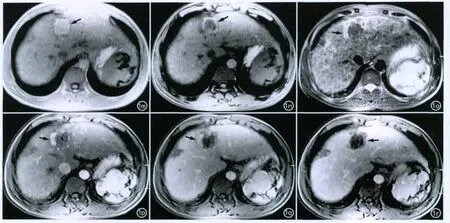
图1 间隔41个月,肝S4段HCC,超声下微波治疗后1周。m)同相位T1WI示病灶较前略增大;n)反相位T1WI示病灶呈周边高信号,中间高低混杂信号(箭);o)T2WI示病灶呈低信号,周边细环状高信号,局部杵状高信号(箭);p)增强扫描动脉期示病灶局部明显强化(箭),其余大部分不强化;q)静脉期示病灶局部强化较前减弱(箭);r)增强延迟期示病灶大部不强化,周边细环状强化(箭)。
大多数学者认为DN 在磁共振平扫T1WI上呈高信号,T2WI呈低信号;小肝细胞癌在T1WI上呈混杂等低信号,T2WI呈稍高信号[3-6]。本组16 个DN 中同、反相位T1WI上均呈高信号者14个,占83%(14/16),其原因可能与铜沉积、脂肪变或透明细胞变有关[1],而5个癌变结节中,同、反相位T1WI上均在原来稍高信号中出现等低信号改变;在抑脂T2WI上多数DN 为相对低信号,15 个DN 周围可见纤维分隔(图1a,b),5个癌变DN 中3个DN 由低信号明显变为高信号,2个呈等或稍高信号,与文献报道的退变结节癌变特点基本一致[2,4]。但也有报道DN 和小肝癌在T1WI和T2WI上观察到的信号特点有重叠,尤其是极早期的HCC,可能与磁共振设备的不同和所用序列有关,早期文献中多采用SE 序列和不抑脂技术;后期文献多采用梯度双回波序列及抑脂FSE 序列,因此,设备及参数的改变对结节信号变化会有一定影响,但对DN 在T2WI上呈等、低信号的特点文献报道还是比较一致[1-9]。应用特殊磁共振成像技术,如DWI和磁敏感成像技术,有望更多地鉴别DN 和小肝癌[6-7]。本组16例DN 做Gd-DTPA 动态增强扫描并现呈缓升速降型15例,基本与肝实质同步强化。5个癌变结节做中呈速升速降型3例,说明病灶大部分癌变;缓升缓降型2例,与DN 增强形式相似,仅平扫信号发生变化,提示DN 部分癌变。因此,动态增强MRI检查有助于了解血供,更好地判断结节癌变程度。近年来许多文献报道肝特异性对比剂如SPIO 和肝细胞性对比剂如Gd-BOPTA 等在鉴别良、恶性肝结节方面优于Gd-DTPA 增强扫描[6-8],也是今后研究的方向。
对肝DN 定期随访有助于观察DN 癌变征象[8],本组16例DN 进行定期随访,随访次数2~15次,随访时间3~58个月,平均8个月,其中5例随访过程中出现癌变的MRI征象(图2a-f),经超声下穿刺活检病理证实结节癌变,并进行超声下微波热凝治疗。肝DN 癌变时间点(1~3年)因人而异,并且受遗传基因、肝功能、退变结节类型及致病因素等影响[2,8]。并非所有退变结节都会癌变,甚至有退变结节自然消失的报道[2-4]。本组统计癌变结节占随访退变结节例数的31%(5/16),癌变时间6~42个月,平均24个月,说明退变结节癌变率较高,但也可能与病例选择有关,因本组将明显增大、增多的肝退变结节病例作为重点随访对象,提高了癌结节的检出率。因此,肝退变结节MRI定期随访有助于早期发现结节癌变,有报道以3~6个月检查1次为宜[8-9]。MRI检查,尤其应用常规序列结合功能成像技术应该成为高危人群筛查的主要工具之一。
超声引导下微波治疗能够使肿瘤凝固性坏死而成为一种有效的治疗方法。但微波治疗后的肿瘤不能很快缩小,需影像学评价其疗效,动态增强超声造影和增强CT能够鉴别肿瘤组织和坏死组织,可以作为随访检查手段来评价疗效[7-8]。但超声造影受检查者经验影响,不能全面观察组织结构,CT具有辐射性,均限制其应用。MRI有较高软组织分辨力,在疗效评价方面较为敏感,能准确区分微波后热凝坏死区与残瘤组织。通过对肝肿瘤微波治疗后MRI随访研究,有助于疗效评估及后续治疗方案的选择。
文献认为HCC 微波治疗后,平扫信号特征即发生明显变化,凝固坏死区在T1WI上由原来瘤内低信号变为高或等信号或大部分为高信号,T2WI上由原来相对高信号变为等或低信号,其信号改变能够区分凝固坏死和瘤组织;而病变范围扩大,实质上由于消融范围大于肿瘤本身,其信号改变为周围坏死及炎性反应所致。动态增强扫描呈“缓升缓降”型,是由于微波治疗破坏了瘤包膜,延迟期正常肝实质强化所致;而残存或复发的活瘤组织仍呈“速升速降”型强化方式[11-13]。本组5例微波治疗后HCC,1周内MRI动态增强检查,其中4例呈“缓升缓降”型,提示肿瘤彻底消融,坏死周围可出现肝窦扩张、充血或炎性反应,与文献报道一致[12-14],1例呈“速升速降”型,提示肿瘤残存(图2g-j)。因此,MRI随访微波治疗后的癌变结节,有一定的疗效评估意义,尤其长期MR 随访更有评估价值[12,14]。而且,磁共振新技术,如扩散加权成像和灌注成像等,也开始应用于肿瘤介入术后的疗效评价[15]。
本组资料不足之处在于肝退变结节随访例数偏少,不足以证明其癌变率,而多数小肝细胞癌往往具有肝硬化增生结节背景,而肝退变结节与再生结节影像形态及信号均难以区分,有文献报道再生结节也能够直接进展到肝细胞癌[10],应该成为今后进一步观察的内容。另外,本组仅分析HCC 1 次PRFA 术后早期的MR 影像资料,不能够对疗效作出符合性判断,今后,应对微波治疗HCC 后的定期MR 随访资料进行评估并与病理对照研究,期待更准确判定疗效。
[1]孟令平,万凯明,俞忠辉,等.高场强MRI鉴别诊断肝硬化退变结节和小肝癌[J].中国医学影像技术,2005,21(6):580-583.
[2]Van den Bos IC,Hussain SM,Terkivatan T,et al.Stepwise carcinogenesis of hepatocellular carcinoma in the cirrhotic liver:demonstration on serial MR imaging[J].J Magn Reson Imaging,2006,24(5):1071-1080.
[3]Hussain SM,Reinhold C,Mitchell DG.Cirrhosis and lesion char-acterization at MR imaging[J].RadioGraphics,2009,29(6):1637-1652.
[4]Kudo M.Multistep human hepatocarcinogenesis:correlation of imaging with pathology[J].J Gastroenterol,2009,44(Suppl 19):S112-S118.
[5]Hanna RF,Aguirre DA,Kased N,et al.Cirrhosis-associated hepatocellular nodules:correlation of histopathologic and MR imaging features[J].RadioGraphics,2008,28(3):747-769.
[6]任崧,叶兆祥,朱理珉.肝硬化结节多步癌变的病理及影像学表现[J].临床肝胆病杂志,2011,27(4):425-428.
[7]Tao R,You ZL,Zhang JQ,et al.Detection of siderotic nodules in the liver with susceptibility weighted imaging:correlations to serum ferritin,Child-Pugh grade and hyaluronic acid levels[J].Chin Med J,2012,125(17):3110-3114.
[8]Chou CT,Chen YL,Su WW,et al.Characterization of cirrhotic nodules with gadoxetic acid-enhanced magnetic resonance imaging:the efficacy of hepatocyte-phase imaging[J].J Magn Reson Imaging,2010,32(4):895-902.
[9]汪剑,陆建平,田建明,等.小肝癌自然史的磁共振成像研究[J].中华肿瘤杂志,2005,27(4):222-225.
[10]Kobayashi M,Ikeda K,Hosaka T.Dysplastic nodules frequently develop into hepatocellular carcinoma in patients with chronic viral hepatitis and cirrhosis[J].Cancer,2006,106(3):636-647.
[11]Minami Y,Kudo M.Review of dynamic contrast-enhanced ultrasound guidance in ablation therapy for hepatocellular carcinoma[J].World J Gastroenterol,2011,17(45):4952-4959.
[12]杜端明,邹英华,刘鹏程,等.MRI评价兔VX2肝癌射频消融后改变:与病理对照[J].中国医学影像技术,2010,26(4):605-608.
[13]Kierans AS,Elazzazi M,Braga L,et al.Thermoablative treatments for malignant liver lesions:10-year experience of MRI appearances of treatment Response[J].AJR,2010,194():523-529.
[14]Kim YS,Rhim H,Lim HK,et al.Coagulation necrosis induced by radiofrequency ablation in the liver:histopathologic and radiologic review of usual to extremely rare changes[J].RadioGraphics,2011,31(2):377-390.
[15]刘于宝,梁长虹,张忠林,等.3.0T MR 弥散加权成像评价肝细胞癌射频消融治疗疗效[J].中国医学影像技术,2010,26(5):896-899.
- 放射学实践的其它文章
- CT容积螺旋穿梭技术评估儿童先天性心脏病血液分流位置及方向的研究