中华鳖药源性肝病模型的构建及其病理学观察
陈彦伶,牟群,潘连德,刘译浓,王爱卿,郑佳瑞,邱进
(1.上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室,上海201306;2.四川省农科院水产研究所,四川宜宾644000)
中华鳖Trionyx sinensis 集约化养殖的疾病诊断及其控制效果,已成为决定其经济效益的重要问题。中华鳖“白底板”病和具有“白底板”症状的疾病流行广、危害严重[1],被养鳖者称之为“不治之症”。这些疾病的研究报道较多,发现的病原有病毒[2]、细菌[3-4]、细菌与病毒的混合感染[5-6]、非寄生性病因[7]等,有学者提出了一些治疗及预防方法[4-5,8],但均未取得理想效果。患病中华鳖表现出“白底板”是一种典型的全身缺血的腹面临床症状,牟群等[1]和潘连德等[7,9]研究发现,“白底板”症状并不是一种寄生性疾病,仅仅根据其症状来命名的中华鳖“白底板”病,值得商榷,有关该病的病原、病理、诊断与控制目前尚不明确。浙江杭州是中国集约化养殖中华鳖的主产区,温室养殖模式的产量占据较大市场分量,几年来,笔者对其跟踪诊断与控制研究发现,具有“白底板”症状的疾病依然是危重病害,给中华鳖生产造成了严重影响。本研究中,笔者使用常用药物构建具有“白底板”症状的中华鳖药源性肝病动物模型,研究该病的病因、病理过程以及病理机制和病理转归等问题,旨在为正确诊断具有“白底板”症状的疾病和预防与控制中华鳖药源性肝病提供科学指导。
1 材料与方法
1.1 材料
预试验用健康中华鳖稚鳖50 只,体质量为10 g;正式试验用健康中华鳖稚鳖640 只,体质量为5 ~10 g,均取自上海某中华鳖养殖场。
饲料为常兴牌稚鳖料。诺氟沙星、土霉素、氯霉素购自上海五洲药厂孙桥分厂。
1.2 方法
1.2.1 预试验在实验室条件下(室温25 ℃),共设10 组,其中1 组投喂添加10 g/kg 氯霉素的饲料;4 组分别投喂添加5、10、20、30 g/kg 土霉素的饲料;4 组分别投喂添加5、10、20、30 g/kg 诺氟沙星的饲料;1 组为空白对照组,投喂不添加任何药物的稚鳖料。每组放5 只中华鳖,在直径为70 cm 的塑料盆中养殖,盆底铺黄沙5 cm,手工制作药饵,以饲养20 ~30 d 出现阳性样品为参照。预试验结果表明,投喂诺氟沙星的组在添加浓度为5 g/kg时阳性症状出现时间少于20 d,结合生产用药浓度,确定试验组出现“白底板”症状阳性个体的药物添加浓度分别为诺氟沙星2 ~3 g/kg、土霉素10 ~20 g/kg,氯霉素为阳性对照。
1.2.2 药饵的制作和养殖试验条件 正式试验中,诺氟沙星添加量为2 g/kg(饲料),土霉素添加量为10 g/kg(饲料),按此比例手工将药物和粉末饲料称重、混合均匀后,加水揉成团状,两种药饵一次加工供5 d 的饲用量,放入冰箱(4 ℃)中保存。
正式试验在上海某中华鳖温室养殖车间进行。选上层4 口池,每个池中间用60 目筛绢隔开,共分成8 个养殖池,依次编号为1#~8#,车间控温在(28 ±2)℃,日粮、换水与生产车间同步。将健康稚鳖640 只,随机分为8 组投放到8 个养殖池中。
1.2.3 用两种药物分别构建中华鳖药源性肝病模型 先投喂稚鳖料驯化,待稚鳖正常吃食后再投喂药饵。1#池为投喂诺氟沙星药饵组,2#池为投喂不加药物饵料而池水相通的对照组;3#池为投喂土霉素药饵组,4#池为投喂不加药物饵料而池水相通的对照组;5#~8#池为投喂不加药物饵料的空白对照组。每7 ~10 d 全量换水一次。每个池日粮为16 ~20 g(投喂量为鱼体质量的5%)。每天观察和统计吃食量,检查稚鳖的健康状况,监测发病情况。试验阳性样品出现后,再进行以下病理转归试验。
1.2.4 药源性肝病转化的动物模型 分别将投喂诺氟沙星药饵组和土霉素药饵组中出现“白底板”症状食量减少或停食的阳性试验鳖(10 只和5只),继续投喂药饵,直至死亡。有明显变化时,按阶段固定样品,留做组织病理切片。
1.2.5 药源性肝病康复的动物模型 分别将投喂诺氟沙星药饵组和土霉素药饵组中出现“白底板”症状食量减少或停食的阳性试验鳖(10 只和5只),停喂30 d(诺氟沙星组)和20 d(土霉素组)后,改喂没有添加药物的稚鳖料,恢复吃食后,分批固定样品,留做组织病理观察。
1.2.6 切片的制作与观察
1)石蜡切片。根据临床解剖的结果,选择有代表特征鳖的肝、肾、脾和肺等组织块,用波恩氏液固定24 h 以上,用常规石蜡包埋,切片厚度为5 ~6 μm,用H.E 染色,在Olympus BH-2 显微镜下观察并拍照。
2)电镜超薄切片。在摘取制作石蜡切片组织块时,同步留取电镜超薄切片组织块,切成1 mm3的正方体小块。用体积分数为2.5%的戊二醛溶液前固定,用0.1 mol/L磷酸缓冲液洗3次,用体积分数为1%的锇酸后固定,用0.1 mol/L 磷酸缓冲液洗3次。然后经五级梯度浓度乙醇脱水(体积分数为50%、70%、80%、90%和95%),再依次用90%乙醇+丙酮(1∶ 1)以及丙酮+包埋剂(ERL 10 mL、GER 6 mL、NHA 26 mL、GNA 0.4 mL)(1∶ 1)浸透。用包埋剂包埋、模板固定后在60 ℃下烘干,用LKB—8800 超薄切片机切片,用醋酸双氧铀—柠檬酸铅双重染色,在JEM100—XⅡ透射电镜下观察并拍照。
2 结果
2.1 药源性肝病模型阳性(患病)率的统计和临床解剖特征
受试中华鳖出现“白底板”症状时,确认为阳性样品,即患药源性肝病鳖。试验开始38 d 时诺氟沙星组最先出现阳性样品,试验进行52 d 后清池和统计,诺氟沙星组阳性率最高,达31.3%(25 只/80 只,1#);土霉素组阳性样品出现较诺氟沙星组晚,阳性率略低,为15.0%(12 只/80 只,3#);与池水相通的对照组(2#和4#)由于受药毒的影响也有发病,但阳性率较低,分别为10.0%(8 只/80 只,2#)和5.0%(4 只/80 只,4#),证实1#和3#的残饵中或代谢物中的药毒通过流通的水分别进入2#和4#池,使对照组中华鳖受到毒害;空白对照组(5#~8#)未出现阳性样品。
对模型阳性样品的中华鳖临床解剖发现,患病鳖具有典型的“白底板”症状(图1 -A 5 号鳖、图1 -C 6 号鳖),切口无血,内脏器官除肝脏外(如肠、胃)严重失血(变白)(图1 -C 6 号鳖),肝脏是该病最严重的病变器官,呈紫色(图1 -B 4 号鳖)或深红色(图1 -B 3 号鳖)或白色(图1 -B 5 号鳖),肿大(为正常的3 ~4 倍),表面紧张,切口流出大量深色血液(图1 - B 2 号鳖),各样品的肝脏病变程度有所不同。脾、肾、心、肺等脏器的病理解剖症状不明显。
2.2 药源性肝病模型阳性中华鳖的组织病理变化
2.2.1 肝组织病理特征 从肝组织病理观察到1、6、2、3、4、5 号患病中华鳖肝组织病变依次加重,全部患病鳖的肝组织局灶性病变特征明显,根据读片结果归纳成如下病理变化过程。
1)肝组织炎症、淤血阶段(1 号患病中华鳖)。肝小叶和汇管区结构显现异常,肝细胞索结构有异常,肝细胞未坏死,血管和血窦内血细胞正常,窦状隙因扩张充血占据较大空间,肝门静脉继续膨胀,内积血液中白细胞占绝大部分,白细胞大量贴壁、浸润肝组织病变区域,形成明显炎症病灶(图1 -D)。电镜观察发现,血窦中白细胞数量剧增,且核型多变,溶酶体增多(图1 -E),肝细胞内脂滴增多增大且连成一片,细胞核肿胀,核靠边,核仁分解,线粒体肿胀(图1 -F)。
2)肝组织淤血加剧、肝细胞索混乱、肝细胞坏死阶段(6 号患病中华鳖)。肝小叶和汇管区结构显现异常加剧,血窦继续扩张、结构完整、淤血加剧,窦状隙因扩张充血而占据更大空间,肝细胞索混乱且萎缩,肝细胞坏死呈空泡化,血管和血窦内血细胞正常,肝静脉血管壁增厚,炎性细胞散布于肝组织,未见明显炎症灶(图1 -G)。电镜观察发现,肝血窦中白细胞挤压红细胞,白细胞核型多变(图1 -H),肝血窦挤压肝细胞,使肝细胞形状发生变化,细胞核肿大,细胞内高尔基、线粒体肿胀,结构模糊不清(图1 -I)。
3)肝组织血肿、血窦扩张、肝细胞坏死阶段(2 号患病中华鳖)。肝小叶和汇管区结构模糊,血窦继续扩张、结构完整、淤血加剧,窦状隙占据更大空间,肝细胞索混乱且萎缩,肝细胞坏死呈空泡化(图1 -J),血管和血窦内血细胞变性,肝静脉血管壁增厚,炎性细胞散布于肝组织,未见明显炎症灶(图1 -K)。
4)肝组织坏死、血窦继续扩张、窦壁破裂、肝细胞索破碎、肝细胞坏死、汇管区变性阶段(3号和4 号患病中华鳖)。肝小叶和汇管区结构消失,肝细胞索破碎、消失,肝细胞坏死呈空泡化,血窦继续扩张、窦壁破碎,散布于肝组织中,血细胞发生轻微变性,肝静脉血管壁增厚,炎性细胞散布于肝组织,未见明显炎症灶(图1 -L)。
5)肝组织接近硬化坏死、血细胞坏死和血浆变性阶段(5 号患病中华鳖)。肝静脉血管壁增厚(图1 -M),肝组织基本结构已经难以辨认,肝细胞坏死,细胞膜已经模糊不清(图1 -N),散布于组织中的血细胞变性,可见红细胞核膨胀、胞浆固缩,炎性细胞也有相似变性(图1 -O)。
2.2.2 肾、脾、肺组织病理特征 肺(1 号患病鳖):各阳性样品的肺组织结构正常,肺泡上皮细胞有嗜酸性粒细胞浸润,未形成炎症灶(图1 -P)。
脾(1 号和5 号患病鳖):遍布在整个脾脏组织中的炎性细胞浸润,形成明显炎症灶,红髓中的脾索和脾窦难以区分,白髓中出现大量红细胞,脾小体界限不清(图1 -Q),白髓和红髓交界处可以观察到许多粒细胞,基本结构正常(图1 -R)。
肾(1 号和5 号患病鳖):肾外侧区的肾小管有炎性细胞浸润,形成明显炎症灶,部分近端小管、集合管、远端小管的上皮细胞发生空泡化变性坏死(图1-S),内侧区肾小球球囊腔扩张,腔内充有泡沫状物质,嗜酸性粒细胞散布肾组织中(图1-T)。
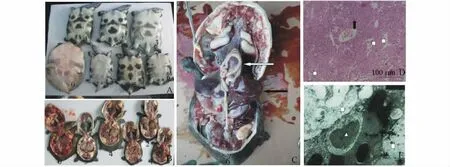
图1 中华鳖药源性肝病组织病理解剖和组织学观察Fig.1 The pathological anatomy and histological observation of liver,lung,spleen and kidney in drug-induced liver diseased soft-shell turtle
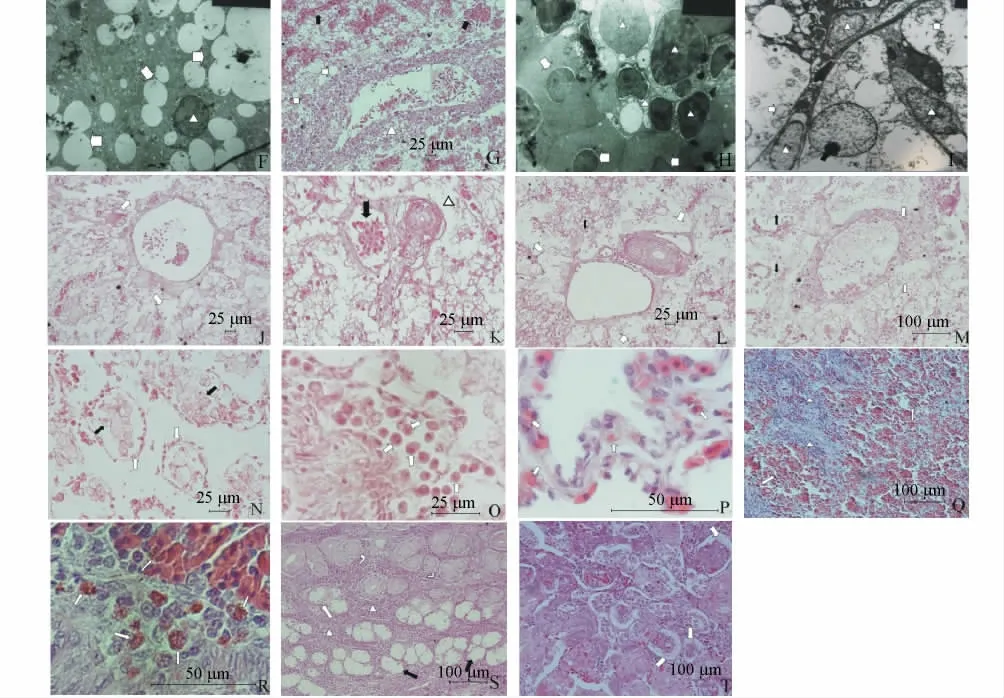
续图1 中华鳖药源性肝病组织病理解剖和组织学观察Cont.Fig.1 The pathological anatomy and histological observation of liver,lung,spleen and kidney in drug-induced liver diseas soft-shelled turtle
2.3 药源性肝病的转归
对阳性鳖继续用药饵饲喂,“白底板”症状逐渐明显,病情加重,第17 d 陆续开始死亡,试验30 d 时受试鳖全部死亡。
对阳性鳖停喂药饵,停喂30 d(诺氟沙星组)和20 d(土霉素组)后,鳖开始恢复进食,逐步进入康复状态,恢复进食40 d 后试验鳖均出现健康鳖的底板色,表明当致病因素(大剂量药物饵料)撤销后,中华鳖有较强的恢复性,并表现出土霉素组较诺氟沙星组康复的快,康复之后中华鳖5月龄后放入池塘继续饲养。
3 讨论
3.1 中华鳖药源性肝病模型构建的意义
药源性疾病具有很强的隐蔽性,而其危害性至今尚未引起广大医务工作者重视,使得对药源性肝病及其诊断和治疗知之甚少[10]。中华鳖的药源性肝病正是由于这种原因,常常得不到准确的诊断。本试验在生产车间条件下,试验样品640 只,试验全程达到150 d,成功构建了中华鳖药源性肝病及其转化模型,充分证明了长期高剂量使用抗生素会导致中华鳖患上具有典型“白底板”症状的药源性肝病。本研究为水产动物医学的非病原性疾病模型的研究奠定了基础。
康复试验开始时的中华鳖通过病理解剖和组织病理观察,发现其病情已经发展到肝淤血至肝血肿阶段,停止用药后可恢复到健康状态,表明在肝淤血阶段及轻度的肝血肿阶段,药源性肝病是可以康复的,具有一定可逆性。发现病变后及时、准确地诊断,查明原因,将致病因子消除即可痊愈。养殖期间常用保肝健脾的中药制剂,可起到预防效果[11-14],还可借鉴家畜、家禽集约化养殖的“限饲饲养”方法进行预防。
3.2 药物致中华鳖肝组织损害的组织病理过程
中华鳖药源性肝病按临床分类属于中毒性肝损伤。从中华鳖药源性肝病模型可以清楚地了解疾病产生的整个组织病理变化过程,中华鳖在长期受到大量抗生素药物的刺激下,肝脏负担过重、中毒,造成严重的肝损伤;致病因子持续作用脂肪变性更加严重,引起肝组织炎症[15-16]和淤血;出现血肿与出血;肝细胞的空泡化变性、坏死,肝血窦窦壁破裂,趋于肝硬变和肝性腹水,这一系列组织病理过程导致肝功能衰竭,患病鳖死亡。高剂量、长时间使用抗生素类药物是中华鳖药源性肝病的致病原因,临床表现为“白底板”症状。
3.3 中华鳖药源性肝病的诊断和肝损害的预防
药源性肝损害是引起肝功能障碍的常见原因,占整个药物不良反应的10%左右。长期低剂量摄取的药饵中,对肝脏损伤严重的有磺胺类、抗生素药物、有机氯杀虫剂[17-18]和化学合成物质[19]。此外,矿 物 质(Cd、Pb、Cu等)[20]、维 生 素(Ve)[21]、激素,以及含亚硝酸盐高的饲料[22]、黄曲霉素的饲料[23-24]和氧化鱼油[25]等都会造成肝脏损伤或影响肝功能,出现非寄生性疾病。
药源性肝病与其他原因所致的肝病不易区别,给诊断带来一定困难。调查疾病原因时要问清养殖过程中给药情况以及给药种类、剂量、时间等,发现有重症的个体要及早停药,进行全面检查,查明致病的准确病因,给予正确的诊断。中华鳖药源性肝病具有典型的“白底板”症状,病理解剖特征是肝淤血、血肿和硬化,组织病理特征是炎症、淤血、肝细胞坏死、血细胞坏死,这些都可作为诊断依据。药源性肝病属于中华鳖非寄生性疾病的一种[7],不能诊断为中华鳖“白底板”病。
[1]牟群,林启存,潘连德.中华鳖白底板病及有白底板症状疾病的诊断和控制[J].水产科技情报,2011,38(6):298 -301,306.
[2]池信才,吴定虎,黄槐,等.养殖中华鳖出血病病毒的电镜观察[J].鱼类病害研究,1998,20(3):1 -5.
[3]叶巧真,何健国,邱德全,等.中华鳖白底板病和红底板病细菌的分离鉴定及致病性[J].微生物学通报,2000,27(6):407 -413.
[4]陈晓岚,周常义,青新.鳖“白板病”致病细菌的研究[J].水产学报,1997,21(3):309 -315.
[5]沈锦玉,潘晓艺,余旭平,等.中华鳖白底板病病原的分析[J].中国水产科学,2007,14(5):815 -822.
[6]叶巧真,何建国,翁少萍,等.中华鳖白底板病和红底板病病毒及细菌的致病性[J].淡水渔业,1999,26(8):3 -7.
[7]潘连德.中华鳖非寄生性肝病组织病理研究[J].水产学报,1998,22(2):129 -135.
[8]丁雷,岳永生,宋憬愚,等.鳖白底板病、腐皮病并发症病原菌及药物治疗[J].淡水渔业,2001,31(1):46 -48.
[9]潘连德,孙玉华,刘其根.温室养殖中华鳖非寄生性肝病的诊断[J].水产科技情报,1999,26(1):10 -15.
[10]林京玉.抗菌药和药物性肝损伤[J].国外医学药学分册,2006,33(3):195 -197,230.
[11]朱家新,方兰勇,吴新民,等.鳖白底板的临床诊断与防治研究初报[J].畜牧与兽医,2000,32(1):27 -28.
[12]夏军权,奚肇宏.肝病治疗的中药药源性肝损害的预防[J].中华全科医学,2010(10):1287 -1288.
[13]曹丽萍,贾睿,丁炜东,等.建鲤急性肝损伤模型的建立及当归提取物的保肝和抗氧化作用研究[J].大连海洋大学学报,2012,27(6):551 -557.
[14]曹丽萍,贾睿,丁炜东,等.五味子提取物对用t-BHP 损伤的异育银鲫原代肝细胞的影响[J].大连海洋大学学报,2011,26(3):197 -202.
[15]Gunawan B K,Kaplowitz N.Mechanisms of drug -induced liver disease[J].Clinics in Liver Disease,2007,11(3):459 -475.
[16]Pham B N,Bernuau J,Durand F,et al.Eotaxin expression and eosinophil infiltrate in the liver of patients with drug -induced liver disease[J].Journal of Hepatology,2001,34(4):537 -547.
[17]Braunbeck T,Gorge G,Storch V.et al.Hepatic steatosis in zebra fish(Brachydanio rerio)induced by long - term exposure to Y -hexachlorocyclohexane[J].Ecotoxixology and Environmental Safety,1990,19(3):355 -374.
[18]李磊,黄清发,肖雨,等.五氯酚钠在鲫体内的毒性及代谢动力学的研究[J].大连海洋大学学报,2012,27(3):243 -246.
[19]汪开毓,耿毅,叶仕根,等.鲤慢性喹乙醇中毒的病理学和组织学残留[J].水产学报,2003,27(1):75 -82.
[20]Henczová M,Deér A K,Filla A,et al.Effects of Cu2+and Pb2+on different fish species:Liver cytochrome P450 -dependent monooxygenase activities and FTIR spectra[J].Comparative Biochemistry and Physiology,2008,148(1):53 -60.
[21]Moccia R D,Hung S S O,Slinger S J,et al.Effect of oxidized fish oil,vitamin E and ethoxyquin on the histopathology and haematology of rainbow trout Salmo gairdneri Richardson[J].Journal of Fish Diseases,1984,7(4):269 -282.
[22]王鸿泰,何力,张俊.饲料质量与中华鳖白底板病的关系[J].淡水渔业,2002,32(2):322 -333.
[23]Chávez-Sánchez M C,Martínez Palacios C A,Osorio M I,et al.Pathological effects of feeding young Oreochromis niloticus diets supplemented with different levels of aflatoxin B1[J].Aquaculture,1994,127:49 -60.
[24]Nunez O,Hendricks J D,Duimstra J R.Ultrastructure of hepatocellular neoplasms in aflatoxin B1(AFB1)-initiated rainbow trout(Oncorhynchus mykiss)[J].Toxicologic Pathology,1991,19(1):11 -23.
[25]叶仕根,汪开毓,何显荣,等.鲤摄食含氧化鱼油的饲料后其病理学的变化[J].大连水产学院学报,2006,21(1):1 -6.

