单端孢霉烯族毒素毒性、检测和脱毒研究进展
薛华丽,毕 阳*,王 毅,葛永红,李永才
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学理学院,甘肃 兰州 730070)
单端孢霉烯族毒素(Trichothecenes)是一类化学性质相近的真菌毒素,由镰刀菌(Fusarium)、木霉(Trichoderma)、单端孢(Trichthecium)、头孢霉(Cephalosporium)、漆斑霉(Myrothecium)、轮枝孢(Verticillium)和黑色葡萄状穗霉(Stachybotrys)等属的真菌产生[1],该类毒素不仅污染小麦、大麦、玉米等禾谷类作物[2-6],也危害马铃薯等经济作物[7-8],以及肉、奶、蛋等畜产品[9-12]。现已经鉴定出单端孢霉烯族毒素200余种[13],根据其化学结构,可分为A、B、C、D四类,其中以A和B型较为常见[14],A型在C8位上有羟基(—OH)或酯基(—COOR),B型在C8位上有羰基(—C=O)。具体结构如图1和表1所示[15]。由于单端孢霉烯族毒素具有致癌、致畸、致突变的作用,严重威胁人畜健康[16]。加之种类繁多,且结构差异较大,故检测方法多样。另外,该类毒素的耐热和耐酸碱特性,也导致了脱除的困难。本文就近年来谷物及其制品中重要的单端孢霉烯族类毒素的毒性效应、分析及脱除方法进行综述,以期为食品质量的安全控制提供一定的理论依据。
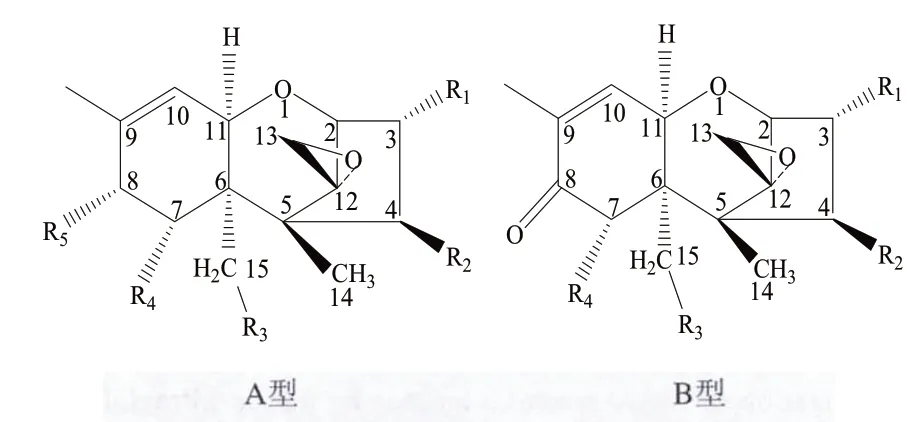
图1 单端孢酶烯族毒素的基本结构Fig.1 Chemical structures of trichothecenes
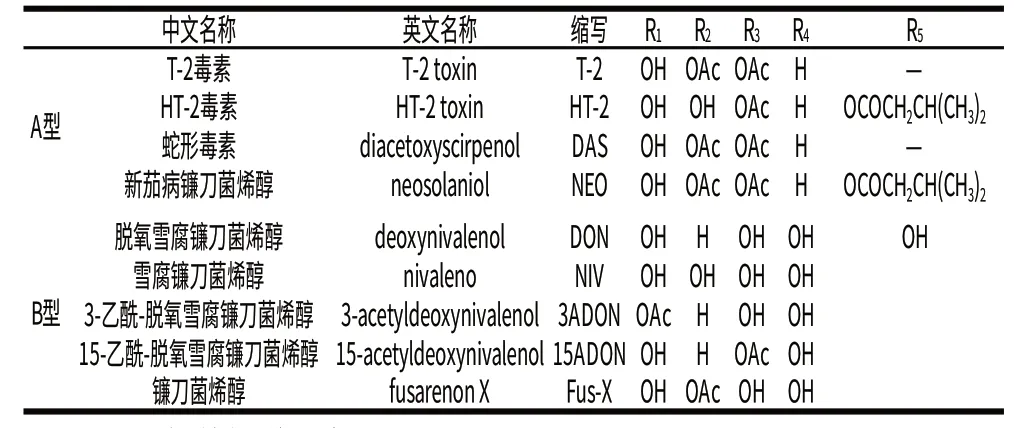
表1 A型和B型单端孢霉烯毒素取代基的区别Table 1 Difference in substitution groups in trichothecenes
1 单端孢霉烯族毒素的毒性效应
单端孢霉烯族毒素主要是通过抑制和干扰人和动物体内的蛋白质和核酸合成,从而对人畜健康产生免疫抑制[17]。人畜在食用该类毒素污染的粮食及其制品后可产生广泛的毒性效应。
1.1 对人类的毒性
在单端孢霉烯族毒素中,以T-2的毒性最强[18],由于为亲脂性物质,极易渗透皮肤,低剂量时引起皮肤刺激,高剂量时能够损伤细胞膜, 并引起淋巴腺和造血细胞组织的凋亡,同时还可导致骨髓坏死、白细胞减少和软骨组织退行性变化等[19-20]。T-2还被认为与白细胞缺乏病、大骨病和克山病这3种地方病的发生有关[21]。 T-2对胎儿软骨增殖有明显的抑制作用,毒素浓度越大,对软骨细胞的增殖抑制也就越明显,当质量浓度达到20 g/L时就可引起软骨细胞凋亡[22]。DON的毒性虽低于T-2,但其污染更为广泛,摄取含DON的食物后会造成头疼、恶心、腹疼、贫血、免疫力下降。如果长期摄入,会造成致癌、致畸、遗传毒性、肝细胞毒性、中毒性肾损害、生殖紊乱、免疫抑制的发生[23]。
1.2 对动物的毒性
单端孢霉烯族毒素可引起动物恶心、呕吐、食欲减退或拒食、倦怠和体质量减轻、生殖功能下降,严重时损害造血系统造成死亡[24]。不过,毒素的反应强弱与动物种属、年龄、雌雄和剂量等有关。一般猪对该类毒素较敏感,猪的抗拒综合症通常与DON有关。当猪饲料中DON含量超过1mg/kg,采食量显著降低,甚至拒食,偶尔伴有呕吐症状,低剂量DON对猪毒性的作用机制主要是通过抑制免疫相关基因而导致一系列症状[25]。当向猪饲料中添加12mg/kg DON时,会引起拒食,体质量减轻,这种拒食可能是由于毒素对消化道的局部刺激或饲料的适口性不良所致[26]。DON毒素对牛、羊、成年鸡鸭则不出现拒食现象。牛、羊似乎对DON不敏感,可能是由于其瘤胃具有代谢和清除单端孢霉烯族毒素的能力[1]。当鸡采食含DON高达18mg/kg的饲料无明显有害影响, 进食9.18mg/kg DON的饲料,蛋和肉中也检测不出DON[27]。Iverson等[28]用DON含量为0、1、5、10mg/kg的饲料饲喂雄性、雌性大鼠2a发现动物体质量增加与DON剂量呈负相关,雄性大鼠血浆中IgA、IgG浓度较对照组增高,生化指标和血液学指标也可见明显异常,病理学检查还发现有肝脏肿瘤、肝脏损害。家禽、牛、羊、猪都对T-2 毒素敏感。T-2毒素经动物口、皮肤、注射等方式都可引发造血、淋巴、胃肠组织以及皮肤的损害,并且损害生殖器官的功能,降低抗体、免疫球蛋白和其他体液因子的水平。Mono等[29]通过给大鼠饲喂含T-2的饲料时发现,雄鼠肺腺瘤和肝细胞腺瘤的发病率均高于雌鼠。而在妊娠9~10d的小鼠腹腔注射1.0mg/kg T-2(以小鼠体质量计),可导致鼠胎畸形,如短尾、无尾、脊柱融合等[30]。
2 单端孢霉烯族毒素的分析
2.1 样品的提取与净化
使用多种溶剂组合可充分从谷类及其制品中提取单端孢霉烯族毒素[31-32],报道较多的提取剂是V乙腈:V水=84:16[3],通过高速搅拌或机械搅拌可获得最佳的萃取效果。样品的净化技术有柱色谱、固相萃取(SPE)、免疫亲和柱(IAC)和多功能净化柱(MycoSep)。最常用的是SPE技术,其中的固定相有硅胶、C18键合相、氧化铝、活性炭、Flofisil的硅酸镁、离子交换材料和它们的混合物。Seidel等[33]采用Florisil-SPE柱对谷物样品进行前处理,结合气相色谱-电子捕获检测器(GC-ECD)法对单端孢霉烯族毒素进行了测定,该方法对DON、NIV、HT-2回收率分别84.2%、87.1%、93.3%,而T-2的回收率比较低,仅为62.7%。IAC净化技术具有特异性强、高选择性和高回收率的特点,可以与高效液相色谱法联用。因此,我国出入境检验检疫行业标准SN/T 1771—2006《进出口粮谷中T-2毒素的测定》,免疫亲和柱-液相色谱法中样品的前处理采用的就是该法[34]。Cahill等[35]采用IAC对小麦样品进行前处理,结合HPLC对DON含量进行检测,平均回收率可达90%,RSD为8.3%。然而,IAC柱对待测毒素抗原有一一对应的特异性吸附,测定费用昂贵。多功能MycoSep柱由于操作方便,无需固相提取和溶剂洗脱,经MycoSep柱处理后几乎所有的干扰物都留在柱中,而单端孢霉烯族毒素则不被吸附。MycoSepTM柱与HPLC和GC联用,回收率大于80%(除NIV回收率60%~70%)[36]。Dall-Asta等[37]采用MycoSep 225柱净化,用LC-MS联用同时测定谷物中A型和B型单端孢霉烯族毒素,最低检测限可达20ng/g。Valle-Algarra等[38]对MycoSep 225柱、Florisil-SPE柱、氧化铝-活性炭-西莱特545混合柱、氧化铝-活性炭柱、氧化铝-活性炭-C18硅胶柱和氧化铝-活性炭-硅胶柱这6种SPE柱对B型单端孢霉烯族毒素的净化效果进行比较分析,通过回收率实验发现MycoSep 225柱对DON的回收率最高,为89.6%。因此,MycoSepTM柱具有较好的应用前景。最近,美国瓦里安公司新开发出了一种名为Bond Elut Mycotoxin的SPE柱,这种SPE柱采用了新型的吸附剂,可同时对谷物及制品中12种单端孢霉烯族毒素进行净化,回收率可达65.1%,且该柱的市场价格比同类的MycoSep多功能柱和IAC要低很多[39],但目前还未见有文献报道使用。
2.2 样品的检测
目前单端孢霉烯族类毒素常采用的检测方法基本上分为免疫学检测和物理化学检测两大类。免疫学检测主要为酶联免疫法(ELISA)。物理化学检测主要包括薄层色谱法、气相色谱法和高效液相色谱法。
2.2.1 免疫学检测
免疫学检测的优点是快速、简单、灵敏,待检测的样品通常不需要净化,即使要净化也是最低程度的。其缺点是较易出现假阳性,且要产生用于ELISA的高效、特异的单抗或多抗需要一个复杂的过程。我国卫生部食检所阳传和等在1992年建立的DON的ELISA法最低检出量为5ng/mL,检测范围为5~1000ng/mL,被批准为国家推荐标准检测方法[40]。Ramesh等[41]将DON的C15羟基与牛血清白蛋白(BSA)形成的偶联物作为抗原制备出的单抗进行ELISA检测,检测出DON和15-ADON,但不与3-ADON反应,检出限为0.05~20μg/mL。
2.2.2 物理化学检测
2.2.2.1 薄层色谱法(TLC)
TLC是最早建立的一种单端孢霉烯族毒素检测方法,具有简便、经济、设备简单等特点,但其灵敏度稍差,近年来应用较少。对于谷物及其制品中DON和饲料中T-2的测定,TLC方法是我国国家标准推荐检测方法之一[40,42]。Sokolovic等[43]采用TLC法对谷物和饲料中T-2和DAS进行了检测,回收率分别为85%和90%,最低检测线为0.1mg/g。随着高效薄层色谱法(HPTLC)以及薄层扫描仪的应用,TLC的分离效率和精确率都得到提高。但目前还未见有关使用HPTLC测定单端孢霉烯族毒素的文献报道。
2.2.2.2 气相色谱法(GC)
气相色谱可与电子捕获检测器(ECD)、火焰离子化检测器(FID)、质谱(MS)或串联质谱联用达到检测的目的。Cerveró等[44]采用GC-FID,测定了25种谷物制品中DON和T-2的含量,回收率分别为67%~85%、85%~96%。Ibá ez-Vea等[45]建立了同时对A、B型单端孢霉烯族毒素进行快速分析的GC-MS,回收率为92.0%~101.9%,检测限为0.31~3.87 g/kg。GC具有灵敏性、高选择性、准确性和精确性等优点,可同时对A、B型单端孢霉烯族毒素进行检测。但GC色谱法需要衍生,同时GC色谱中还存在标准曲线线性关系不好、响应漂移、上一次进样样品的滞留和记忆效应、MS检测时重复进样变异系数大以及基体干扰等问题。所以应用GC方法分析单端孢霉烯族毒素有待标准化以减少GC分析中出现的问题。
2.2.2.3 高效液相色谱法(HPLC)
HPLC具有GC所具有的灵敏性、高选择性、准确性和精确性等优点,同时能克服GC中难以解决的问题,近年来被越来越广泛使用。Schuhmacher等[46]建立了HPLCMS/MS测定玉米中A、B型单端孢霉烯族毒素的方法,该方法最低检测限为0.3~3.8 g/kg。Han等[47]通过超高压液相色谱-串联质谱法(UPLC-MS/MS)同时检测到5种DON,3-ADON、15-ADON、NIV、Fus-X的含量,检测限0.29~0.99 g/kg,回收率88.5%~119.5%。Santini等[48]利用液相色谱/大气压化学源三重四极杆串联质谱(HPLCAPCI-MS/MS)实现了对A、B单端孢霉烯族毒素NIV、DON、Fus-X、3-ADON、DAS、HT-2、T-2和NEO的同时检测。除DAS、HT-2外,其他毒素的检测范围为0.2~3.3 g/kg。
表2对近年来上述单端孢霉烯族毒素的分析方法进行了总结,包括基质来源、萃取、纯化、分离检测、检出限和回收率等。可以看出,2005年以后基本都是利用HPLC-MS/MS方法进行单端孢霉烯族真菌毒素的检测,主要是因为该方法不仅检测限低,而且可以避免衍生步骤的烦琐,便于操作。

表2 单端孢霉烯族毒素检测方法Table 2 Detection of trichothecenes
3 单端孢霉烯族毒素的脱毒
单端孢霉烯族毒素的毒性取决于其分子结构,尤其是结构中的毒性官能团[42]。因此,这些官能团是脱毒作用的靶点。常见的脱毒方法有物理法、化学法和生物法。
3.1 物理法
物理法主要通过热处理、微波、辐射、吸附等方法脱除毒素。单端孢霉烯族毒素类物质在120℃时很稳定,当温度高于200℃时部分分解,Bullerman等[49]在210℃处理30~40min,可将其毒性结构破坏,如焙烤类食品中,单端孢霉烯族毒素的含量会降低24%~71%。辐射法主要采用微波诱导或短波紫外线照射来降解毒素或杀死霉菌,Park等[50]采用自制的微波诱导氩等离子体处理含DON和NIV的谷物制品,当处理5s后,DON和NIV可被彻底清除。Murata等[51]采用短波紫外线(中等强度0.1mW/cm2和高强度24mW/cm2)对含DON的样品进行处理时发现,随着紫外线强度的增强,以及处理时间的延长,对DON的脱除效果就会越来越好。
3.2 化学法
化学法是采用一定的化学试剂处理,将毒素转化为低毒或无毒的物质。主要包括碱、氧化剂和还原剂处理。Bretz等[52-53]发现,在75℃、0.1mol/L NaOH作用1h,NIV和3-ADON产生norNIVA、norNIV B、norNIV C、NIV内酯和norDON A、norDON B、norDON C和其他4种产物(9-羟甲基DON内酯、norDON D、norDON E和norDON F),且转化产物的毒性远低于NIV和3-ADON的毒性。氧化剂如臭氧进攻结构中的C-9,10位的双键使其发生环氧化而使其毒性降低。Young等[54]发现湿润的臭氧(2.88%)通过霉变玉米时,能减少90%的DON;而当两者都处于干燥状态时,DON的减少量不大。还原剂如Na2S2O5可将DON转化成DON磺酸盐,使其毒性大大降低。Danicke等[55]通过比较用Na2S2O5处理过的霉变小麦和不含毒素的小麦喂食仔猪,发现仔猪的反应相同,与用未经处理的霉变小麦喂食仔猪相比,具有很明显的改善作用。
3.3 生物法
生物脱毒是指应用微生物及其代谢产生的酶与毒素作用,使其分子结构中的毒性基团被破坏而生成无毒降解产物的过程。单端孢霉烯族毒素的毒性各不相同,这是由其分子结构,尤其是毒性官能团决定的。这些毒性官能团包括:C-12,13环氧环、C-9,10双键、乙酰基和羟基的位置和数量也与毒性有关[15]。该类毒素的生物降解包括分子的脱环氧化、烯基的氧化、脱乙酰化、羟基化和羰基化等。
3.3.1 脱环氧化
在单端孢霉烯结构中,C-12,13环氧环是毒性的必需官能基团,A型和B型单端孢霉烯族毒素的开环作用,例如脱环氧作用,能产生无毒或低毒的产物。如Swanson等[56]通过脱氧环T-2毒素刺激大鼠皮肤实验,发现其毒性是T-2毒素的1/400。Schatzmayr等[57]从乳牛瘤胃液中分离得到具有脱环氧化作用的菌株BBSH 797。Eriksen[58]将DON在该菌株的存在下,经脱环氧化得到DOM-1,进行DNA合成评价,发现DOM-1的毒性是DON的1/54,脱环氧NIV的毒性是NIV的1/55。
3.3.2 烯基的氧化
C-9,10双键(烯基)也是单端孢霉烯族毒素毒性作用的必需基团。Young等[54]采用臭氧处理单端孢霉烯族毒素类化合物,首先攻击双键在C-9,10双键上加上2个氧原子,分子的其他部分没有发生改变。毒素的分子结构发生改变,从而使其毒性降低。
3.3.3 脱乙酰化
虽然C-12,13环氧环和C-9,10双键是毒性作用的必需基团,乙酰基的位置和数量也显著地影响到单端孢霉烯族毒素的毒性。Fuchs[59]发现反刍动物瘤胃液中具有脱乙酰作用的微生物,在厌氧条件下与瘤胃液一起孵化后,DAS、T-2分别转化为低毒性MAS、HT-2。Young等[60]发现从鸡肠道消化物中分离鉴定得到细菌菌株LS100和SS3具有对12种单端孢霉烯族毒素脱毒降解的能力。Ueno等[61]也发现,土壤微生物短小杆菌属菌株114-2在有氧条件下,可将T-2毒素可转化为HT-2毒素,HT-2毒素进一步转化成T-2三醇,T-2三醇在菌株BBSH797作用下,最后转化为T-2四醇,其毒性大小关系:T-2>HT-2>T-2三醇>T-2四醇。
3.3.4 羟基化和羰基化
单端孢霉烯族毒素分子结构中,羟基的存在与否及位置也影响其毒性,NIV和DON的区别是NIV的C-4位上有羟基,而NIV毒性是DON的10倍[15]。但C-3位上羟基对其毒性影响不同,当T-2、HT-2及T-2三醇的C-3位上的羟基被乙酰基取代,形成T-2乙酸盐、T-2毒素和T-2四醇四乙酸盐,它们的毒性却显著降低[62]。Baccharisspp.能将T-2毒素通过羟基化作用氧化成3’-OH T-2或3’-OHHT-2[63],Yoshizawa等[64]研究表明,羟基化氧化作用需要NADPH的参与,主要发生在肝微粒体中,苯巴比妥能诱导大多数细胞色素P-450同工酶系,起到催化作用,从而加强这一反应,苯巴比妥能在肝中通过羟基化和糖酯化作用被代谢掉。
4 结 语
通过对单端孢霉烯族毒素的毒性效应、分析方法和脱毒技术进行系统比较,结果表明,该类毒素来源广泛,对人畜健康存在潜在威胁,但不同畜种对单端孢霉烯族毒素的毒性反应存在差异;多种方法可用于单端孢霉烯族毒素的检测,包括酶联免疫吸附法、HPTLC法、GC和HPLC法,其中HPLC-MS/MS由于具有极高的检测灵敏度,可以根据待测物的性质选择不同的离子化模式,因此该法在单端孢霉烯族毒素的检测中将具有广阔的应用前景;加热和短波紫外线处理可有效降低单端孢霉烯族毒素的浓度,化学处理也有良好的脱除效果,但存在效果不稳定、降低营养价值以及适口性、产生残留有害物质等问题,采用微生物的生物脱毒法因具有高效、特异性强、对饲料和环境无污染等特点成为目前研究的热点。
[1]MENEELY J P, RICCI F, van-EGMOND H P, et al.Current methods of analysis for the determination of trichothecene mycotoxins in food[J].Trends in Analytical Chemistry, 2011, 2: 192-203.
[2]BERGAMINI E, CATELLANI D, DALL’ASTA C, et al.Fate ofFusariummycotoxins in the cereal product supply chain:the deoxynivalenol (DON) case within industrial bread-making technology[J].Food Additives and Contaminants, 2010, 27(5):677-687.
[3]ADEJUMO T O, HETTWER U, KARLOVSKY P.Occurrence ofFusariumspecies and trichothecenes in Nigerian maize[J].International Journal of Food Microbiology, 2007, 116: 350-357.
[4]KAMMOUN L G, GARGOURI S, BARREAU C.Trichothecene chemotypes ofFusarium culmoruminfecting wheat in Tunisia[J].International Journal of Food Microbiology, 2010, 140: 84-89.
[6]MOAZAMI E F, JINAP S.Optimisation of the determination of deoxynivalenol in wheat flour by HPLC and a comparison of four clean-up procedures[J].Food Additives and Contaminants, 2009,26(9): 1290-1297.
[7]DELGADO J A, SCHWARZ P B, GILLESPIE J, et al.Trichothecene mycotoxins associated with potato dry rot caused byFusarium graminearum[J].Postharvest Pathology and Mycotoxins, 2010, 100(3):290-296.
[8]EL-BANNA A A, SCOTT P M, PUI-YAN L, et al.Formation of Trichothecenes byFusarium solanivar.coeruleumandFusarium sambucinumin potatoes[J].Applied and Environmental Microbiology,1984, 5: 1169-1171.
[9]ZOU Z Y, HE Z F, LI H J, et al.Development and application of a method for the analysis of two trichothecenes: deoxynivalenol and T-2 toxin in meat in China by HPLC-MS/MS[J].Meat Science, 2012,90(3): 613-617.
[10]POAPOLATHEP A, SUGITA-KONISHI Y, PHITSANU T, et al.Placental and milk transmission of trichothecene mycotoxins, nivalenol and fusarenon-X, in mice[J].Toxicon, 2004, 44(1): 111-113.
[11]SYPECKA Z, KELLY M, BRERETON P.Deoxynivalenol and zearalenone residues in eggs of laying hens fed with a naturally contaminated diet: effects on egg production and estimation of transmission rates from feed to eggs[J].Journal of Agricultural and Food Chemistry, 2004, 52(17): 5463-5471.
[12]VALENTA H, DNICKE S.Study on the transmission of deoxynivalenol and deepoxy-deoxynivalenol into eggs of laying hens using a high-performance liquid chromatography-ultraviolet method with clean-up by immunoaffinity columns[J].Molecular Nutrition and Food Research, 2005, 49: 779-785.
[13]ZHOU T, HE J W, GONG J.Microbial transformation of trichothecene mycotoxins[J].Journal of World Mycotoxin, 2008, 1(1): 23-30.
[14]邹忠义, 贺稚非, 李洪军, 等.单端孢霉烯族毒素转化降解研究进展[J].食品科学, 2010, 31(19): 443-448.
[15]HE J, ZHOU T, YOUNG J C, et al.Chemical and biological transformations for detoxification of trichothecene mycotoxins in human and animal food chains: a review[J].Trends in Food Science and Technology, 2010, 21(2): 67-76.
[16]MORGAVI D P, RILEY R T.Fusariumand their toxins: mycology,occurrence, toxicity, control and economic impact[J].Animal Feed Science and Technology, 2007, 137: 199-200.
[17]ROCHA O, ANSARI K, DOOHAN fM.Effects of trichothecene mycotoxins on eukaryotic cells: a review[J].Food Additives and Contaminants, 2005, 22: 369-378.
[18]AGRAWAL M, PARDASANI D, LAKSHMANA-RAO P V.Evaluation of protective efficacy of CC-2 formulation against topical lethal dose of T-2 toxin in mice[J].Food and Chemical Toxicology,2012, 50(3/4): 1098-1108.
[19]DAENICKE S, KEESE C, GOYARTS T, et al.Effects of deoxynivalenol (DON) and related compounds on bovine peripheral blood mononuclear cells (PBMC)in vitroandin vivo[J].Mycotoxin Research, 2011, 27(1): 49-55.
[20]ERIKSEN G S, ALEXANDER J.Fusariumtoxins in cereals a risk assessment[M].Copenhagen: Nordic Council of Ministers, 1998: 7-27;45-58.
[21]付莹, 孟凡刚, 邓佳云, 等.2008年四川省阿坝州大骨节病相对活跃病区硒及T-2毒素水平调查[J].中国地方病学杂志, 2010, 29(3):325-329.
[22]王敏辉, 李吕木, 丁小玲.T-2 毒素研究进展[J].动物营养学报,2011, 23(1): 20-24.
[23]PESTKA J J.Deoxynivalenol: mechanisms of action, human exposure, and toxicological relevance[J].Archives of Toxicology, 2010, 84: 663-679.
[24]SOBROVA P, ADAM V, VASATKOVA A, et al.Deoxynivalenol and its toxicity[J].Interdisciplinary Toxicology, 2010, 3: 94-99.
[25]CHRISTIANE B, MARTINA R, MICHAEL W, et al.Expression of immune relevant genes in pigs under the influence of low doses of deoxynivalenol (DON)[J].Mycotoxin Research, 2011, 27(4): 287-293.
[26]PRELUSKY D B.The effect of low-level deoxynivalenol on neurotransmitter levels measured in pig cerebral spinal fluid[J].Journal of Environmental Science and Health: Part B, 1993, 28(6): 731-761.
[27]YOUNG J C, ZHOU T, HAI Y, et al.Degradation of trichothecene mycotoxins by chicken intestinal microbes[J].Food and Chemical Toxicology, 2007, 45: 136-143.
[28]IVERSON F, ARMSTRONG C, NERA E, et al.Chronic feeding study of deoxxynivalenol in B6C3F1 male female mice[J].Teratog Carcinog Mutagen, 1995, 15: 283-306.
[29]MONA A, DEEPAK P, LAKSHMANA-RAO P V.Evaluation of protective efficacy of CC-2 formulation against topical lethal dose of T-2 toxin in mice[J].Food and Chemical Toxicology, 2012, 50(3):1098-1108.
[30]CHAUDHARY M, RAO P V.Brain oxidative stress after dermal and subcutaneous exposure of T-2 toxin in mice[J].Food and Chemical Toxicology, 2010, 48(12): 3436.
[31]LATTANZIO V M T, PASCALE M, VISCONTI A, Current analytical methods for trichothecene mycotoxins in cereals[J].Trends in Analytical Chemistry, 2009, 28: 758-768.
[32]LANGSETH W, RUNDBERGET T.Instrumental methods for determination of nonmacrocyclic trichothecenes in cereals, foodstuffs and cultures[J].Journal of Chromatography A, 1998, 815: 103-121.
[33]SEIDEL V, FRAIBLER S, LANG C, et a1.Analysis of trace levels of trichothecene mycotoxins in Austrian cereals by gas chromatography with electron capture detection[J].Chromatographia, 1993, 37:191-201.
[34]中华人民共和国出入境检验检疫行业标准SN/T 1771—2006 进出口粮谷中T-2毒素的测定免疫亲合柱-液相色谱法[S].2006.
[35]CAHILL L M, KRUGER S C, MCALICE B T, et al.Quantification of deoxynivalenol in wheat using an immunoaffinity column and liquid chromatography[J].Journal of Chromatography A, 1999, 859: 23-28.
[36]REN Y, ZHANG Y, SHAO S, et al.Simultaneous determination of multi-component mycotoxin contaminants in foods and feeds by ultraperformance liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A, 2007, 1143(1/2): 48-64.
[37]DALL-ASTA C, SFORZA S, GALAVEMA G.Simultaneous detection of type A and type B trichothecenes in cereals by liquid chromatography electrospray ionization mass spectrometry using NaCl as cationization agent[J].Journal of Chromatography A, 2004, 1054:389-395.
[38]VALLE-ALGARRA fM, MEDINA A, GIMENO-ADELANTADO J V.Comparative assessment of solid-phase extraction cleanup procedures, GC columns and perfluoroacylation reagents for determination of type B trichothecencs in wheat by GC-ECD[J].Talanta, 2005, 66: 194-201.
[39]王晓春, 刘晓端, 杨永亮, 等.谷物中重要单端孢霉烯族毒素的检测方法[J].环境化学, 2010, 29(5): 802-809.
[40]中华人民共和国国家标准GB/ T 5009.111—2003谷物及其制品中脱氧雪腐镰刀菌烯醇的测定[S].2003.
[41]SINHA R C, MARC E.Production of monoclonal antibodies for the specific detection of DON and 15-acetyldeoxyivalenol by ELISA[J].Journal of Agricultural Food Chemistry, 1995, 43: 1740-1744.
[42]中华人民共和国国家标准GB/T 8381.4—2005, 配合饲料中T-2毒素的测定薄层色谱法[S].2005.
[43]SOKOLOVIC M, SIMPRAGA B.Survey of trichothecene mycotoxins in grains and animal feed in Croatia by thin layer chromatography[J].Food Control, 2006, 17: 733-740.
[46]SCHUHMACHER R, BERTHILLER F, BUTTINGER G, et al.Simultaneous determination of type A and B trichothemenes and Zearalenone in maize by high performance liquid chromatographytandem mass spectrometry[J].Mycotoxin Research, 2005, 4: 237-240.
[47]HAN Z, LIU X S, REN Y P, et al.A rapid method with ultra-highperformanc liquid chromatography-tandem mass spectrometry for simultaneous determination ofve type B trichothecenes in traditional Chinese medicines[J].Journal of Separation Science, 2010, 33:1923-1932.
[48]SANTINI A, FERRACANE R, SOMMA M C.Multitoxin extraction and detection of trichothecenes in cereals: an improved LC-MS/MS approach[J].Journal of the Science of Food and Agriculture, 2009, 89:1145-1153.
[49]BULLERMAN L B, BIANCHINI A L.Stability of mycotoxins during food processing[J].International Journal of Microbiology, 2007,119(1/2): 140-146.
[50]PARK B J, KOSUKE T, YOSHIKO S K, et al.Degradation of mycotoxin using microwave-induced argon plasma at atmospheric pressure[J].Surface and Coating Technology, 2007, 201(9/11):5733-5737.
[51]MURATA H, MITSUMATSU M, SHIMADA N.Reduction of feed-contaminating mycotoxins by ultraviolet irradiation: anin vitrostudy[J].Food Additives and Contaminants, 2008, 25(9): 1107-111.
[52]BRETZ M, BEYER M, CRAMER B, et al.Thermal degradation of theFusariummycotoxin deoxynivalenol[J].Journal of Agricultural and Food Chemistry, 2006, 54: 6445-6451.
[53]BRETZ M, KNECHT A, GOCKLER S, et al.Structural elucidation and analysis of thermal degradation products of the Fusarium mycotoxin nivalenol[J].Molecular Nutrition & Food Research, 2005,49: 309-316.
[54]YOUNG J C, ZHU H H, ZHOU T.Degradation of trichothecene mycotoxins by aqueous ozone[J].Food and Chemical Toxicology,2006, 44(3): 417-424.
[55]DANICKE S, VALENTA H, GAREIS M, et al.On the effects of a hydrothermal treatment of deoxynivalenol (DON)-contaminated wheat in the presence of sodium metabisulphite (Na2S2O5) on DON reduction and on piglet performance[J].Animal Feed Science and Technology,2005, 118: 93-108.
[56]SWANSON S P, HELASZEK C, BUCK W B, et al.The role of intestinal microflora in the metabolism of trichothecene mycotoxins[J].Food and Chemical Toxicology, 1988, 26: 823-829.
[57]SCHATZMAYR G, ZEHNER F, TAUBEL M, et al.Microbiologicals for deactivating mycotoxins[J].Molecular Nutrition and Food Research, 2006, 50: 543-551.
[58]ERIKSEN G S, PETTERSSON H, LUNDH T.Comparative cytotoxicity of deoxynivalenol, nivalenol, their acetylated derivatives and de-epoxy metabolites[J].Food and Chemical Toxicology, 2004,42: 619-624.
[59]FUCHS E, BINDER EM, HEIDLER D.Structural characterization of metabolites of the microbial degradation of type A trichothecenes by the bacterial strain BBSH797[J].Food Additives and Contaminants, 2002,19: 379-386.
[60]YOUNG J C, ZHOU T, HAI Y, et al.Degradation of trichothecene mycotoxins by chicken intestinal microbes[J].Food and Chemical Toxicology, 2007, 45: 136-143.
[61]UENO Y, NAKAYAMA K, ISHII K, et al.Metabolism of T-2 toxin inCurtobacteriumsp.strain 114-2[J].Applied and Environmental Microbiology, 1983, 46(1): 120-127.
[62]JARVIS B B, MAZZOLA E P.Macrocyclic and other novel trichothecenes: their structure, synthesis, and biological significance[J].Accounts of Chemical Research, 1982, 15: 388-395.
[63]MIROCHA C J, ABBAS H K, TREEFUL L, et al.T-2 toxin and diacetoxyscirpenol metabolism byBaccharisspp.[J].Applied and Environmental Microbiology, 1988, 54(9): 2277-2280.
[64]YOSHIZAWA T, SAKAMOTO T, OKAMOTO K.in vitroformation of 3’-hydroxy T-2 and 3’-hydroxy HT-2 toxins from T-2 toxin by liver homogenates from mice and monkeys[J].Applied and Environmental Microbiology, 1984, 47: 130-134.

