NdWO4(OH)粉体的微波水热法合成及其光催化性能
曹丽云, 安 平, 黄剑锋, 高彦峰
(1.陕西科技大学 材料科学与工程学院, 陕西 西安 710021; 2.上海大学 材料科学与工程学院, 上海 200444)
0 引言
近年来,光催化技术因其能够利用太阳能清洁能源分解水制氢及降解有机污染物,在环境污染净化和开发新能源改变能源结构方面具有深远意义,成为人们关注的焦点.开发洁净、高效的半导体光催化材料逐渐成为材料领域研究的重点课题[1].目前,钨酸盐系列半导体因其具有特殊的物理和化学性能而日益受到广泛的关注,尤其在太阳能光催化降解有机污染物、分解水制氢方面具有重要的应用[2-4].已被研究开发的钨酸盐半导体Bi2WO6[5,6]、ZnWO4[7,8]、CdWO4[9]、AgInW2O8[10]等均表现出了优异的光催化性能.同时,不断有学者研究发现稀土金属离子,如La3+、Sm3+、Nd3+、Eu3+等能够极大地优化半导体光催化剂的光催化性能[11-13],因此,研究开发稀土钨酸盐半导体材料对于光催化领域具有重大意义.本文主要研究碱式钨酸钕NdWO4(OH)的制备并探究其光催化性能.
目前,钨酸钕及碱式钨酸钕的制备方法主要有高温固相法[14]、提拉法[15]等,然而,这些方法均需要较高的温度,能耗较大,操作复杂且工艺过程难以控制,重复性较差.微波水热法因其具有反应周期短、节约能源且制备的粉体颗粒细小、尺寸均一等优点而逐渐受到研究者的青睐.本文利用微波水热法成功制备出了NdWO4(OH)粉体,并探究了其光催化性能,为稀土钨酸盐半导体的进一步开发和运用提供依据.
1 实验部分
1.1 试剂
Nd(NO3)3·6H2O(分析纯,山东省济宁市中凯新材料公司),Na2WO4·2H2O(分析纯,天津市天力化学试剂有限公司),罗丹明B(分析纯,国药集团化学试剂有限公司),浓HNO3(分析纯,北京化工厂),NaOH(天津市恒兴化学试剂制造有限公司).
1.2 样品的制备与表征
1.2.1 样品的制备
将4 mmol的Nd(NO3)3·6H2O与2 mmol的Na2WO4·2H2O分别溶于20 mL的去离子水中,配置成0.2 mol/L的Nd(NO3)3溶液和0.1 mol/L的Na2WO4溶液,然后将Na2WO4溶液缓慢加入到Nd(NO3)3溶液中,将混合液磁力搅拌30 min,以确保所有反应试剂均匀分散,用稀HNO3和NaOH溶液调节混合液的pH值至7.0,从而制得前驱液.然后将前驱液转移至100 mL聚四氟乙烯反应釜中,填充比为40%,密封反应釜,将其放入MDS-10型微波水热反应仪(上海新仪微波化学科技有限公司)中,在160 ℃~200 ℃反应90 min,冷却至室温后取出混合液,离心后用去离子水和无水乙醇洗涤,在60 ℃真空干燥箱中干燥,并用玛瑙研钵研磨,得到淡紫色粉状样品.
1.2.2 样品的表征
通过日本理学公司Dmax2200PC型自动X射线衍射仪(X-ray Diffraction,XRD)鉴定样品的物相结构;通过JSM-6700型场发射扫描电子显微镜(Field Emission Scanning Electron Microscope,FE-SEM)观察样品的形貌尺寸及分布;通过BL-GHX-V型光化学反应仪(西安比朗生物科技有限公司)和UV-2600A型紫外可见分光光度计(上海尤尼柯仪器有限公司)测试样品的光催化性能,以500 W汞灯作为紫外光光源,以罗丹明B溶液为有机染料,初始浓度为20 mg/L,样品的浓度为1 g/L.
2 结果与讨论
2.1 物相组成分析
图1所示为反应体系pH=7.0、不同温度下反应90 min所合成NdWO4(OH)粉体的XRD图谱,从图中可以看出:在温度为160 ℃、180 ℃、200 ℃、220 ℃时均可以合成NdWO4(OH)纯相(JCPDS No.74-1798),且当温度为160 ℃时,所生成的NdWO4(OH)衍射峰强度较高,峰型较为尖锐,晶型发育良好,结晶性较高;当温度升高至180 ℃,衍射峰峰形仍较为尖锐,但其中一些衍射峰的强度相较于160 ℃时略有下降;当温度为200 ℃时,这些衍射峰的强度进一步下降;当温度升至220 ℃时,衍射峰峰型变宽,结晶性变差,且峰强相较于160 ℃时有所降低.
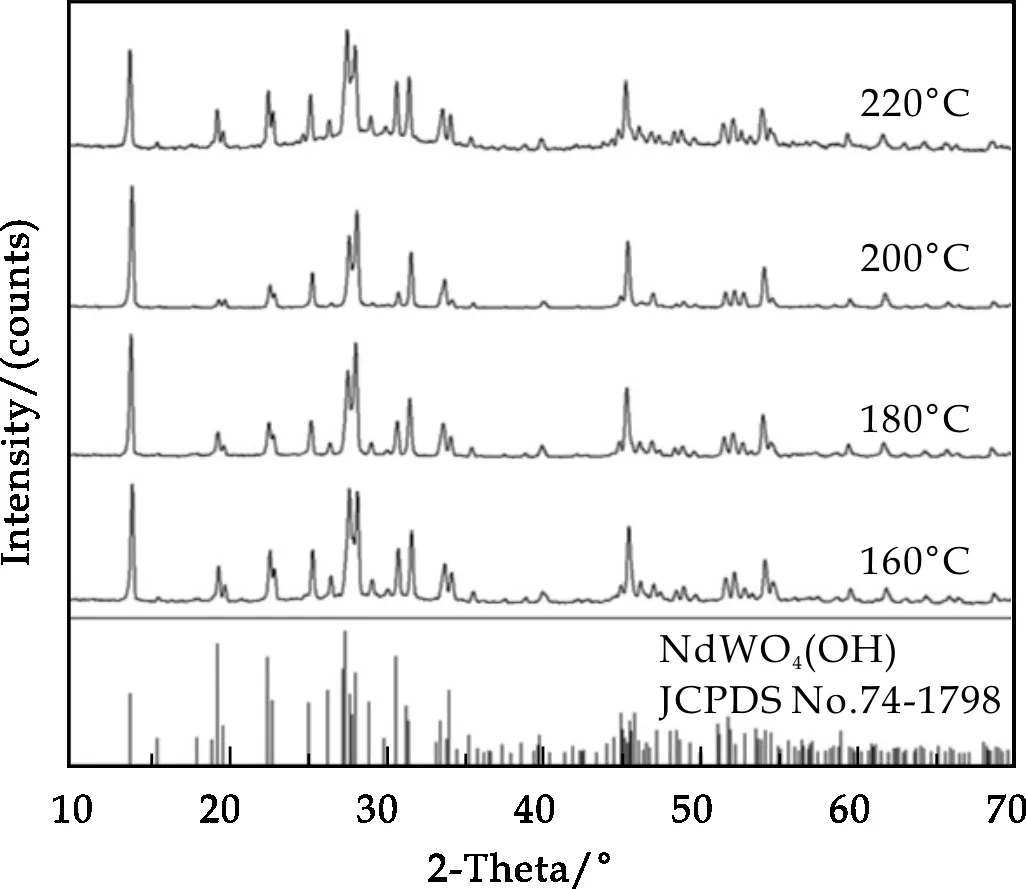
图1 不同合成温度下合成的NdWO4(OH)粉体的XRD图谱
2.2 SEM分析
图2所示为反应体系pH=7.0、不同温度下反应90 min所合成NdWO4(OH)粉体的SEM照片, 可以看出:按照上述工艺用微波水热法合成的NdWO4(OH)粉体微观形貌呈无序分布的薄片状,其上附有团聚的细小颗粒.当温度为160 ℃时,颗粒尺寸较大且数量较少,薄片状结构相对较多(图a);当温度升至180 ℃时,颗粒数量较少,稀疏分布在薄片上,薄片尺寸较大(约为5μm)(图b);当温度为200 ℃时,颗粒数量有所增多,且变得细小而稠密(图c);当温度升至220 ℃时,颗粒数量明显增多,颗粒尺寸变小,稠密地附着在薄片表面,薄片尺寸有所减小(约为3μm)(图d).

图2 不同合成温度下合成的NdWO4(OH)粉体的FESEM照片
引起这一现象的主要原因可能是温度影响了晶体的形核率[16],当温度较低时,形核率较低,体系中形成晶核较少,溶液中的原子从液相中转移到晶核表面使之逐渐长大,易形成较为粗大的薄片,此时,晶体呈现出较好的结晶性;当温度升高时,形核率随之增大,体系中形成的晶核逐渐增多,液相中的原子聚集到众多晶核表面,易形成团聚的细小颗粒,从而,相比于低温时结晶性较差,这一现象与上述XRD结果相符.
2.3 紫外光下NdWO4(OH)粉体的光催化性能
图3所示为pH=7.0、200 ℃反应90 min合成的NdWO4(OH)粉体作为催化剂时RhB溶液在紫外光催化降解下光谱随时间的变化曲线,图4为降解过程的降解率-时间曲线,从图4中可以看出:在加入NdWO4(OH)作为催化剂的条件下,紫外光照射120 minRhB溶液的降解率达到93.0%.降解初,RhB溶液的最大吸收峰在553 nm处,随着降解过程的进行,最大吸收波长处的吸光度逐渐降低,且最大吸收波长由553 nm变为542 nm,吸收峰发生蓝移,这是由于在紫外光的照射下,RhB的结构发生了变化引起的,这一现象表明RhB溶液正逐步被降解.同时,由图中可看出,RhB溶液在250 nm处有一较明显的次吸收峰,随着降解的进行,这一吸收峰逐渐消失,也表明RhB溶液正在被降解.最终,溶液变为无色透明,RhB几乎被完全降解.
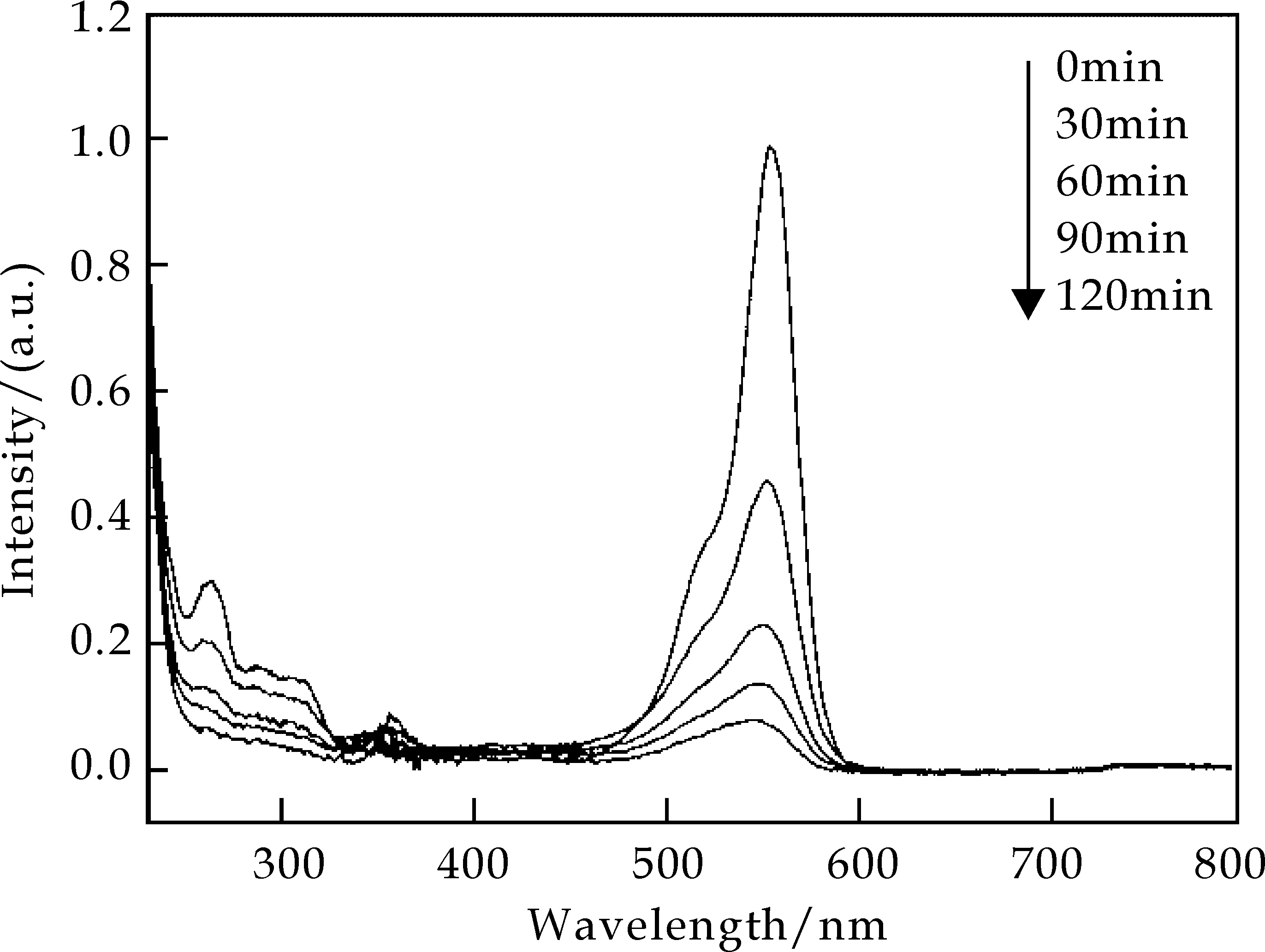
图3 200 ℃制备的NdWO4(OH)粉体作为催化剂时RhB溶液在紫外光催化降解下光谱随时间的变化
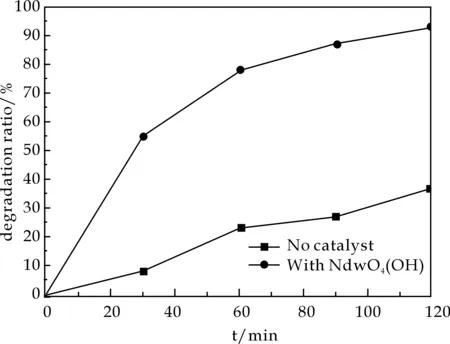
图4 200 ℃制备的NdWO4(OH)粉体作为催化剂时RhB溶液在紫外光下的降解率-时间曲线
3 结论
以Nd(NO3)3·6H2O和Na2WO4·2H2O为原料,采用微波水热法在160 ℃~220 ℃反应90 min成功制备出NdWO4(OH)粉体,研究了不同合成温度对NdWO4(OH)粉体晶体结构和微观形貌的影响.结果表明:不同的合成温度对NdWO4(OH)的晶体结构和微观形貌均有一定影响.对200 ℃合成的NdWO4(OH)粉体在紫外光照射下测定了其光催化性能,结果发现,在紫外光下照射120 min,NdWO4(OH)粉体对RhB溶液的降解率达93.0%.
[1]韩世同,习海玲,史瑞雪,等.半导体光催化研究进展与展望[J].2003,16(5):309-319.
[2]A.D.Paola,E.G.Lopez.A survey of photocatalytic materials for environmental remediation[J].Journal of Hazardous Materials,2012(211-212):3-29.
[3]Tiziano Montini,Valentina Gombac,Abdul Hameed.Synthesis,characterization and photocatalytic performance of transition metal tungstates[J].Chemical Physics Letters,2010(498):113-119.
[4]U.M.Garcia-Perez,A.Martinez-de la Cruz,J.Peral.Transition metal tungstates synthesized by co-precipitation method:Basic photocatalytic properties[J].Electrochimica Acta,2012(81):227-232.
[5]Jinyun He,Weimin Wang.Hydrothermal synthesis of hierarchical rose-like Bi2WO6microspheres with high photocatalytic activities under visible-light irradiation[J].Materials Science and Engineering B,2012(177):967-974.
[6]S.Obregon Alfaro,A.Martinez-de la Cruz.Synthesis,characterization and visible-light photocatalytic properties of Bi2WO6and Bi2W2O9obtained by co-precipitation method[J].Applied Catalysis A:General,2010(383):128-133.
[7]K.M.Garadkar,L.A.Ghule,K.B.Sapnar,et al.A facile synthesis of ZnWO4nanoparticles by microwave assisted technique and its application in photocatalysis[J].Materials Research Bulletin,2013(48):1 105-1 109.
[8]Shen Lin,Jiebo Chen,Xiulan Weng,et al.Fabrication and photocatalysis of mesoporous ZnWO4with PAMAM as a template[J].Materials Research Bulletin, 2009(44):1 102-1 105.
[9]Tingjiang Yan,Liping Li,Wenming Tong,et al.CdWO4polymorphs:Selective preparation,electronic structures,and photocatalytic activities[J].Journal of Solid State Chemistry,2011(184):357-364.
[10]Tang J,Zou Z,Ye J.Photophysical and photocatalytic properties of AgInW2O8[J].Journal of Physical Chemistry B,2003,107(51):14 265-14 269.
[11]V.Stengl,S.Bakardjieva,N.Murafa.Preparation and photocatalytic activity of rare earth doped TiO2nanoparticles[J].Materials Chemistry and Physics,2009(114):217-226.
[12]Wang Cong,Cao Lin.Preparation,spectral characteristics and photocatalytic activity of Eu3+-doped WO3nanoparticles[J].Journal of Rare Earths,2011,29(8):727-731.
[13]Yu Tian,Lide Zhang,Junxi Zhang.A superior visible light-driven photocatalyst:Europium-doped bismuth tungstate hierarchical microspheres[J].Journal of Alloys and Compounds,2012(537):24-28.
[14]P.Urbanowicz,E.Tomaszewicz,T.Gron,et al.Magnetic properties of R2WO6(where R=Nd, Sm, Eu, Gd, Dy and Ho)[J].Physica B,2009(404):2 213-2 217.
[15]臧竞存,刘燕行,方 方,等.钨酸钕单晶光谱及其上转换发光[J].中国稀土学报,2001,19(1):5-8.
[16]施尔畏.水热结晶学[M].北京:科学出版社, 2004:36-38.

