基于四尾栅藻响应的有机磷农药生态风险评估
孙凯峰,王 娜,刘莉莉,段舜山
(暨南大学水生生物研究中心,广东普通高校水体富营养化与赤潮防治重点实验室,广东 广州 510632)
据报道,欧盟2008年和中国2005年农药喷洒量分别达到了14万t和100万t以上,然而经济利益驱使下的不合理甚至是随意滥用导致的农药残留却带来了严重的生态环境危害及食品安全问题[1-3].有机磷农药随农业灌溉、雨水冲刷、淋溶等过程进入构成水域生态系统门户的池塘、河流等水体并对“非靶目标生物”作用相关的研究已有大量报道[4-7].高浓度有机磷农药残留对浮游植物的毒害作用可概括为:抗氧化系统伤害、光合作用受抑制、胞内生化组分合成受阻、遗传物质合成破坏等[8-10];而其对水生动物的毒害作用则主要包括神经毒性、抗氧化系统损伤、行为干扰等[11-13].有机磷农药对初级消费者浮游动物的干扰作用间接导致了该生态系统浮游植物群落组成和稳定性[8,14].同时,由于藻类耐受性差异,有机磷农药直接作用浮游植物导致其群落组成和结构的变化也能够影响生态系统的健康和稳定[15-17].另外,研究者也注意到了有机磷农药刺激微藻生长这一现象并对其可能机理进行了探讨[18-22].然而,蓝、绿藻的“藻华”暴发的诱导因素及发生机理仍无统一定论[15,23-26].然而,淡水生态系统中存在磷限制的传统观念也引起了对有机磷类化合物作用的关注,尤其是在“藻华”暴发区域和频率都不断增加的状况下.本文意在模拟一次有机磷农药喷洒后经历的高浓度残留阶段、稀释后的中等残留阶段以及吸附沉降后的低浓度存在阶段三个自然过程,探索该过程中典型微藻四尾栅藻的生理生态响应程度.进一步揭示有机磷农药喷洒对水域生态系统中浮游植物种群动态响应的生理机制,探索有机磷作为磷源下藻类的生理过程变化差异并为有机磷农药生态风险的科学、准确评估提供参考.
1 材料与方法
1.1 实验材料
实验所用的四尾栅藻(S. quadricanda)分离自暨南大学明湖“藻华”过程,采用BG-11培养基培养,并保存于暨南大学水生生物研究中心藻种室.BG-11培养基主要成分和含量分别是:NaNO3,K2HPO4,MgSO4·7H2O,CaCl2·2H2O,Na2CO3,EDTANa2,柠檬酸,柠檬酸铁铵溶液,微量元素,其工作液含量分别为 1.5,0.04,0.075,0.036,0.02,0.001,0.006,0.006g/L.
实验用市售毒死蜱浓度为40%(博乐牌)、草甘膦异丙胺盐浓度为41%(农达).有机磷农药使用前配置,实验中的药物浓度均按照P原子摩尔质量设定.
1.2 实验设计及培养条件
高浓度毒死蜱和草甘膦对四尾微藻生长的毒性效应实验:参考藻类急性毒性试验要求,将处于指数期的微藻接种到新鲜培养基中后分装到 150mL三角瓶中,然后根据预实验结果,分别添加6个浓度的农药后进行第二次分装.50mL玻璃管(Schott Duran, Germany)中分装 40mL加药后的藻液,藻细胞起始密度为(2.6~3.0)×105个/mL.草甘膦浓度设定为:2.95,5.90,11.80,23.59,47.19,94.37μmol/L;毒死蜱浓度设定为:0.46,0.91,1.83,3.66,7.31,14.63μmol/L.每组设3个平行,并设不加药处理组为对照.
低浓度毒死蜱和草甘膦对四尾栅藻生长的刺激效应实验:毒死蜱处理组藻细胞起始密度为8.5×105个/mL,浓度设定为:0.021,0.214,2.14μmol/L;草甘膦处理组藻细胞起始密度为3.8×105个/mL,浓度设定为:0.014,0.135,1.35μmol/L.将处于指数生长期的藻细胞浓缩后接种到不同浓度处理组中,然后分装150mL藻液到200mL三角瓶中.每组设3个平行,并设不加药处理组为对照.
磷饥饿处理后四尾栅藻在毒死蜱和草甘膦作为唯一磷源下的生长实验:将培养 14d的四尾栅藻离心(3000r/min,5min,24℃)后重新接种到无菌蒸馏水进行饥饿处理3d,以消耗藻细胞体内储存的磷.然后将藻细胞离心浓缩后接种到不添加无机磷的BG-11培养液中,分装到500mL三角瓶中加入相应浓度的农药.草甘膦浓度设定为:0.13,0.27,0.40,0.54,0.67μmol/L;毒死蜱浓度设定为:0.03,0.06,0.09,0.11,0.14μmol/L.混匀后再次分装150mL藻液到200mL三角瓶中.每组设3个平行,并设不加药处理组为对照.
实验在人工气候培养箱(CC275TL-2H, Xutemp)中进行一次性培养,光照强度 90μmol/ (m2·s),温度为(24±1)℃.每天早中晚采用微型漩涡混合仪(XW-80A,江苏)连续震荡(2800r/min)混匀藻液,并随机更换玻璃试管位置,以避免光照不均匀带来的影响.
1.3 观测指标
藻细胞数目:混匀后取样 100μL,加入到血球计数板中,并在显微镜下计数全片.
藻细胞叶绿素荧光值:采用叶绿素荧光仪(TD-700,Turner Design)测定.取样后进行20min的黑暗处理,若浓度高于检测线则采用蒸馏水稀释后测定.
藻细胞最大光能转化效率(Fv/Fm):采用植物效率仪(Handy PEA, Hansatech)测定.取样后进行20min的黑暗处理,且测样过程也在黑暗条件下进行.
半数有效浓度(EC50):以浓度的对数值(log10)为横坐标,抑制率的百分数为纵坐标绘制曲线,通过回归分析获得相应的回归方程,并计算出半数有效浓度.
1.4 数据处理和分析
实验数据汇总和绘图 origin8.0,统计学分析采用SPSS 13.0进行线性回归(Linear Regression)和单因素方差分析(One-way ANOVA),并采用LSD进行多重比较.
2 结果与分析
2.1 草甘膦和毒死蜱对四尾栅藻的毒性效应
四尾栅藻培养液中添加有机磷农药草甘膦和毒死蜱对其生长均表现出显著的剂量效应,农药浓度的增加,四尾栅藻的叶绿素荧光值受到的抑制效应显著增强(图1).处理组四尾栅藻叶绿素荧光值受到的抑制程度与有机磷农药 P原子浓度(μmol/L)之间存在显著的正相关关系,除草剂草甘膦和杀虫剂毒死蜱对四尾栅藻生长的 96h EC50值分别为 12.98,2.02μmol/L.
2.2 草甘膦和毒死蜱对四尾栅藻生长和最大光能转化效率的刺激效应

图1 草甘膦和毒死蜱(μmol/L)对四尾栅藻叶绿素荧光值的影响及急性毒性分析Fig.1 Effect of glyphosate and chlorpyrifos (μmol/L) on fluorescence of chlorophyll a in S. quadricanda and the inhibitory rate under series of concentrations (log C)
四尾栅藻培养液中添加低浓度草甘膦和毒死蜱其细胞密度和最大光能转化效率变化如图2所示.添加低浓度草甘膦对四尾栅藻最大光能转化效率和细胞密度均能够表现出显著的刺激作用(图 2).低浓度草甘膦(<0.135μmol/L)对四尾栅藻细胞密度表现出显著的刺激效应.0.014,0.135μmol/L草甘膦处理组第 6d的细胞密度分别比对照组增加了13%和10%,表现出显著的刺激效应(P<0.05).从最大光能转化效率上,草甘膦也表现出显著的刺激作用,0.014和 1.35μmol/L草甘膦处理组第6d的促进效应比对照组增加了6.0%和 7.1%(P<0.05).低浓度毒死蜱对四尾栅藻细胞密度仍表现出了显著的抑制效应(图2),而在最大光能转化效率上,仅第5,6d时处理组高于对照组.2.14μmol/L处理组Fv/Fm比对照组增加了11.6%,表现出显著的刺激效应(P<0.05).

图2 低浓度草甘膦和毒死蜱(μmol/L)对四尾栅藻细胞密度和最大光能转化效率的影响Fig.2 Effect of glyphosate and chlorpyrifos (μmol/L) on cell density and Fv/Fm in S. quadricanda under low concentrations (μmol/L)
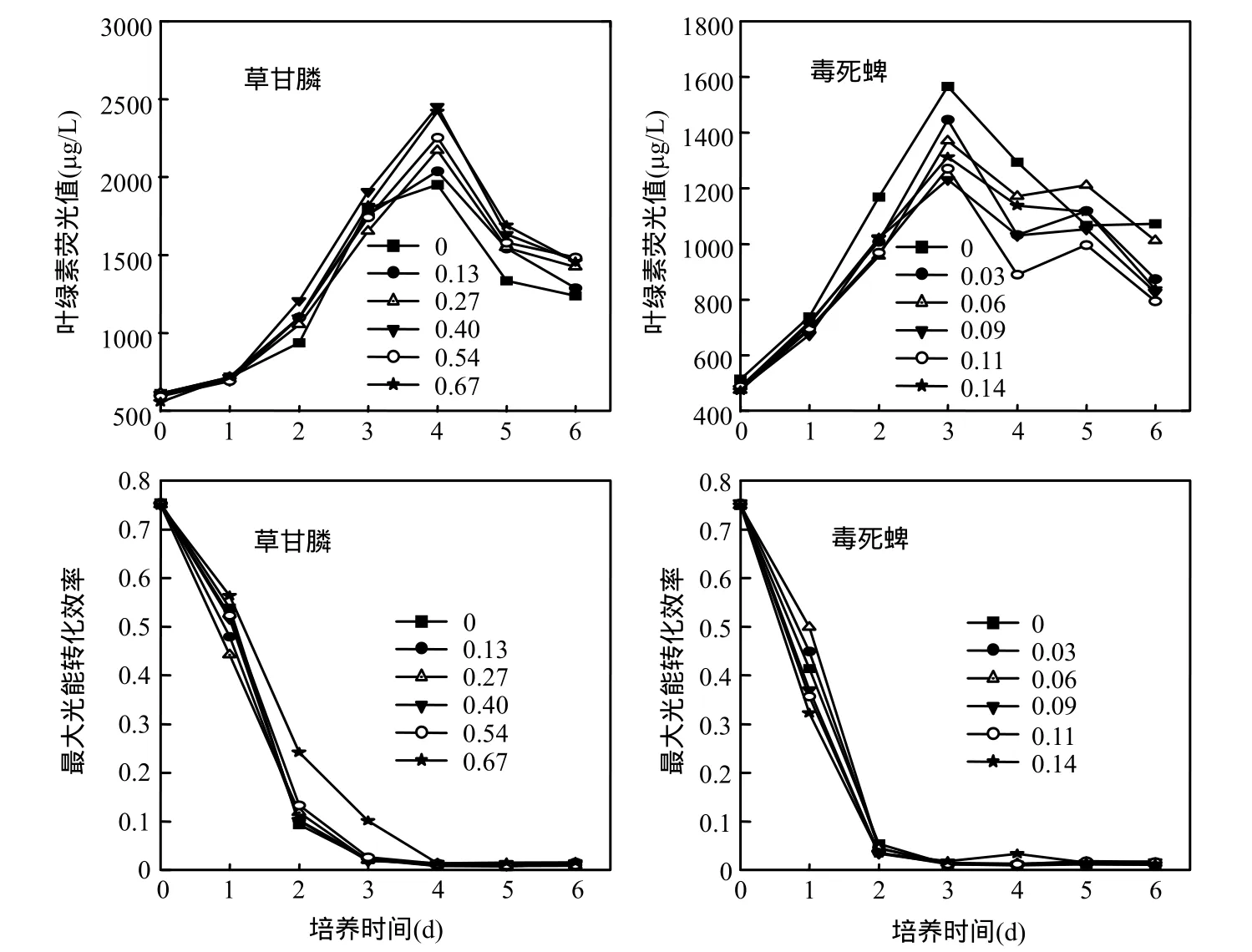
图3 磷饥饿处理后四尾栅藻在草甘膦和毒死蜱作为唯一磷源下的叶绿素荧光和Fv/Fm变化Fig.3 Fluorescence of chlorophyll a and Fv/Fm in S. quadricanda treated with glyphosate and chlorpyrifos (μmol/L) as unique phosphorus in after phosphorus starvation in preculture
2.3 草甘膦和毒死蜱对磷缺失培养液中四尾栅藻磷源的替代效应
经过无菌蒸馏水饥饿处理3d的四尾栅藻接种到草甘膦和毒死蜱作为磷源下的生理生长情况如图 3所示.四尾栅藻以草甘膦作为唯一磷源下的叶绿素荧光值均高于对照组,0.4μmol/L处理组在第4d比对照组增加了30.8%,表现出显著促进作用.但第 6d的促进作用有所降低,仅为18.0%(图3).从Fv/Fm变化上看,0.67μmol/L草甘膦处理组显著减缓了Fv/Fm的降低,第2,4d分别是对照组的2.1倍和1.7倍(P<0.05).以毒死蜱作为唯一磷源下的叶绿素荧光值在实验中也表现出毒性效应,Fv/Fm仅0.03和0.06μmol/L处理组第1d比对照组增加了5.2%和16.8%(图3).
3 讨论
有机磷农药多为磷酸酯类或硫代磷酸酯类,基本构型以P原子为中心连接4个取代基(R1、R2、Z、X).其中,R1、R2多为甲氧基(-CH3O)或乙氧基(-C2H5O);Z为氧(O)或硫(S)原子;X为烷氧基、芳氧基或其他取代基团.有机磷农药的毒性与其中心P原子的电正性直接相关,取代基种类和结构通过影响 P原子电荷分布影响其毒性效应[7].同时,有机磷农药直接或分解后被藻类利用所提供的营养元素最主要的也是P.因此,可以根据P原子的摩尔质量开展有机磷农药的生态效应研究.
有机磷农药在农业上的应用可间接导致水体有机磷农药残留的增加,而水产养殖业中的有机磷杀虫剂和杀菌剂的应用可直接导致水体的有机磷农药污染.一次有机磷农药喷洒(0.15g/m2)可导致水深 30cm,表面积666.67m2水塘产生1μg/L的农药残留[27].以磷酸酯类或硫代磷酸酯类经典的结构式计算其最小分子量在220左右,按照P原子计算一次农药喷洒后残留的有机磷农药残留量为4.55μmol/L.有机磷农药对淡水微藻的急性毒性效应尽管存在种间差异,但其急性毒性浓度范围多为μmol/L数量级.本实验中选取的草甘膦和毒死蜱对四尾栅藻的急性毒性 96hEC50值分别为12.98μmol/L 和 2.02μmol/L,毒死蜱毒性显著高于草甘膦.这一现象从化学结构上看,毒死蜱取代基可诱导P原子产生高电正性,而草甘膦仅由甘氨酸异丙胺盐取代了一个-OH;从作用特征上看,毒死蜱类杀虫剂作用四尾栅藻主要是降低藻细胞体内胆碱酯酶活性、产生抗氧化损伤、增加细胞膜通透性等[8-9,19],而草甘膦主要作用于藻细胞内烯醇丙酮基莽草素磷酸合成酶,通过抑制莽草素向苯丙氨酸、酷氨酸及色氨酸的转化,使蛋白质的合成受到干扰导致植物死亡[21-22].因此,草甘膦作用的专一性也是限制其毒性强度的重要因素.
有机磷农药进入水体后的吸附和沉降导致其浓度逐渐降低,有研究者发现一定浓度的有机磷农药会刺激藻类的生长并可能诱发特殊条件下某些种类微藻的“水华”.有机磷农药对微藻的刺激作用表现在叶绿素和蛋白质含量增加、DNA和RNA合成速度升高、抗氧化系统活性增强,光合作用速率提高以及营养盐吸收速率增加等[18-20].如:低于22.7μmol/L的甲胺磷和0.34μmol/L的辛硫磷能够促进显著铜绿微囊藻(Microcystis aeruginosa)的生长[23],5.2μmol/L对硫磷显著提高了三角褐指藻的生长速率[17].本研究中也进一步证实这一现象,添加低浓度草甘膦能够显著促进四尾栅藻细胞密度增加以及最大光能转化效率的升高,藻细胞密度和最大光能转化效率的刺激作用最大值分别为 13%和 7%.然而,本实验也发现毒死蜱在显著低于其EC50浓度下仍未检测出刺激作用,这可能受实验选取观察指标的限制或毒死蜱浓度设定的限制等.谢荣等[19]在探讨丙溴磷对微藻刺激效应和毒性作用的机理中提出了抗氧化系统响应程度差异引发不同生理反应的观点,从污染物引发胞内活性氧含量的程度差异以及引发脂质过氧化水平变化上揭示有机磷农药的作用机制.然而,也有研究者认为藻细胞可以通过利用有机磷作为磷源,进而促进藻类的生长[24-25].辛硫磷浓度介于67.1~ 335.2nmol/L条件下可作为磷源维持滇池微囊藻的生长[23],铜绿微囊藻在无机磷缺乏的条件下易成为优势种,而斜生栅藻在无机磷充足条件下占优势[26].本实验中,草甘膦能够较显著地弥补培养液中无机磷缺失对四尾栅藻生长的限制,然而这仅局限在较短的时间内.从最大光能转化效率上看,所有无机磷缺失条件下的四尾栅藻光合作用均收到显著的抑制.毒死蜱对培养液中无机磷缺失下四尾栅藻不仅没有促进作用,反而表现出了抑制或毒害作用.
综合以上结果,有机磷农药喷洒后进入水体的残留对水体初级生产者浮游植物的影响以低浓度下的刺激作用为主.同时,某些种类的有机磷农药可一定程度上作为磷源供藻类生长所需,即可引发特殊种类微藻优势种的形成或“水华”的暴发.另外,农药喷洒对初级消费者浮游动物种群的毒害作用及由此引发的摄食压力降低在浮游植物群落结构变化中的作用也值得关注.
4 结论
4.1 草甘膦和毒死蜱对四尾栅藻均表现出显著的毒害作用,毒性强弱受P原子电正性影响显著.
4.2 除草剂草甘膦能够显著刺激四尾栅藻的生长和光能转化效率,其浓度为0.014~1.35μmol/L.
4.3 四尾栅藻能够利用草甘膦作为唯一磷源,表明草甘膦可刺激四尾栅藻生长.
[1] Yanggen D, Cole D C, Crissman C, et al. Pesticide use in commercial potato production: Reflections on research and intervention efforts towards greater ecosystems health in Northern Ecuador [J]. EcoHealth, 2004, 1(Suppl.2):72-83.
[2] Fenik J, Tankiewicz M, Biziuk M. Properties and determination of pesticides in fruits and vegetables [J]. TrAC Trends in Analytical Chemistry, 2011,30(6):814-826.
[3] 贺红武.有机磷农药的现状与发展趋势 [J]. 世界农药, 2008,20(6):29-33.
[4] Casida J E, Quistad G B. Organophosphate toxicology: safety aspects of non-acetylcholinesterase secondary targets [J].Chemical Research in Toxicology, 2004,17(8):983-998
[5] Hildebrandt A, Lacorte S, Barceló D. Assessment of priority pesticides,degradation products and pesticide adjuvants in ground waters and top soils from agricultural areas of the Ebro river basin [J]. Analytical and Bioanalytical Chemistry, 2007,384(4):1459-1468.
[6] Schiff K, Sutula M. Organophosphorus pesticides in storm-water runoff from southern California (USA) [J]. Environmental Toxicology and Chemistry, 2004,23(8):1815-1821.
[7] Yen J, Donerly S, Levin E D, et al. Differential acetylcholinesterase inhibition of chlorpyrifos, diazinon and parathion in larval zebrafish[J]. Neurotoxicology and Teratology, 2011,33(6):735-741.
[8] Sabater C, Carrasco J M. Effects of pyridaphenthion on growth of five freshwater species of phytoplankton. A laboratory study [J].Chemosphere, 2001,44(8):1775-1781.
[9] 唐学玺,于 娟,李永祺.久效磷对海洋微藻细胞的活性氧伤害[J]. 海洋与沼泽, 2001,3,32(2):155-158.
[10] 蔡阿根,李文权,郑爱榕.有机磷农药对海洋微藻的若干生物学效应[J]. J. 厦门大学学报(自然科学版), 1999,7,38(4):598-593.
[11] Bock C W, Larkin, J D, Hirsch S S, et al. Nucleophilic destruction of organophosphate toxins: A computational investigation [J]. J. Molecular Structure, 2009,915(1-3): 11-19.
[12] Sparling D W, Fellers G. Comparative toxicity of chlorpyrifos,diazinon, malathion and their oxon derivatives to larvalRana boylii[J]. Environmental Pollution, 2007,147(3):535-539.
[13] 黎艳霞,杨俭美.4种杀虫药剂对大型蚤(Daphnia magna)的毒性和酶活性影响的比较 [J]. 北京大学学报(自然科学版), 1997,3,2(33):197-202.
[14] Ren Z M, Li Z L, Zha J M, et al. The avoidance responses ofDaphnia magnato the exposure of organophosphorus pesticides in an on-line biomonitoring system [J]. Environmental Modeling and Assessment, 2009,14(3):405-410.
[15] Kent R A, Currie D. Predicting algal sensitivity to a pesticide stress [J]. Environ. Toxicol. Chem., 1995,14(6): 983-991.
[16] 王 悠,唐学玺,李永祺.蒽与有机磷农药对海洋微藻的联合毒性 [J]. 海洋科学, 2000,24(4):5-7.
[17] 唐学玺,李永祺.4种海洋微藻对久效磷的抗性与其抗氧化能力的相关性 [J]. 海洋与湖沼, 2000,31(4):414-418.
[18] 金相灿,郑朔方.有机磷和无机磷对铜绿微囊藻生长的影响及动力学分析 [J]. 环境科学研究, 2006,19(5):40-44.
[19] 谢 荣,唐学玺,李永祺,等.丙溴磷影响海洋微藻生长机理的初步研究 [J]. 环境科学学报, 2000,20(4):473-477.
[20] 张 磊,段舜山,孙凯峰,等.有机磷农药草甘膦异丙胺盐对球形棕囊藻的刺激效应 [J]. 生态环境学报, 2010,19(1):51-56.
[21] 张 哲,王江涛,谭丽菊.草甘膦对旋链角毛藻和盐生杜氏藻的毒性兴奋效应 [J]. 生态毒理学报, 2010,5(5):685-691.
[22] Cedergreen N. Is the growth stimulation by low dose of glyphosate sustained over time? [J]. Environmental pollution, 2008,156(3):1099-1104.
[23] 沈 宏,宋立荣,周培疆,等.有机磷农药对滇池微囊藻生长和摄磷效应的影响 [J]. 水生生物学报, 2007,31(6):863-868.
[24] Tian S Z, Liu Z, Weng J H, et al. Growth ofGhlorella vulgarisin cultures with low concentration dimethoate as source of phosphorus [J]. Chemosphere, 1997,35(11):2713-2718.
[25] 钱善勤,孔繁翔,张 民,等.铜绿微囊藻和蛋白核小球藻对不同形态有机磷的利用及其生长 [J]. 湖泊科学, 2010,22(3):411-415.
[26] 许 海,杨林章,茅 华,等.铜绿微囊藻、斜生栅藻生长的磷营养动力学特征 [J]. 生态环境, 2006,15(5):921-924
[27] 蔡道基.农药环境毒理学研究 [M]. 北京:中国环境科学出版社,1999:100-134.

