颈椎前路减压融合内固定术后食道功能障碍的临床研究
李超 何勍 阮狄克
(海军总医院骨科,北京100048)
目前在颈椎前路单节段和多节段融合术中使用接骨板已经成为标准的手术方法之一,无论是在颈椎退行性变、创伤还是颈椎肿瘤的治疗中都大量使用接骨板。颈椎接骨板的使用可以改善前路融合术后的即刻稳定性并提高融合率。术中食道损伤、食道瘘作为严重的并发症已得到很多的关注,而无术中食道损伤的术后食道功能障碍,发生隐匿,大部分患者病情轻微,但发生率高[1,2]。食道功能障碍表现为进食液体或固体食物时出现困难现象,颈椎前路手术所导致的功能障碍主要表现在食道的咽部及起始部的食物下送困难,严重者可引起气道的不适。为明确颈椎前路减压植骨融合内固定对食道功能的远期影响及相关因素,本研究对2008年1月开始因颈椎病及颈椎间盘突出行前路椎间盘摘除或椎体切除、植骨融合内固定的病例进行回顾分析。
1 资料与方法
1.1 临床资料
选取2008年1月至2009年12月连续诊治的94例颈椎病患者为研究对象,所有患者术前明确既往无食道疾患病史,无食道功能障碍。手术方式采取单椎间盘切除或单椎体次全切除,植骨材料均取自于切除椎体颗粒骨,填入钛笼或cage植骨。所有患者均行前路接骨板内固定,材料包括Orion、Zephir及ABC接骨板。
1.2 手术操作要点
患者全麻,右侧入路。单节段椎间盘切除采用横切口,椎体切除采用斜切口。常规暴露拟切除椎间盘或椎体,彻底减压后牵引下植入cage或钛笼,椎体前方安装接骨板固定。术后常规使用广谱抗生素3~5 d,糖皮质激素、脱水剂及雾化吸入3 d。术后24~48 h拔除引流管,随后带围领离床康复锻炼。围领佩戴时间为4~8周。
1.3 观测指标
术后3、6、12及24个月时分别进行电话随访,评估食道功能。食道功能评价采用Bazaz等[2]的食道功能分级标准(表1)。

表1 食道功能障碍评分系统
1.4 统计学方法
采用SPSS10.0统计软件进行分析。统计不同性别、不同手术方法下术后3、6、12、24个月食道功能障碍的发生率并进行方差分析。P<0.05为差异有统计学意义。
2 结果
共有75例(79.8%,75/94)患者获得完整随访,男43例,女32例,年龄42~68岁,平均54.2岁。病程4 d至84个月,平均14.2个月。脊髓型颈椎病62例(83%),颈椎间盘突出症13例(17%)。单节段前路椎间盘切除Cage植骨融合52例(69%),手术节段:C3-44例,C4-519例,C5-624例,C6-75例。前路单椎体次全切除植骨融合内固定合23例(31%),手术节段:C44例,C512例,C67例。54例患者完成门诊影像学随访,所有患者均无螺钉、接骨板松动、断裂及植骨块脱出、不融合、食管后间隙异位骨化等并发症。
术后3个月随访时,共有21例患者(男9例,女12例;轻度障碍14例,中度障碍4例,重度障碍3例)出现食道功能障碍,占随访病例的28%。术后6个月随访时,功能障碍患者减少至14例(男6例,女8例;轻度11例,中度2例,重度1例),占随访病例的21%。术后12个月随访时,功能障碍患者进一步减少至6例(男2例,女4例;轻度5例,中度1例),占随访病例的8%。术后2年随访时3例患者表现为功能障碍,均为女性,且均为轻度功能障碍。
随访时,采用前路单椎间盘切除融合患者和单椎体次全切除患者食道功能障碍的发生率分别为:3个月(19%∶49%),6个月(12%∶35%),12个月(4%∶17%),24个月(2%∶7%),在各时间节点,两种术式的食道功能障碍发生率差别显著(P<0.01)。男性与女性患者术后食道功能障碍的发生率分别为:3个月(12%∶16%),6个月(8%∶11%),12个月(3%∶5%),24个月(0%∶4%),在各时间节点,男女患者的食道功能障碍发生率存在差别,但除外24个月时,各时间点无显著性差别(P>0.05)。见表2。
3 讨论
颈椎前路减压、融合内固定术后食道出现功能障碍是一种常见的现象,由于其发病隐匿,而且多数患者的症状轻微,无需特殊治疗,从本组病例的随访结果可以看出,出现食道功能障碍的患者均未接受特殊治疗,大部分出现食道功能障碍的患者术后1年左右症状均有显著改善。
关于颈椎前路减压融合术后出现食道功能障碍的原因目前尚不明确,可能的原因包括局部血肿形成以及术中持续的食道牵拉损伤部分食道后壁的肌间神经组织导致肌肉收缩功能障碍。Smith-Hammond等[3]比较了颈椎前路、颈椎后路及腰椎后路三组患者术后发生食道功能障碍的发生率,结果显示在颈椎前路术后食道功能障碍的发生率为60%,腰椎后路术后食道功能障碍的发生率为0%,而颈椎后路术后的食道功能障碍的发生率为20%,这提示颈椎术后出现食道功能障碍的原因可能不仅是局部手术的刺激及接骨板的占位因素,颈椎术后整体曲度的改变也可能对食道的功能带来影响,而且这种影响是暂时性的。
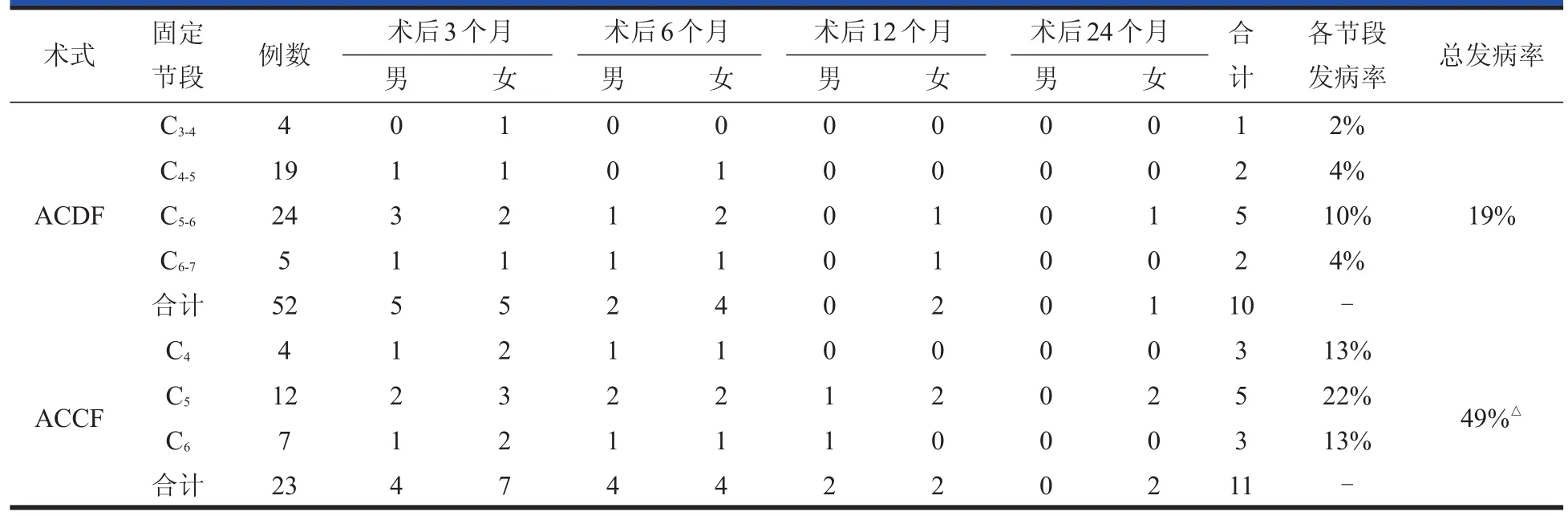
表2 颈椎前路减压融合术后各节段及随访各时间节点食道功能障碍的发病率( n=75)
颈椎前路减压植骨融合术后出现食道功能障碍的发生率报道不一,术后1周食道功能障碍的发生率从1%到79%,差别很大,原因可能在于对食道功能障碍的评价上[4,5]。目前尚无标准性的评价标准用来评估食道功能障碍。总体而言,术后1个月的食道功能障碍发生率在50%左右,术后1年在15%左右[5,6]。本组病例术后食道功能障碍的发生率及转归趋势基本符合该规律,随着术后康复的进行,食道功能障碍的发生率及严重程度呈显著性的下降,至术后2年存在食道功能障碍的病例很少,且程度均较轻。
根据目前的研究,颈椎前路手术后出现食道功能障碍的相关因素包括以下几个方面:手术节段的长短、部位,减压方式,内固定类型以及性别、年龄、是否初次手术等。本研究提示手术部位位于C4-5及C5-6节段的病例术后出现食道功能障碍的比率较高,而C3-4节段术后出现食道功能障碍较少,可能与本组病例中C3-4节段病例数目较少有关。Chin等[7]报道固定至C3-4节段的病例术后更容易出现食道功能障碍,分析原因为该部位的减压手术由于部位较高,且下颌阻挡,所以手术当中需要更强有力的牵拉食道显露颈前,更易造成食道的牵拉损伤。同时他也指出手术时间的长短与术后出现食道功能障碍也有关,手术时间越长,术后出现食道功能障碍的几率越大。
颈椎前路术后发生食道功能障碍与手术节段的长短是相关的[8]。本组病例各时间节点单椎体次全切除均较单节段椎间盘切除的术后食道功能障碍的发生率增高。由于长节段固定的病例较少,本组病例未纳入比较。本组研究还显示女性患者术后出现食道功能障碍的几率较高,原因尚不明确。可能的原因包括女性患者的解剖因素,由于颈椎椎体及食道的直径均较男性为小,相同宽度的接骨板可能会带来更明显的刺激。而且食道功能障碍本身更多的是一种主观的感觉,钡餐实验表明食道功能障碍可能与影像学上观察到的食道局部蠕动功能减低并不完全相符,女性患者可能更容易出现心理因素上对食道功能状态的影响[9]。
有研究指出手术入路同样会影响术后食道功能障碍的发生率。Lu等[10]比较了左侧入路和右侧入路术后出现食道功能障碍的发生率,结果显示左侧入路术后出现食道功能障碍的发生率为6.5%,低于右侧入路的13.3%。其解释在于解剖学上的左侧入路损伤喉返神经的几率要小于右侧入路。由于优势手的原因,大多数外科医生还是习惯于右侧入路,右侧入路时尽量减少对食道的牵拉及注意对喉返神经的保护是必要的。此外,研究还显示固定的接骨板类型同样会影响术后的食道功能。目前颈椎前路接骨板中,枢法模的Zephir接骨板较薄,有研究比较了Zephir接骨板与Atlantis接骨板术后食道功能障碍的发生率,结果显示Zephir接骨板组术后出现食道功能障碍的发生率较低,但无显著性差异[11]。
颈椎前路减压融合术后具有较高的食道功能障碍发生率,总体而言随着康复过程功能障碍的程度会逐步改善并趋于消失。相比于接骨板的占位因素,术中对食道的过度及持续牵拉可能是术后出现食道功能障碍的主要原因。
[1]Martin RE,Neary MA,Diamant NE.Dysphagia following anterior cervical spine surgery.Dysphagia,1997,12(1):2-10.
[2]Bazaz R,Lee MJ,Yoo JU.Incidence of dysphagia after anterior cervical spine surgery:a prospective study.Spine(Phila Pa 1976),2002,27(22):2453-2458.
[3]Smith-Hammond CA,New KC,Pietrobon R,et al.Prospective analysis of incidence and risk factors of dysphagia in spine surgery patients:comparison of anterior cervical,posterior cervical,and lumbar procedures.Spine(Phila Pa 1976),2004,29(13):1441-1446.
[4]Fountas KN,Kapsalaki EZ,Nikolakakos LG,et al.Anterior cervical discectomy and fusion associated complications.Spine(Phila Pa 1976),2007,32(21):2310-2317.
[5]Yue WM,Brodner W,Highland TR.Persistent swallowing and voice problems after anterior cervical discectomy and fusion with allograft and plating:a 5-to 11-year follow-up study.Eur Spine J,2005,14(7):677-682.
[6]Oppenlander ME,Orringer DA,La Marca F,et al.Dysphagia due to anterior cervical hyperosteophytosis.Surg Neurol,2009,72(3):266-270.
[7]Chin KR,Eiszner JR,Adams SB Jr.Role of plate thickness as a cause of dysphagia after anterior cervical fusion.Spine(Phila Pa 1976),2007,32(23):2585-2590.
[8]Kang SH,Kim DK,Seo KM,et al.Multi-level spinal fusion and postoperative prevertebral thickness increase the risk of dysphagia after anterior cervical spine surgery.J Clin Neurosci,2011,18(10):1369-1373.
[9]Riley LH 3rd,Vaccaro AR,Dettori JR,et al.Postoperative dysphagia in anterior cervical spine surgery.Spine(Phila Pa 1976),2010,35(9 Suppl):S76-S85.
[10]Lu DC,Theordore P,Korn WM,et al.Esophageal erosion 9 years after anterior cervical plate implantation.Surg Neurol,2008,69(3):310-313.
[11]Lee MJ,Bazaz R,Furey CG,et al.Influence of anterior cervical plate design on dysphagia:a 2-year prospective longitudinal follow-up study.J Spinal Disord Tech,2005,18(5):406-409.

