芹菜素诱导乳腺癌MDA-MB-231细胞系非P53依赖性凋亡的研究
张伟然 张 斌 刘博文 曹旭晨
芹菜素是一种黄酮类化合物,广泛存在于蔬菜,水果及茶叶中[1]。据报道,芹菜素能够对前列腺癌,胰腺癌等多种肿瘤细胞系产生增殖抑制作用[2-3]。此外,芹菜素还具有诱导细胞凋亡,阻滞细胞周期,抑制肿瘤的侵袭和转移等多种抗肿瘤活性。因其具有毒性小、致突变作用低等优势引起广泛关注[4]。MDA-MB-231是突变型P53高表达细胞株,突变型P53不仅降低抑癌基因p53的生理调节功能,还可促进细胞发生恶性转化,并抑制其发生凋亡[5]。P73是P53蛋白家族中重要成员。有研究表明,在p53突变或缺失的肿瘤细胞中,p73可代替p53靶向调节下游基因表达[6]。其中,p53诱导基因3(PIG3)就是其下游调控细胞凋亡的重要靶基因之一。本实验以MDA-MB-231细胞为对象,研究芹菜素对乳腺癌MDA-MB-231细胞的凋亡诱导作用,并初步探讨非P53依赖性凋亡发生的分子机制。
1 材料与方法
1.1 材料
人乳腺癌MDA-MB-231细胞系由天津医科大学附属肿瘤医院中心实验室提供。芹菜素购于美国Sigma公司。RPMI 1640培养基,胰蛋白酶及胎牛血清购于美国Hyclone公司。染料Hochest33342、Mitotracker Red、Yo-Pro-1以及转染试剂盒LipofectamineTM2000购于美国Invitrogen公司。Annexin V-FITC凋亡检测试剂盒购于美国BD公司。P53、P73、Bax、Bcl-2、Caspase-3、PARP、β-actin一抗购于美国Cell Signaling Technology公司。PIG3一抗购于美国Millipore公司。HRP标记的IgG二抗购于中国Abmart公司。双链小分子RNA购于美国Selleck公司。
1.2 方法
1.2.1 细胞培养 MDA-MB-231细胞系常规培养于RPMI 1640培养液中,内含10%胎牛血清,1%青霉素(100 U/mL)和链霉素(100 μg/mL),于含5%CO2的37℃恒温培养箱中培养,采用对数生长期的细胞进行实验。
1.2.2 MTT法 常规培养MDA-MB-231细胞,选取对数生长期的细胞以3×103/孔接种于96孔板。细胞贴壁后将芹菜素分别稀释为0、10、20、40 μM,按200 μL/孔加入96孔板,对照组加入等量培养液,每组设3个复孔,分别培养24和48 h。以20 μL/孔加入MTT(5 g/L),4 h后1 000 r/min离心5 min,弃上清。再加入DMSO 200 μL/孔,37℃震荡15 min,直至紫褐色沉淀完全溶解。采用酶标仪测定各孔在570nm波长处各孔吸光度值(A值),并计算肿瘤生长抑制率。生长抑制率(%)=[1-(加药孔A值/对照孔A值)]×100%。
1.2.3 荧光染色观察细胞形态学变化 取对数生长期MDA-MB-231细胞,以2×105/mL接种于6孔板内。加入0、10、20、40 μM不同浓度芹菜素处理24h后,再分别加入终浓度为5 μg/mL Hoechst33342、250 nM Mitotracker Red和1μM Yo-pro-1,室温孵育30 min后,于倒置荧光显微镜下观察。其中Hochest33342使细胞核呈蓝色荧光,Mitotracker Red使线粒体呈红色荧光,Yo-pro-1则标记凋亡细胞呈绿色荧光。
1.2.4 流式细胞术(FCM)检测细胞凋亡率 不同浓度芹菜素0、10、20、40 μM分别处理细胞24 h,收集细胞并调整细胞数至1×106/mL,用预冷磷酸盐缓冲液(PBS)洗涤细胞2次。弃上清,加入100 μL染料结合缓冲液重悬后,分别加入10 μL Annexin V-FITC和5 μL PI染液(50 mg/L),混匀后室温避光孵育15 min,补加400 μL结合缓冲液,静置5 min后检测凋亡率。
1.2.5 Western blot法检测凋亡及周期相关蛋白的表达 收集0、10、20、40 μM芹菜素处理24 h后各组细胞。预冷PBS洗涤2次,加入裂解液充分裂解,提取总蛋白,BSA法测定蛋白浓度,每孔加入相同蛋白质量的样品,在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)中电泳分离蛋白,电转移至PVDF膜上,5% 牛奶室温封闭1 h,放入一抗(P53、P73、PIG3、Bax、Bcl-2、Caspase-3、PARP及β-actin)中4 ℃孵育过夜,次日用TBST洗涤3次,用HRP标记的羊抗兔二抗(1:10 000)室温孵育1 h,TBST洗涤3次,ECL显影,于暗室曝光。条带灰度值使用Image J软件进行分析。
1.2.6 细胞转染 选取对数生长期的乳腺癌MD A-MB-231细胞,转染前24 h用0.125%的胰酶消化细胞,用不含抗生素和血清的RPMI 1640制备单细胞悬液(1×105/mL),将细胞悬液以2 mL/孔重新接种于6孔板,使转染时细胞密度达到30%~50%。具体转染步骤参照LipofectamineTM2000转染试剂说明进行。转染实验分别设立阴性对照组(转染scrambled siRNA)以及siRNA干扰组(转染p73-siRNA),转染浓度50 nM。加入siRNA-Lipo2000混合物于培养液中,37℃恒温培养4~6 h后,更换新鲜的生长培养基继续培养24 h,随后各实验组分别给予40 μM芹菜素处理,空白对照组则不予以处理,24 h后收集细胞。
1.3 统计学分析
数据使用SPSS 16.0软件进行分析,实验结果用均数±标准差(±s)表示。组间差异比较使用单因素方差分析(ANOVA),P<0.05表示差异有统计学意义。所有实验至少重复3次。
2 结果
2.1 芹菜素对乳腺癌MDA-MB-231细胞增殖的影响
芹菜素可有效抑制乳腺癌MDA-MB-231细胞系增殖。随着浓度增加及作用时间的延长,各组增殖抑制率逐渐增加,具有浓度依赖性和时间依赖性。空白对照组,芹菜素10 μM、20 μM及40 μM组处理细胞24 h,各实验组增殖抑制率分别为6.94%、12.14%及26.59%,与对照组比较差异具有统计学意义(P<0.05);当芹菜素作用时间延长至48 h,芹菜素对MDA-MB-231细胞的增殖抑制作用明显增强,各实验组增殖抑制率上升至8.64%、30.86%及56.17%,与对照组比较差异具有统计学意义(P<0.05)。两组组间差异具有统计学意义(P<0.05,表1)。
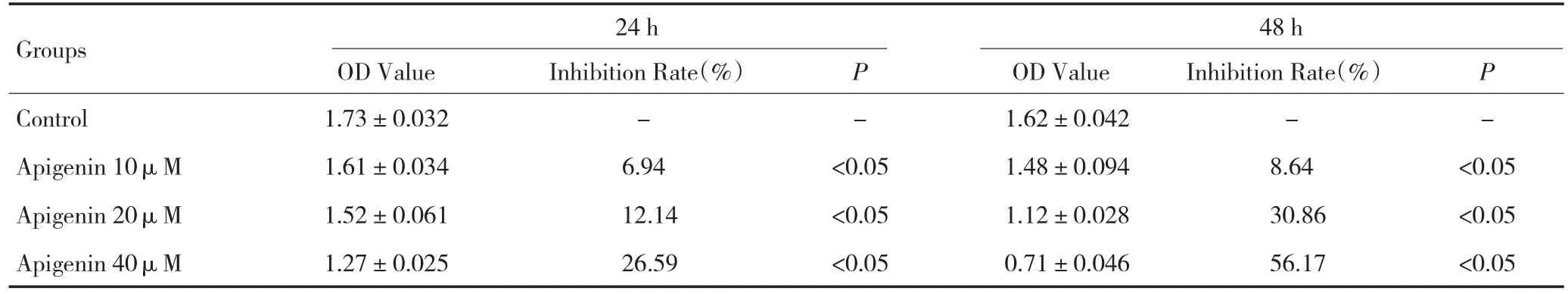
表1 芹菜素对乳腺癌MDA-MB-231细胞系增殖的影响Table1 Effect of apigenin on the proliferation of the MDA-MB-231 breast cancer cell line
2.2 芹菜素诱导乳腺癌MDA-MB-231细胞发生凋亡
荧光染色结果显示,芹菜素可诱导MDA-MB-231细胞发生凋亡。对照组未观察到明显的凋亡形态学改变(图1)。芹菜素10μM组可见绿色荧光标记细胞(即凋亡小体),且随着芹菜素浓度的增加,各实验组凋亡小体数目逐渐增加,具有浓度依赖性。芹菜素20 μM、40 μM组均可观察到明显的凋亡形态学改变。
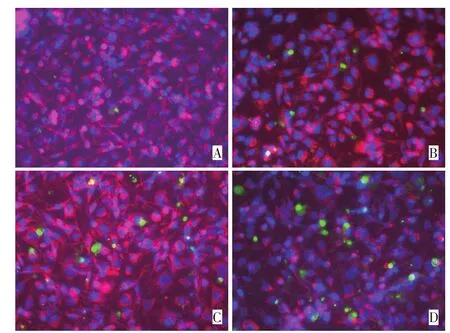
图1 荧光染色观察凋亡小体形成Figure1 Morphological changes in apoptotic bodies observed by fluorescent staining
流式细胞术结果显示,芹菜素可诱导乳腺癌MDA-MB-231细胞发生早期凋亡。与对照组比较,各实验组早期凋亡率逐渐增加,呈明显的量效关系(图2)。空白对照组、芹菜素10 μM、20 μM及40 μM组处理细胞24 h,各组凋亡率分别为(0.92±0.063)%、(9.23±0.037)%、(19.80±0.046)%、(38.30±0.081)%,实验组与对照组比较差异具有统计学意义(P<0.05,表2)。
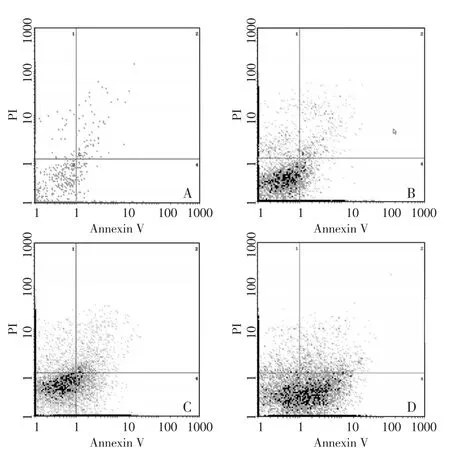
图2 AnnexinV/PI双染法检测乳腺癌MDA-MB-231细胞早期凋亡。Figure2 Detection of the early apoptotic ratio in the human breast cancer cell line MDA-MB-231 using Annexin V/PI double staining of flow cytometry
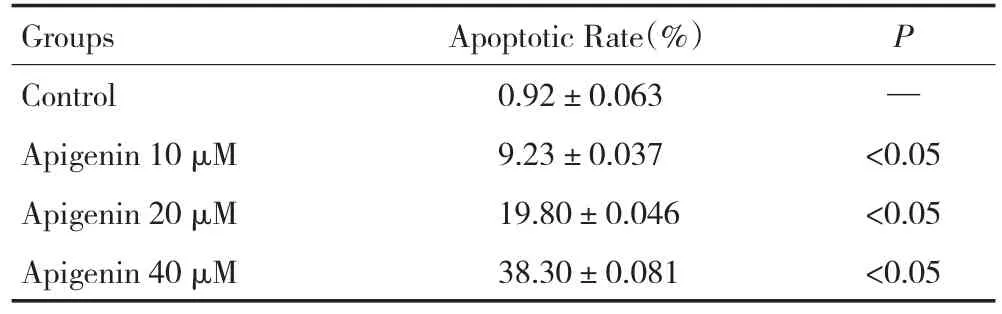
表2 Annexin V/PI双染流式细胞术检测各组细胞凋亡率Table2 Detection of the apoptotic ratio in the groups using Annexin V/Propidium iodide double staining of flow cytometry
Western blot结果显示,与对照组比较,芹菜素10 μM、20 μM及40 μM组PARP及Caspase-3剪切带表达水平逐渐增加,具有浓度依赖性。此外,随芹菜素浓度增加,P73、PIG3与促凋亡蛋白Bax表达上调,而突变型P53与Bcl-2均表达下调,呈明显量效关系(图3)。各组Bax/Bcl-2比值分别为0.57±0.029、0.62±0.031、1.23±0.027、4.29±0.046,与芹菜素浓度呈正相关,实验组与对照组比较差异具有统计学意义(P<0.05)。
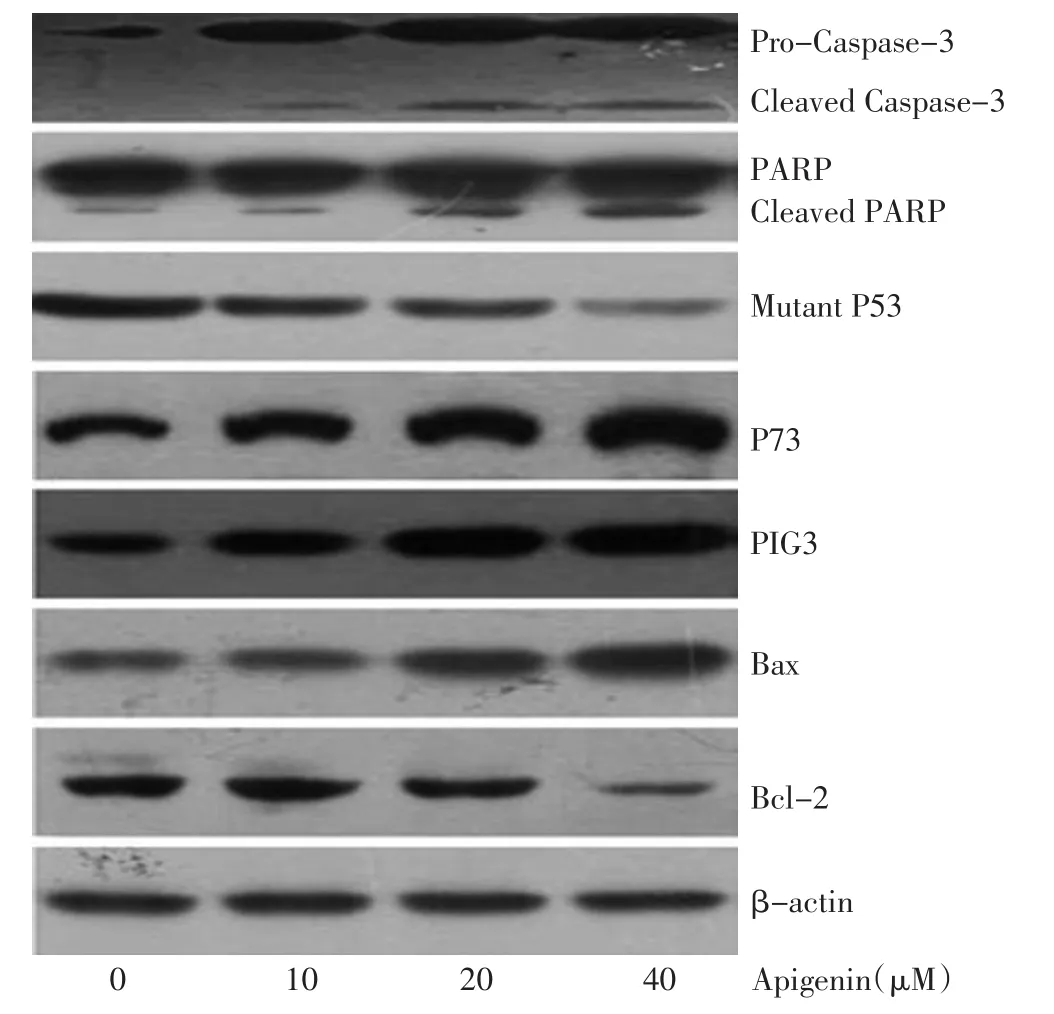
图3 不同浓度芹菜素对乳腺癌MDA-MB-231细胞凋亡相关蛋白表达的影响Figure3 Effect of various apigenin concentrations on the expression of apoptosis-related proteins in the MDA-MB-231 breast cancer cell line
RNA干扰结果显示,p73-siRNA可有效抑制PIG3蛋白表达(图4)。空白对照组与实验组(芹菜素40μM)PIG3表达分别降低了92.4%及89.9%,差异有统计学意义(P<0.05)。此外,Caspase-3和PARP剪切含量也明显减少。Caspase-3剪切表达分别降低42.9%(空白对照组)及62.7%(实验组),PARP剪切表达则降低65.4%(空白对照组)及73.3%(实验组),差异具有统计学意义(P<0.05)。

图4 p73基因敲除对PIG3表达及MDA-MB-231细胞凋亡的影响Figure4 Effect of the p73 gene knockdown on PIG3 expression and the apoptosis of the MDA-MB-231 breast cancer cell line
3 讨论
乳腺癌已经成为全球女性最为常见的恶性肿瘤,其发病率呈逐年递增趋势。流行病学研究显示,受传统饮食习惯影响,豆类制品在亚洲人饮食结构中所占比例较高,与欧美女性比较,亚洲女性罹患乳腺癌风险相对较低[7]。豆类食品中包含黄酮类化合物,可以有效降低包括乳腺癌在内的多种激素依赖性肿瘤发病风险。芹菜素是存在于多种植物中的一种黄酮类药物,有文献报道,芹菜素可大幅降低乳腺癌发病率,且对多种肿瘤细胞产生增殖抑制作用[2-3]。然而,其作用机制尚不明确。本研究发现,芹菜素可通过非P53依赖性途径诱导乳腺癌MDA-MB-231细胞发生凋亡。
在倒置显微镜下观察,随着芹菜素浓度的增加,贴壁细胞出现皱缩、变圆、脱落现象,而在对照组中几乎观察不到此现象。同时,MTT实验结果表明,芹菜素能有效抑制乳腺癌MDA-MB-231细胞增殖,并呈现出明显的量效及时效关系。芹菜素对细胞增殖的抑制作用可能是通过诱导凋亡、阻滞细胞周期或抑制细胞生长实现的。为了进一步确定芹菜素对乳腺癌MDA-MB-231细胞的增殖抑制作用,本研究应用荧光染色、流式细胞术及Western blot等方法证实芹菜素可通过诱导凋亡来抑制MDA-MB-231细胞增殖。Yo-pro-1荧光染色观察到凋亡细胞的特征性形态学改变-凋亡小体形成,为芹菜素诱导的凋亡发生提供直接证据。流式细胞术检测结果显示,MDA-MB-231细胞发生早期凋亡比例逐渐增高,呈明显的量效关系,进一步证明芹菜素对乳腺癌MDA-MB-231细胞系的增殖抑制作用与细胞凋亡相关。此外,Caspase-3是细胞凋亡过程中重要的执行分子,而PARP是Caspase-3的主要切割底物,其在DNA损伤修复与细胞凋亡中发挥重要作用,底物PARP的剪切通常被认为是Caspase-3凋亡途径激活的标志[8]。应用Western blot检测技术,发现随着芹菜素浓度的增加,Caspase-3和PARP剪切带含量也随之增加,提示乳腺癌MDA-MB-231细胞发生凋亡。以上实验结果表明,芹菜素是通过诱导乳腺癌MDA-MB-231细胞凋亡来抑制细胞增殖的。
研究表明,肿瘤抑制基因p53与凋亡发生相关。p53是细胞内重要的抑癌基因,其突变是导致肿瘤发生的重要原因。P53过表达源于DNA损伤,野生型P53可促进P21表达,后者通过下调细胞周期依赖性蛋白激酶CDK阻滞细胞周期,从而使细胞获得充分的时间修复损伤基因,维持细胞遗传的稳定。若基因修复失败,P53会促进Bax上调,并下调凋亡抑制蛋白Bcl-2的表达,从而诱导细胞凋亡[9]。然而,MDA-MB-231是突变型P53高表达细胞株,突变型P53不仅降低P53的正常调节功能,还可促使细胞发生恶性转化。本研究发现,芹菜素处理MDA-MB-231细胞24h,突变型P53蛋白表达水平显著下降,且具有浓度依赖性,提示芹菜素可通过下调突变型P53表达促进MDA-MB-231细胞凋亡。
P53诱导基因3(PIG3)是p53下游调控细胞凋亡的靶基因之一。多项研究表明[10-11],PIG3参与合成活性氧簇(ROS),而后者是线粒体凋亡途径中的关键效应分子。ROS水平升高可降低线粒体跨膜电位,使线粒体释放细胞色素C,从而诱导凋亡产生。因此,PIG3的激活在P53介导的细胞凋亡中发挥重要作用。本研究发现,随着芹菜素浓度的增加,PIG3表达随之增加,且具有浓度依赖性。以上实验结果表明,乳腺癌MDA-MB-231凋亡可能与PIG3表达上调相关。
在乳腺癌MDA-MB-231细胞中,突变型P53高表达,且随着芹菜素浓度增加,其表达显著降低,提示PIG3不是由突变型P53诱导产生的。另有研究表明[12],除P53以外,PIG3也可由P53蛋白家族中其他成员诱导产生。P73是P53蛋白家族中的一员,其编码序列与p53基因高度同源。与p53不同的是,p73在肿瘤细胞中极少发生变异或缺失[13]。研究表明,在p53突变或缺失的肿瘤细胞中,p73可代替p53靶向调节下游基因表达[6](如P21,PIG3等),从而修复损伤基因,或诱导细胞发生凋亡。本研究发现,随着芹菜素浓度增加,P73表达水平也有显著提高,提示乳腺癌MDA-MB-231细胞中PIG3的表达可能与p73激活有关。为了进一步确定p73在PIG3表达中的必要性,利用RNA干扰技术沉默p73基因。实验结果显示,p73-siRNA可有效抑制PIG3蛋白表达,说明在乳腺癌MDA-MB-231细胞中,PIG3的表达是P73依赖性的。同时,Caspase-3和PARP剪切含量也显著降低,提示P73在调控乳腺癌MDA-MB-231细胞凋亡中起关键作用。因此,P73介导的PIG3表达可能是芹菜素诱导MDA-MB-231细胞凋亡的分子机制之一。
此外,Bcl-2家族是调节细胞凋亡中的重要因子,其中最重要的当属促凋亡蛋白Bax与抗凋亡蛋白Bcl-2,这两种蛋白在细胞凋亡过程中发挥决定性作用。Bax蛋白与Bcl-2蛋白有21%的同源性,Bax不仅能和Bcl-2形成异源二聚体抑制细胞凋亡,而且其自身还能形成同源二聚体诱导凋亡发生[14]。研究表明,Bax/Bcl-2比值增加是细胞内源性凋亡发生的使动因素,当Bax/Bcl-2比值增高后,线粒体膜电位会发生改变,促进细胞色素C从线粒体释放到细胞质中,进而激活Caspase-3,导致核内PARP发生剪切,从而诱导细胞凋亡[15]。本研究发现,芹菜素处理24h,Bax表达显著增加,而Bcl-2表达降低,Bax/Bcl-2比值逐渐增加。实验结果表明,Bax/Bcl-2比值增加可能是芹菜素诱导MDA-MB-231细胞凋亡的又一分子机制。
综上所述,芹菜素可通过非P53依赖性凋亡有效抑制乳腺癌MDA-MB-231细胞增殖,其主要机制可能与突变型P53表达下调,P73介导的PIG3表达上调,以及Bax/Bcl-2比值增加有关。由于芹菜素对肿瘤细胞杀伤能力强,且在体内毒副作用小,芹菜素在不久的将来很有可能成为一种有效的辅助化疗药,特别是在预防肿瘤发生及防治肿瘤复发方面发挥自己的独特优势。
1 Shukla S,Gupta S.Apigenin:a promising molecule for cancer prevention[J].Pharm Res,2010,27(6):962-978.
2 Shukla S,Gupta S.Apigenin suppresses insulin-like growth factor I receptor signaling in human prostate cancer:an in vitro and in vivo study[J].Mol Carcinog,2009,48(3):243-252.
3 Ujiki MB,Ding XZ,Salabat MR,et al.Apigenin inhibits pancreatic cancer cell proliferation through G2/M cell cycle arrest[J].Mol Cancer,2006,5:76.
4 Czeczot H,Tudek B,Kusztelak J,et al.Isolation and studies of the mutagenic activity in the Ames test of flavonoids naturally occurring in medical herbs[J].Mutat Res,1990,240(3):209-216.
5 Inoue K,Kurabayashi A,Shuin T,et al.Overexpression of p53 protein in human tumors[J].Med Mol Morphol,2012,45(3):115-123.
6 Maas AM,Bretz AC,Mack E,et al.Targeting p73 in cancer[J].Cancer Lett,2011[Epub ahead of print].
7 de Bruin MA,Kwong A,Goldstein BA,et al.Breast cancer risk factors differ between Asian and white women with BRCA1/2 mutations[J].Fam Cancer,2012,11(3):429-439.
8 Bu R,Uddin S,Bavi P,et al.HGF/c-Met pathway has a prominent role in mediating antiapoptotic signals through AKT in epithelial ovarian carcinoma[J].Lab Invest,2011,91(1):124-137.
9 Lee WT,Chang CW.Bax is upregulated by p53 signal pathway in the SPE B-induced apoptosis[J].Mol Cell Biochem,2010,343(1-2):271-279.
10 Kotsinas A,Aggarwal V,Tan EJ,et al.PIG3:a novel link between oxidative stress and DNA damage response in cancer[J].Cancer Lett,2012,327(1-2):97-102.
11 Wang H,Luo K,Tan LZ,et al.p53-induced gene 3 mediates cell death induced by glutathione peroxidase 3[J].J Biol Chem,2012,287(20):16890-16902.
12 Jost CA,Marin MC,Kaelin WG Jr.p73 is a simian p53-related protein that can induce apoptosis[J].Nature,1997,389(6647):191-194.
13 Ozaki T,Nakagawara A.p73,a sophisticated p53 family member in the cancer world[J].Cancer Sci,2005,96(11):729-737.
14 Choi EJ,Kim GH.Apigenin induces apoptosis through a mitochondria/caspase-pathway in human breast cancer MDA-MB-453 cells[J].J Clin Biochem Nutr,2009,44(3):260-265.
15 Zhao M,Guo T,Wang M,et al.The course of uncarinic acid E-induced apoptosis of HepG2 cells from damage to DNA and p53 activation to mitochondrial release of cytochrome c[J].Biol Pharm Bull,2006,29(8):1639-1644.

