RNA干扰血管平滑肌细胞高血压相关基因FXYD5表达及其功能研究
施翔翔, 高瞻, 伍新雷, 黄周青, 杨德业,2
(1.温州医科大学附属第一医院 心内科,浙江 温州 325000;2.杭州师范大学附属医院 心内科,浙江 杭州 310015)
原发性高血压即高血压病是老年人最常见的心血管疾病之一,近几年国内外学者的研究结果表明:原发性高血压是一种多基因疾病,可能存在多个“微效基因”的联合缺陷[1-2]。FXYD蛋白家族最近被证明是一个组织特异性调节Na+-K+-ATPase的小跨膜蛋白家族[3]。我们之前的研究表明在阻力血管(肠系膜动脉第二、第三级分支)和肾脏组织FXYD5基因表达水平在13周龄的自发性高血压大鼠(spontaneously hypertensive rats,SHR)组比Wistar大鼠(WKY)组下调14.8倍[4-5],提示FXYD5可能在高血压发病机制中扮演重要角色。
RNA干扰(RNA interference,RNAi)是近几年才被认识的自然界进化保守而普遍存在的一种现象[6],目前广泛应用于哺乳动物细胞基因功能研究和基因表达调节。本实验选择RNAi技术特异性沉默其在血管平滑肌细胞内的表达,研究该高血压相关基因的沉默对血管平滑肌细胞所造成的一系列影响,包括增殖能力、迁移能力及Na+-K+-ATPase的活性改变,为探索高血压病新的致病基因及其发病机制提供参考和依据。
1 材料和方法
1.1 主要试剂 DMEM、0.05%胰酶/EDTA、胎牛血清购自Gibco公司;Trizol、Lipofectamine 2000转染试剂、DEPC水均购自Invitrogen公司;RT试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit)购自立陶宛Fermantas公司;Power SYBR®Green PCR试剂盒购自ABI公司;CCK-8试剂盒购自日本同仁化学研究所;超微量Na+-K+-ATPase测试盒购自南京建成生物工程研究所;Triton X 100溶液购自美国Amresco公司。
1.2 细胞培养 大鼠胸主动脉平滑肌细胞株(rat thoracic aorta smooth muscle cells A7r5,CRL-1444),购自美国标准生物品收藏中心(ATCC)。接种于含有10% FBS的DMEM培养基中,置于37 ℃、5% CO2的培养箱中培养,定期观察细胞生长情况,平均每3 d进行胰酶消化法传代。
1.3 实验方法
1.3.1 设计合成FXYD5特异的siRNA片段:siRNA片段由上海吉玛公司合成,分别命名为siRNA-1、siRNA-2、siRNA-3、siRNA-4。siRNA-con与大鼠基因组各基因均无明显同源性。各序列分别为:siRNA-1正义链5’-GAGUUCUGUGACUACUCAUTT-3’,反义链5’-AUGAGUAGUCACAGAACUCTG-3’;siRNA-2正义链5’-CG AAAUGGCCACUGCGAAUTT-3’,反义链5’-AUUCGCAGUGGC CAUUUCGTT-3’;siRNA-3正义链5’-ACUUACAAGCAGCGA GAAATT-3’,反义链5’-UUUCUCGCUGCUUGUAAGUTT-3’;siRNA-4正义链5’-GGAAUUAUCAUCCUCACUATT-3’,反义链5’-UAGUGAGGAUGAUAAUUCCAG-3’;siRNA-con正义链5’-UUCUCCGAACGUGUCACGUTT-3’,反义链5’-AC GUGACACGUUCGGAGAATT-3’。
1.3.2 转染及筛选高效干扰的siRNA片段:用FAMNC siRNA/Lipofectamine 2000(2.5μL/2.5μL)转染CRL-1444细胞,培养48 h后激光共聚焦显微镜下观察每孔细胞,获得满意转染效率后,转染各siRNA片段,48 h后各组以Trizol、RT试剂盒按说明书操作逆转录成cDNA,行PCR扩增。以GAPDH为内参照。设计并合成扩增引物:FXYD5上游引物(5’to 3’)gggtggtattgtcgtagtagaagg,下游引物(5’to 3’)atgtcaccgcccagtcag,产物长度:423 bp;GAPDH上游引物(5’to 3’)CATGGTCTACATGTCCAGT,下游引物(5’to 3’)GGCTAAGCAGTTGGTGGTGC,产物长度:346 bp;α1亚单位上游引物(5’to 3’)TGCCTTCCCCTACTCCCTTCTCATC,下游引物(5’to 3’)CTTCCCCGCTGTCGTCCCCGTCCAC,产物长度:323 bp。产物经凝胶电泳,在Biorad凝胶成像系统成像,观察目的条带。
1.3.3 荧光实时定量PCR技术检测干扰后FXYD5 mRNA表达水平:于NCBI网站查找大鼠FXYD5及GAPDH的基因序列,通过Primer Express 3.0软件设计引物序列,由上海基康生物技术有限公司合成引物。FXYD5正向引物5’-CCTAGTGAAGGGCAGACACCAG-3’,反向引物5’-TGGCCATTTCGGTCAGTTG-3’;GAPDH正向引物5’-GTCATCATCTCCGCCCCTT-3’,反向引物5’-TTCTGAGTGGCAGTGATGGC-3’。以15μL反应体系进行实时定量PCR,包括:1μL cDNA,7.5μL 2×Power SYBR®Green PCR Mix,0.5μL前向引物,0.5μL后向引物。实时定量PCR条件为:50 ℃ 2 min,95 ℃ 10 min,92 ℃ 15 s,60 ℃ 1 min,40循环。所有样品设3个复孔,扩增完毕后,进行熔解曲线分析,判断扩增产物单一性。通过比较ΔCt的方法进行基因表达的定量分析[7]。以GAPDH为内参,FXYD5在实验组和空白对照组的mRNA表达水平的比值=2-(ΔCt实验组-ΔCt空白对照组),ΔCt=CtmRNA-CtGAPDH。
1.3.4 CCK-8法检测细胞增殖:常规消化对数生长期的血管平滑肌细胞,显微镜下计数,以5000个细胞/孔接种到96孔板,24 h后分别转染siRNA-1、siRNA-2、siRNA-con对照组、空白对照组4组;37 ℃、5% CO2的培养箱中继续培养48 h后,将CCK-8与无血清DMEM以1:9混合,各孔加入100μL混合液,每组设3个复孔,边缘孔用DMEM填充避免边缘效应;继续37 ℃、5% CO2的培养箱中培养1 h,酶标仪470 nm波长处检测各孔光密度值并记录,参比波长650 nm。
1.3.5 划痕法检测细胞迁移力:常规消化对数生长期的血管平滑肌细胞,接种6孔板转染各组并继续培养48 h后;每孔加入2 mL无血清DMEM同步化24 h;用无菌1000μL枪头(直径约1 mm)在各孔细胞生长单层的相同位置划平行直线,造成“伤口”;加入含5% FBS的DMEM培养液2 mL,继续培养24 h;4%甲醛固定20 min及1% Triton X-100作用5 min;苏木精染色5 min后显微镜下观察,随机选取3个视野拍摄(×40),软件(Image-Pro Plus,v6.0)测量迁移距离最远的细胞到起始处的距离,计算均值。
1.3.6 血管平滑肌细胞膜Na+-K+-ATPase活性检测:严格按照南京建成超微量Na+-K+-ATPase测定试剂盒说明书进行,Na+-K+-ATPase可分解ATP生成ADP及无机磷,根据测定无机磷的量可判断ATP酶活力的高低。可见分光光度计636 nm处测吸光度值。规定每小时每毫克细胞蛋白中ATP酶分解ATP产生1μmol无机磷的量为一个ATP酶活力单位。公式:ATPase活力(U/mgprot)=(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)×标准管浓度×6*×7.8**÷匀浆蛋白含量(mgprot/mL),其中6*:定义上为每小时,实际操作为10 min酶促反应;7.8**:反应体系中为7.8倍稀释。
1.4 统计学处理方法 采用SPSS 13.0统计软件进行统计学分析。实验数据经过方差齐性检验,以±s表示,多组间均数比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染及筛选高效干扰的siRNA片段结果 激光共聚焦显微镜下观察每孔细胞,以绿色荧光细胞数与自然光下细胞总数的比值估算转染效率,转染效率在80%以上(见图1)。RT-PCR初筛RNAi效率(见图2):目的条带位于400~500 bp左右与引物设计时的PCR产物片段大小符合,筛选出siRNA-1和siRNA-2两实验组做随后实验。

图1 CRL-1444转染携带FAM基团的siRNA 48 h后通过激光共聚焦显微镜检测。绿色荧光代表成功转染的平滑肌细胞,转染率约为80%
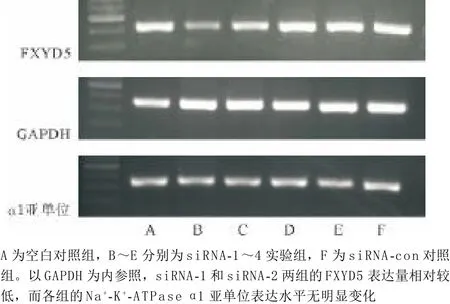
图2 RT-PCR产物凝胶电泳图
2.2 特异性干扰后FXYD5 mRNA表达水平 熔解曲线分析显示FXYD5和GAPDH的PCR产物特异性高,无杂带(见图3)。FXYD5和GAPDH的扩增曲线见图4,横坐标为Ct值,纵坐标为ΔRn,Rn表示第n个循环时的荧光值,红线为荧光阈值。转染siRNA-1、siRNA-2和siRNA-con对照组与空白对照组的相对比值分别为0.133±0.116、0.098±0.072和1.003±0.262。siRNA-1使FXYD5的mRNA表达与空白对照组相比下降86.71%,差异有统计学意义(P<0.01);siRNA-2使FXYD5的mRNA表达与空白对照组相比下降90.17%,差异有统计学意义(P<0.01);siRNA-con对照组与空白对照组FXYD5的mRNA表达差异无统计学意义(P=0.996)。
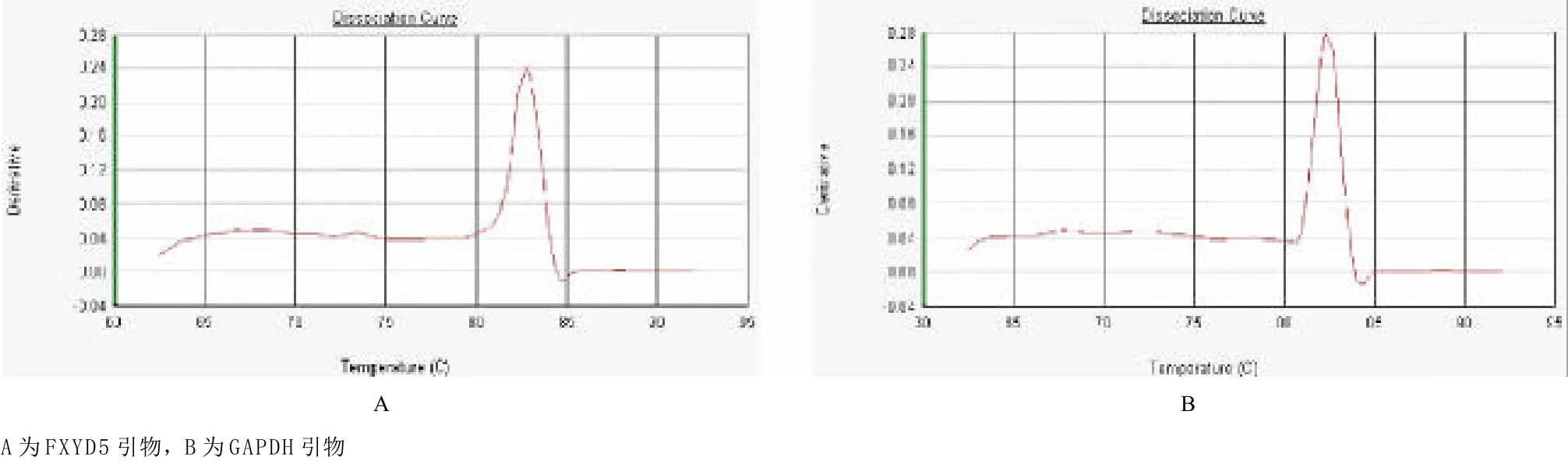
图3 荧光实时定量PCR引物熔解曲线
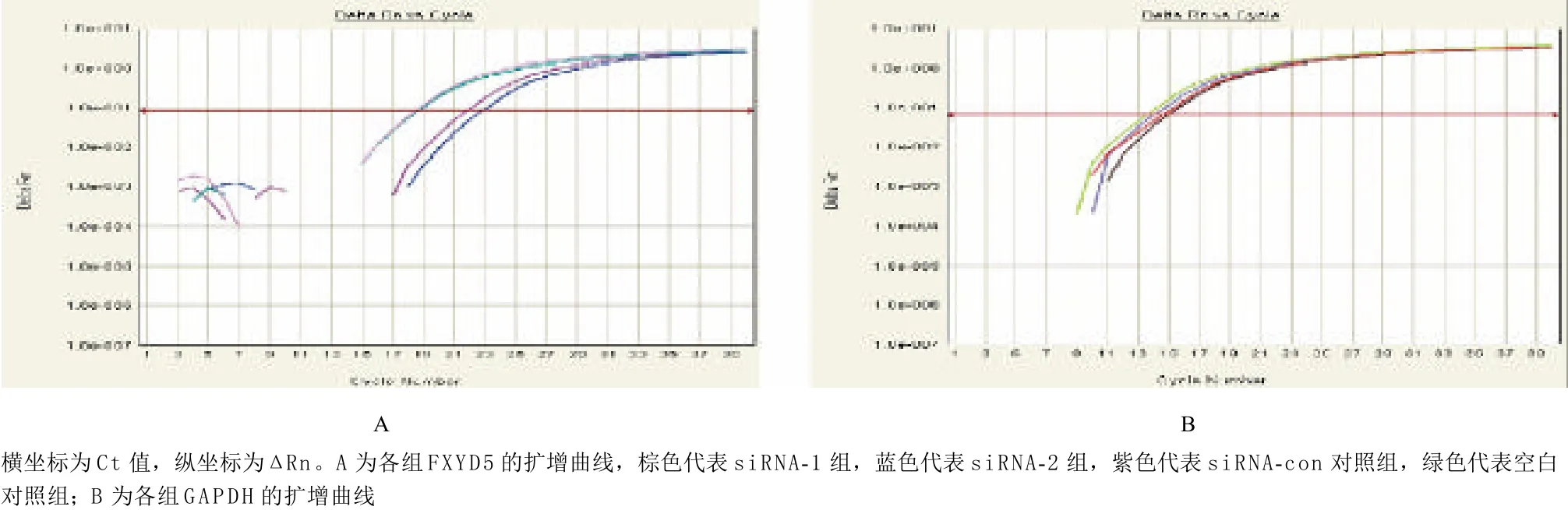
图4 荧光实时定量PCR扩增曲线
2.3 特异性干扰FXYD5对平滑肌细胞增殖的影响转染siRNA-1、siRNA-2和siRNA-con对照组的吸光光度值分别为1.040±0.141、1.097±0.206和1.062±0.111,与空白对照组的1.184±0.152比较差异无统计学意义(均P>0.05),见表1。特异性干扰沉默FXYD5对平滑肌细胞的增殖无影响。
2.4 沉默FXYD5对平滑肌细胞迁移能力的影响 转染siRNA-1、siRNA-2的平滑肌细胞迁移距离(μm)分别为188.098±9.900、180.247±25.497,较siRNA-con对照组的245.690±24.438和空白对照组的250.866±21.887显著降低(P<0.01),见图5。
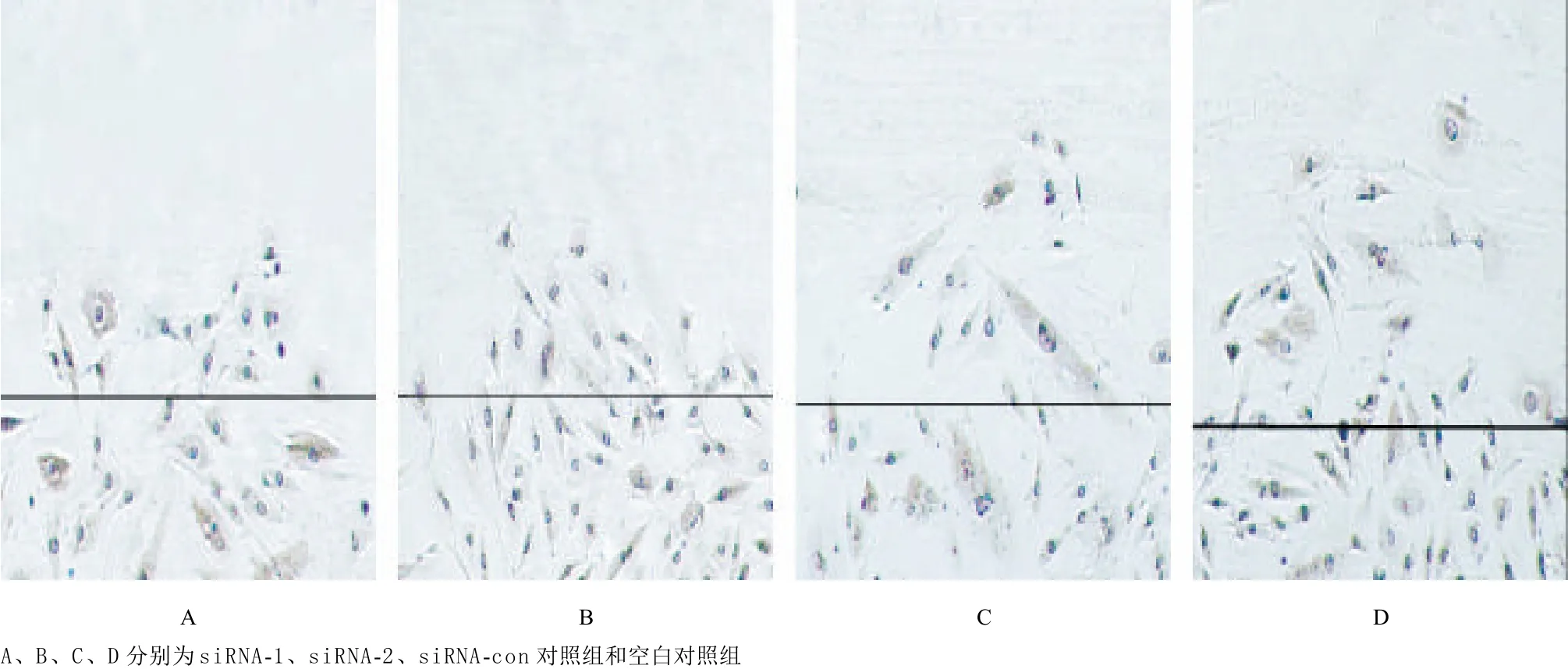
图5 转染48 h后各组CRL-1444细胞的迁移情况(×40)
2.5 沉默FXYD5对平滑肌细胞膜Na+-K+-ATPase活性的影响 转染siRNA-1、siRNA-2的Na+-K+-ATPase活性(U/mgprot)分别为2.894±0.170、2.944±0.060,较空白对照组的4.006±0.048显著降低(P<0.01),较siRNA-con对照组的3.587±0.064亦显著降低(P<0.05),见表2。
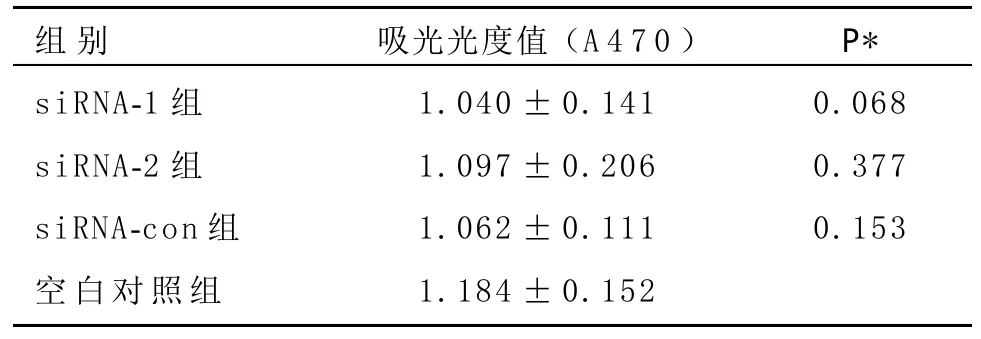
表1 转染48 h后对各组CRL-1444细胞增殖能力的影响

表2 转染48 h后对各组细胞膜Na+-K+-ATPase活性的影响
3 讨论
RNAi现象是由与靶基因序列同源的双链RNA(dsRNA)引发的广泛存在于生物体内的序列特异性基因转录后沉默的过程。RNAi具有特异、有效的基因沉默效应,克服了建立基因敲除动物模型费时费力的缺点,已成为基因功能分析和基因治疗的重要手段。本实验运用化学合成法,严格设计并合成了4个针对不同FXYD5基因mRNA序列区域的siRNA(siRNA-1~4)及采用公认的通用阴性对照来尽量避免脱靶效应,高效率地瞬时转染大鼠血管平滑肌细胞,之后通过RT-PCR和荧光实时定量PCR验证4个片段的抑制效率,发现siRNA-1和siRNA-2特异性地抑制了FXYD5基因mRNA水平的表达,抑制率分别达到86.71%和90.17%。以上结果说明我们在设计的4个siRNA片断中成功筛选出2个能够有效抑制FXYD5基因表达的siRNA序列,为今后构建siRNA表达载体,获得FXYD5稳定低表达细胞株奠定了基础。
FXYD蛋白家族是一类Na+-K+-ATPase的组织特异性调节因子。这些蛋白具有一个特征性的FXYD基序,两个保守的甘氨酸残基和一个丝氨酸残基。FXYD5在结构上不同于其他的FXYD家族成员,它的胞外段氨基酸超过140个,明显长于其他FXYD蛋白胞外端的40个氨基酸,并且它的胞内段只有15个氨基酸[8-9]。Lubarski等[10]的系列研究证明FXYD5和Na+-K+-ATPase之间存在相互作用,能明显增加钠泵的构型的转变的效率,在爪蟾卵中FXYD5/FXYD4嵌合表达实验证明它们与钠泵的高亲和力以及它的Vmax的增加都是通过FXYD5的跨膜区域介导的,其中已经证明的几个相关氨基酸有Ala150、Ile160和Leu161。
本实验室已研究表明:在阻力血管(肠系膜动脉第二、第三级分支)和肾脏组织FXYD5基因表达水平在13周龄的SHR组比WKY组下调14.8倍[5],提示FXYD5可能是高血压新的相关基因。我们进一步对相同周龄的WKY和SHR的肾组织和肺组织中的FXYD5的表达进行了对比研究,发现在4周、8周即处于高血压前期的SHR和WKY的肾组织中FXYD5的表达没有差异,而在13周即处于高血压形成进展期的SHR的肾组织其表达明显低于WKY[11]。对于FXYD5在高血压的发生发展中扮演什么角色目前鲜有文献报道。本实验通过RNAi技术特异性沉默FXYD5在大鼠平滑肌细胞的表达,模拟了SHR大鼠体内低FXYD5表达的环境,发现FXYD5的低表达会导致细胞膜Na+-K+-ATPase活性明显下降。而Na+-K+-ATPase作为真核细胞膜上的糖蛋白,介导细胞信号传递,对血管紧张性、心肌收缩、细胞增殖和死亡等产生重要影响[12]。已有研究证明高血压病患者及SHR大鼠体内钠泵活性降低[13],且发现高血压病患者子女的钠泵活性也降低,提示高血压病的高度遗传倾向[14]。众所周知,血管重塑既是高血压发生的病理基础,也是高血压维持、进展的结构基础。高血压血管结构改变被证实与血管细胞的增殖、迁移有关[15]。高血压血管重构主要表现为管壁增厚,血管壁/腔比例加大,血流阻力和血管反应性增加。中膜平滑肌细胞向内膜下迁移并增殖是包括高血压、动脉粥样硬化等在内的血管重构的重要发生机制之一。Hsieh等[16]报道在血清和血小板衍化生长因子等因子的趋化作用下,SHR中膜VSMC迁移快于WKY。这一现象不仅见于血压已明显升高的20周龄SHR,而且也见于高血压前期的5周龄SHR,提示不仅血管平滑肌细胞增殖而且细胞迁移也可能参与高血压血管重塑机制。本实验的另一结果也发现抑制FXYD5的表达并不影响血管平滑肌细胞的增殖,但能使其迁移能力下降,即FXYD5表现出一种抗黏附的作用,提示FXYD5可能通过影响血管重塑在高血压病进展期发挥一定的代偿作用。
综上所述,FXYD5在血管平滑肌细胞中的低表达能影响血管重塑,抑制钠泵活性,从而在高血压形成过程中扮演重要角色,可能是高血压病新的相关基因之一,为进一步探索高血压的发病机制及基因治疗开辟了崭新的途径。
[1] 周雨生, 张衍文. 老年人单纯收缩期高血压的分离比与遗传度调查[J]. 安徽医科大学学报, 1997, 32(5): 542-544.
[2] Brown MJ. Science, medicine, and the future. Hypertension[J]. BMJ, 1997, 314(7089): 1258-1261.
[3] Crambert G, Geering K. FXYD proteins: new tissue-specific regulators of the ubiquitous Na+, K+-ATPase[J]. Sci STKE,2003, 2003(166): RE1.
[4] 陈长曦, 余祖善, 杨德业, 等. 大鼠自发性高血压致病相关基因的初步筛选[J]. 温州医学院学报, 2006, 36(5): 430-433.
[5] 陈长曦, 杨德业, 余祖善, 等. 自发性高血压大鼠FXYD5基因的实验研究[J]. 中华高血压杂志, 2007, 15(2): 119-123.
[6] Hannon GJ. RNA interference[J]. Nature, 2002, 418(6894):244-251.
[7] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) Method[J]. Methods, 2001, 25(4): 402-408.[8] Franzin CM, Yu J, Thai K, et al. Correlation of gene and protein structures in the FXYD family proteins[J]. J Mol Biol, 2005, 354(4): 743-750.
[9] Sweadner KJ, Rael E. The FXYD gene family of small ion transport regulators or channels: cDNA sequence, protein signature sequence, and expression[J]. Genomics, 2000,68(1): 41-56.
[10] Lubarski I, Karlish SJ, Garty H. Structural and functional interactions between FXYD5 and the Na+-K+-ATPase[J].Am J Physiol Renal Physiol, 2007, 293(6): F1818-1826.
[11] 方飞, 李小旺, 施翔翔, 等. 自发性高血压大鼠FXYD5基因表达的时空分布[J]. 中国病理生理杂志, 2009, 25(3): 447-450.
[12]Liu L, Askari A. On the importance and mechanism of amplification of digitalis signal through Na+/K+-ATPase[J].Cell Mol Biol (Noisy-le-grand), 2006, 52(8): 28-30.
[13]Spieker C, Zidek W, Rahn KH. Na+, K(+)-ATPase inhibition and intracellular electrolyte content in essential and secondary hypertension[J]. Am J Hypertens, 1991, 4(4 Pt 1):309-314.
[14]Mazzanti L, Rabini RA, Testa I, et al. Sodium metabolism in offspring of hypertensive parents[J]. Biochem Med Metab Biol, 1991, 45(2): 181-187.
[15]Kim S, Iwao H. Involvement of angiotensin II in cardiovascular and renal injury: effects of an AT1-receptor antagonist on gene expression and the cellular phenotype[J]. J Hypertens Suppl, 1997, 15(6): S3-7.
[16]Hsieh CC, Lau Y. Migration of vascular smooth muscle cells is enhanced in cultures derived from spontaneously hypertensive rat[J]. Pflugers Arch, 1998, 435(2): 286-292.

